名校
解题方法
1 . 亚硝酸钙 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。 溶液能将NO氧化为
溶液能将NO氧化为 。
。
回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通 ,其目的是
,其目的是________ 。通 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是________ 。
(2)仪器a的名称为________ ,装置D中盛装的试剂是________ (填名称),装置E的作用是________ 。
(3)制备的产品 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: ;“还原
;“还原 ”时加入
”时加入 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为________ ,样品中 的纯度为
的纯度为________ (用含m、V的式子表示)。
 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。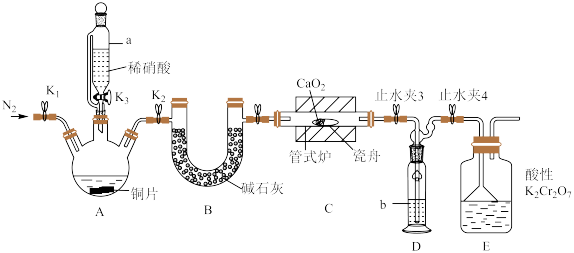
 溶液能将NO氧化为
溶液能将NO氧化为 。
。回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通
 ,其目的是
,其目的是 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是(2)仪器a的名称为
(3)制备的产品
 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: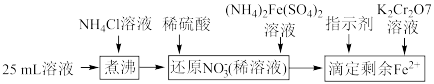
 ;“还原
;“还原 ”时加入
”时加入 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为 的纯度为
的纯度为
您最近一年使用:0次
昨日更新
|
242次组卷
|
6卷引用:广东省梅州市部分学校2024届高三下学期5月联考化学试卷
名校
解题方法
2 . 高砷烟尘(主要成分有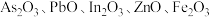 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 ,和金属铟的工业流程如下:
,和金属铟的工业流程如下: 在酸性溶液中以
在酸性溶液中以 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;
② 在
在 易分解为
易分解为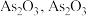 难溶于水;
难溶于水;
③ 。
。
回答下列问题:
(1)滤渣的主要成分为_______ (填化学式)。
(2)“高压酸浸”时, 的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过 时,
时, 的浸出率随硫酸浓度增大而略微减小的原因可能为
的浸出率随硫酸浓度增大而略微减小的原因可能为_______ 。 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ 。已知 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为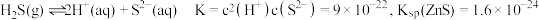 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
_______ 。
(4)“还原”后溶液酸性增强,主要原因是_______ (用离子方程式表示)。
(5)“结晶”操作为_______ 、过滤、洗涤、干燥。
(6)“萃余液”中含有的金属阳离子为_______ (填离子符号),将 溶液电解得到金属铟,阴极的电极反应式为
溶液电解得到金属铟,阴极的电极反应式为_______ 。
(7)硫化铟铜是一种新型的纳米材料,具有优异的光电性能和光催化性能。一种由S、 三种元素组成的化合物的晶胞如图所示。采用
三种元素组成的化合物的晶胞如图所示。采用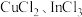 和
和 合成硫化铟铜薄膜,该反应的化学方程式是
合成硫化铟铜薄膜,该反应的化学方程式是_______ ,该晶胞的六个面均为矩形,上、下底面的晶胞参数为 ,高为
,高为 ,晶体密度为
,晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为_______ (用含a、b、d的式子表示)。
 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 ,和金属铟的工业流程如下:
,和金属铟的工业流程如下: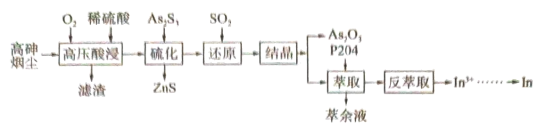
 在酸性溶液中以
在酸性溶液中以 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;②
 在
在 易分解为
易分解为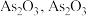 难溶于水;
难溶于水;③
 。
。回答下列问题:
(1)滤渣的主要成分为
(2)“高压酸浸”时,
 的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过 时,
时, 的浸出率随硫酸浓度增大而略微减小的原因可能为
的浸出率随硫酸浓度增大而略微减小的原因可能为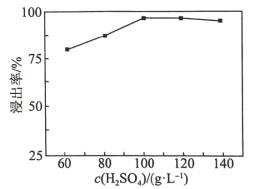
 ,发生反应的离子方程式为
,发生反应的离子方程式为 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为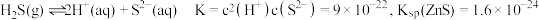 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
(4)“还原”后溶液酸性增强,主要原因是
(5)“结晶”操作为
(6)“萃余液”中含有的金属阳离子为
 溶液电解得到金属铟,阴极的电极反应式为
溶液电解得到金属铟,阴极的电极反应式为(7)硫化铟铜是一种新型的纳米材料,具有优异的光电性能和光催化性能。一种由S、
 三种元素组成的化合物的晶胞如图所示。采用
三种元素组成的化合物的晶胞如图所示。采用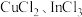 和
和 合成硫化铟铜薄膜,该反应的化学方程式是
合成硫化铟铜薄膜,该反应的化学方程式是 ,高为
,高为 ,晶体密度为
,晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近一年使用:0次
昨日更新
|
139次组卷
|
4卷引用:广东省梅州市部分学校2024届高三下学期5月联考化学试卷
名校
解题方法
3 . 次氯酸盐是常用的水处理剂。有效氯含量(COAC)指与含氯消毒剂氧化能力相当的氯气量,单位为 mol/L;物质氧化性越强,氧化还原电位(ORP)越高;相同条件下,次氯酸的氧化性大于次氯酸盐。温度及pH对Ca(ClO)2溶液有效氯含量(COAC)及氧化还原电位的影响。
(1)在不同温度下,用0.2 mol/L乙酸溶液调节pH得到Ca(ClO)2溶液COAC、ORP的关系如图1室温(25 ℃)、图2(70 ℃)所示。___________ (填“增大”或“减小”)。
②Ca(ClO)2溶液用于消毒时适宜的条件:温度为___________ (填字母,下同)、pH为___________ 。
A. 25 ℃ B. 70 ℃ C. 5.75 D. 6.85
(2)某小组探究70 ℃时,pH及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下:
①设计实验1和2的目的是___________ 。
②实验5中的a___________ 0.935(填“大于”“小于”或“等于”)。
③根据实验3~5,可得出的结论是___________ 。
④下列物质中最适宜作为NaClO溶液稳定剂的是___________ (填字母)。
A. MgCl2 B. NaCl C. Na2S D. CH3COONa
资料:ⅰ.Mn2+在一定条件下被ClO-氧化成MnO2(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
ⅱ.浓碱条件下, 可被OH-还原为
可被OH-还原为 。
。
ⅲ.NaClO的氧化性随碱性增强而减弱。
实验记录如下:
(3)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因。
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①离子方程式表示可能导致溶液碱性减弱的原因:_______________ ,但通过实验测定溶液的碱性变化很小。
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为___________ ,溶液绿色缓慢加深,原因是MnO2被___________ (填化学式)氧化,可证明Ⅲ的悬浊液中氧化剂过量。
③从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:___________ 。
(1)在不同温度下,用0.2 mol/L乙酸溶液调节pH得到Ca(ClO)2溶液COAC、ORP的关系如图1室温(25 ℃)、图2(70 ℃)所示。
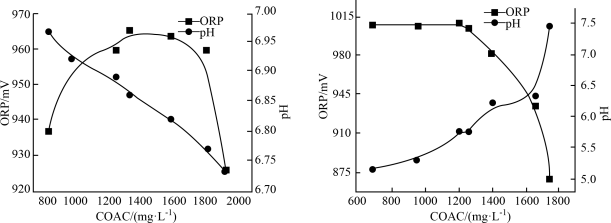
图1 图2
①由图1可知,随着少量乙酸的滴入,Ca(ClO)2溶液的pH在②Ca(ClO)2溶液用于消毒时适宜的条件:温度为
A. 25 ℃ B. 70 ℃ C. 5.75 D. 6.85
(2)某小组探究70 ℃时,pH及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下:
| 序号 | 硅酸钠的质量分数 | 碳酸钠的质量分数 | 初始COAC | pH | 12 h后COAC | 12 h后COAC/初始COAC |
| 1 | 0 | 0 | 1 794 | 8.53 | 1 218 | 0.679 |
| 2 | 0 | 0 | 1 794 | 8.63 | 1 288 | 0.718 |
| 3 | 0.9% | 0.6% | 1 794 | 13.44 | 1 676 | 0.935 |
| 4 | 1.5% | 0 | 1 834 | 13.76 | 1 597 | 0.871 |
| 5 | 0 | 1.5% | 1 834 | 13.66 | - | a |
②实验5中的a
③根据实验3~5,可得出的结论是
④下列物质中最适宜作为NaClO溶液稳定剂的是
A. MgCl2 B. NaCl C. Na2S D. CH3COONa
资料:ⅰ.Mn2+在一定条件下被ClO-氧化成MnO2(棕黑色)、
 (绿色)、
(绿色)、 (紫色)。
(紫色)。ⅱ.浓碱条件下,
 可被OH-还原为
可被OH-还原为 。
。ⅲ.NaClO的氧化性随碱性增强而减弱。
实验记录如下:
| 序号 | Cl2的吸收液 | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 10mL水+5滴0.1mol/L MnSO4溶液 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 10mL5% NaOH溶液+5滴0.1mol/L MnSO4溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 10mL40% NaOH溶液+5滴0.1mol/L MnSO4溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(3)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因。
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①离子方程式表示可能导致溶液碱性减弱的原因:
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
名校
解题方法
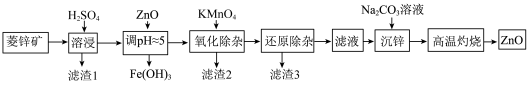
4 . 工业上可由菱锌矿(主要成分为ZnCO3,还含有Ni、Cd、Fe、Mn等元素)制备ZnO。工艺如图所示:
②弱酸性溶液中KMnO4氧化Mn2+时,产物中含Mn元素物质只有MnO2。
③氧化性强弱顺序:Ni2+>Cd2+>Zn2+。
④相关金属离子[c(Mn+)=0.1 mol/L]形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)基态Zn原子的价电子排布式为___________ ,ZnO溶于氨水生成[Zn(NH3)4]2+,1 mol [Zn(NH3)4]2+共有___________ mol的σ键。
(2)①“溶浸”过程中,为了提高浸出率,可采取的措施是___________ 。(写一条即可)
②“调pH”时,可替代ZnO的一种含锌化合物是___________ 。(用化学式表示)
③“调pH”时,若pH=5.5,此时溶液中Zn2+的最大浓度c=___________ mol/L。
(3)写出“氧化除杂”时KMnO4溶液与Mn2+反应的离子方程式___________ 。
(4)“还原除杂”除去的离子是___________ ,加入的还原剂是___________ 。
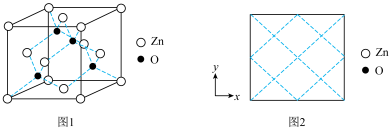
(5)“沉锌”时生成ZnCO3·2Zn(OH)2·2H2O (碱式碳酸锌)沉淀,该沉淀“高温灼烧”后获得ZnO。氧化锌的一种晶体的晶胞是立方晶胞(如图1所示),其中与锌原子距离最近的O原子数有___________ 个,请在图2中画出该晶胞沿z轴方向的平面投影图___________ 。
②弱酸性溶液中KMnO4氧化Mn2+时,产物中含Mn元素物质只有MnO2。
③氧化性强弱顺序:Ni2+>Cd2+>Zn2+。
④相关金属离子[c(Mn+)=0.1 mol/L]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ | Mn2+ | Ni2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.0 | 7.4 | 8.1 | 6.9 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.0 | 9.4 | 10.1 | 8.9 |
(1)基态Zn原子的价电子排布式为
(2)①“溶浸”过程中,为了提高浸出率,可采取的措施是
②“调pH”时,可替代ZnO的一种含锌化合物是
③“调pH”时,若pH=5.5,此时溶液中Zn2+的最大浓度c=
(3)写出“氧化除杂”时KMnO4溶液与Mn2+反应的离子方程式
(4)“还原除杂”除去的离子是
(5)“沉锌”时生成ZnCO3·2Zn(OH)2·2H2O (碱式碳酸锌)沉淀,该沉淀“高温灼烧”后获得ZnO。氧化锌的一种晶体的晶胞是立方晶胞(如图1所示),其中与锌原子距离最近的O原子数有
您最近一年使用:0次
5 . 某研究性学习小组探究硫的化合物的制备和性质。
Ⅰ.制备二氧化硫
用70%的浓硫酸与 固体反应制备
固体反应制备 气体。
气体。 气体最合适的发生装置是
气体最合适的发生装置是___________ (填写字母)。
Ⅱ.制备硫代硫酸钠
已知:硫代硫酸钠易与酸反应。
反应原理: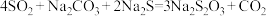
室温时,往 、
、 混合溶液中均匀通入
混合溶液中均匀通入 气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH接近于7时,停止通入
气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH接近于7时,停止通入 气体。
气体。
(2)制备 反应分三步进行
反应分三步进行
反应i: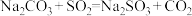 ;
;
反应ii: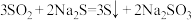 ;
;
反应iii的化学方程式为___________ 。
(3)当pH值接近于7时,停止通入 的原因是
的原因是___________ 。
Ⅲ.探究浓度对反应速率的影响
相同温度下,按下表中的体积将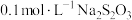 溶液、
溶液、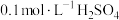 溶液与蒸馏水温合,并采集反应后浑浊度传感器数据。
溶液与蒸馏水温合,并采集反应后浑浊度传感器数据。
通过实验绘制出的浑浊度随时间变化关系如图所示:
___________ (实验标号)探究H2SO4溶液浓度对反应速率的影响。
②请在图中画出实验 对应的曲线
对应的曲线___________ 。
Ⅳ.探究性质
资料:
(5) 在酸性溶液中氧化I-,反应为:
在酸性溶液中氧化I-,反应为:___________ 。
向某浓度的过量 酸性溶液(含淀粉)中通入一定量SO2后,停止通气,刚开始时溶液无明显变化,t秒后溶液突然变蓝。
酸性溶液(含淀粉)中通入一定量SO2后,停止通气,刚开始时溶液无明显变化,t秒后溶液突然变蓝。
某实验小组提出假设:t秒前生成了 ,但
,但 继续与溶液中的
继续与溶液中的 反应,且该反应速率较快,故溶液没有立刻变蓝,是由于
反应,且该反应速率较快,故溶液没有立刻变蓝,是由于 与
与 反应SO2+I2+2H2O=2I—+SO
反应SO2+I2+2H2O=2I—+SO +4H+
+4H+
(6)为验证该实验小组的假设合理,设计下面实验:
操作:向变蓝色的溶液中___________ ;可观察到现象为:蓝色迅速消失,一段时间后再次变蓝。
应用:写出一个SO2相关性质在日常生活生产中的用途___________ 。
Ⅰ.制备二氧化硫
用70%的浓硫酸与
 固体反应制备
固体反应制备 气体。
气体。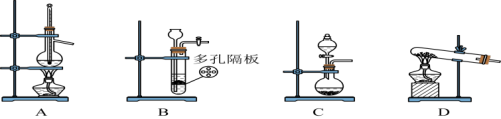
 气体最合适的发生装置是
气体最合适的发生装置是Ⅱ.制备硫代硫酸钠
已知:硫代硫酸钠易与酸反应。
反应原理:
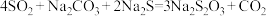
室温时,往
 、
、 混合溶液中均匀通入
混合溶液中均匀通入 气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH接近于7时,停止通入
气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH接近于7时,停止通入 气体。
气体。(2)制备
 反应分三步进行
反应分三步进行反应i:
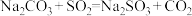 ;
;反应ii:
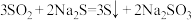 ;
;反应iii的化学方程式为
(3)当pH值接近于7时,停止通入
 的原因是
的原因是Ⅲ.探究浓度对反应速率的影响
相同温度下,按下表中的体积将
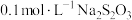 溶液、
溶液、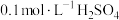 溶液与蒸馏水温合,并采集反应后浑浊度传感器数据。
溶液与蒸馏水温合,并采集反应后浑浊度传感器数据。| 实验标号 | 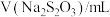 | 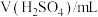 | V(蒸馏水)/mL |
| A | 1.5 | 3.5 | 10 |
| B | 2.5 | 3.5 | 9 |
| C | 3.5 | 3.5 | 8 |
| D | 3.5 | 2.5 | 9 |
| E | 3.5 | 1.5 | 10 |
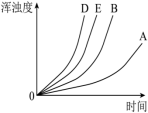
②请在图中画出实验
 对应的曲线
对应的曲线Ⅳ.探究性质
资料:
(5)
 在酸性溶液中氧化I-,反应为:
在酸性溶液中氧化I-,反应为:向某浓度的过量
 酸性溶液(含淀粉)中通入一定量SO2后,停止通气,刚开始时溶液无明显变化,t秒后溶液突然变蓝。
酸性溶液(含淀粉)中通入一定量SO2后,停止通气,刚开始时溶液无明显变化,t秒后溶液突然变蓝。某实验小组提出假设:t秒前生成了
 ,但
,但 继续与溶液中的
继续与溶液中的 反应,且该反应速率较快,故溶液没有立刻变蓝,是由于
反应,且该反应速率较快,故溶液没有立刻变蓝,是由于 与
与 反应SO2+I2+2H2O=2I—+SO
反应SO2+I2+2H2O=2I—+SO +4H+
+4H+(6)为验证该实验小组的假设合理,设计下面实验:
操作:向变蓝色的溶液中
应用:写出一个SO2相关性质在日常生活生产中的用途
您最近一年使用:0次
名校
6 . 某小组在实验室用NaClO溶液和NH3反应制备肼(N2H4),并进行相关性质探究实验。
Ⅰ.实验室制备N2H4___________ 。
(2)装置长颈漏斗的作用___________ 。
(3)制备N2H4的离子方程式___________ 。
Ⅱ.测定产品中水合肼(N2H4·H2O)的含量
(4)称取产品6.0g,加入适量NaHCO3固体(调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol/L的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①滴定到达终点的现象是___________ 。
②重复上述滴定实验2~3次,测得消耗碘标准溶液的平均值为20.00mL,产品中水合肼的质量分数为___________ 。
Ⅲ.探究肼的化学性质。将制得的肼分离提纯后,进行如下实验。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】
(5)设计如下方案,进行实验。
③综合上述实验,肼具有的性质是___________
(6)N2H4是一种二元弱碱,在水中的电离与NH3相似,写出肼的第一步电离方程式___________ 。
Ⅰ.实验室制备N2H4

(2)装置长颈漏斗的作用
(3)制备N2H4的离子方程式
Ⅱ.测定产品中水合肼(N2H4·H2O)的含量
(4)称取产品6.0g,加入适量NaHCO3固体(调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol/L的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①滴定到达终点的现象是
②重复上述滴定实验2~3次,测得消耗碘标准溶液的平均值为20.00mL,产品中水合肼的质量分数为
Ⅲ.探究肼的化学性质。将制得的肼分离提纯后,进行如下实验。

【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】
(5)设计如下方案,进行实验。
| 操作 | 现象 | 结论 |
| ⅰ.取少量黑色固体于试管中,加入足量① | 黑色固体部分溶解 | 黑色固体有Ag2O |
| ⅱ.取少量黑色固体于试管中,加入足量稀硝酸,振荡。 | ② | 黑色固体是Ag和Ag2O |
(6)N2H4是一种二元弱碱,在水中的电离与NH3相似,写出肼的第一步电离方程式
您最近一年使用:0次
解题方法
7 . 锂离子电池广泛应用于便携式电动设备,某锂离子电池废料含Li、Fe、Co等金属及其氧化物,回收利用其废料的一种简化工艺流程如下: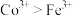 ;
;
②常温下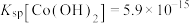 ,
,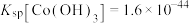 。
。
(1)写出铁的价层电子排布式___________ 。
(2)写出“酸浸”时金属Co与稀 反应的化学方程式
反应的化学方程式___________ ;“酸浸”后溶液中的金属阳离子主要有 、
、___________ 。
(3)“沉铁”反应的离子方程式是___________ ,“沉钴”时 溶液的作用是
溶液的作用是___________ 。
(4)已知 是微溶于水的强电解质,其饱和水溶液的浓度与温度关系如图所示,在a点对应条件下进行“沉锂”,若“沉锂”后溶液
是微溶于水的强电解质,其饱和水溶液的浓度与温度关系如图所示,在a点对应条件下进行“沉锂”,若“沉锂”后溶液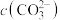 为
为 ,求
,求 =
=___________ (写出计算过程,保留两位有效数字)。 距离最近且相等的
距离最近且相等的 有
有___________ 个;设 与
与 的最近的核间距为r nm,CoO晶体的密度为
的最近的核间距为r nm,CoO晶体的密度为___________  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值);该晶胞若沿体对角线投影,则
为阿伏加德罗常数的值);该晶胞若沿体对角线投影,则 的投影图为
的投影图为___________ (填字母选项)。

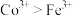 ;
;②常温下
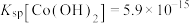 ,
,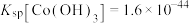 。
。(1)写出铁的价层电子排布式
(2)写出“酸浸”时金属Co与稀
 反应的化学方程式
反应的化学方程式 、
、(3)“沉铁”反应的离子方程式是
 溶液的作用是
溶液的作用是(4)已知
 是微溶于水的强电解质,其饱和水溶液的浓度与温度关系如图所示,在a点对应条件下进行“沉锂”,若“沉锂”后溶液
是微溶于水的强电解质,其饱和水溶液的浓度与温度关系如图所示,在a点对应条件下进行“沉锂”,若“沉锂”后溶液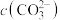 为
为 ,求
,求 =
=
 距离最近且相等的
距离最近且相等的 有
有 与
与 的最近的核间距为r nm,CoO晶体的密度为
的最近的核间距为r nm,CoO晶体的密度为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值);该晶胞若沿体对角线投影,则
为阿伏加德罗常数的值);该晶胞若沿体对角线投影,则 的投影图为
的投影图为

您最近一年使用:0次
解题方法
8 . 某小组在做铜与浓硫酸(装置如下图)的反应实验时,发现有如下的反应现象:
 呈黄色,
呈黄色, 呈蓝色,两者混合则成绿色,铜的化合物中
呈蓝色,两者混合则成绿色,铜的化合物中 、
、 、
、 都为黑色,其中
都为黑色,其中 溶于盐酸;
溶于盐酸; 、
、 不溶于稀盐酸,但溶于浓盐酸。
不溶于稀盐酸,但溶于浓盐酸。
(1)铜丝与浓硫酸反应的化学方程式为___________ 。
(2)试管中品红溶液褪色,体现 的
的___________ 性,浸 溶液的棉团作用是
溶液的棉团作用是___________ 。
(3)甲组同学对实验中形成的墨绿色溶液进行探究,特进行下列实验:
请解释形成墨绿色的原因:___________ 。
(4)乙组同学对白雾的成分经检验为 ,请设计实验证明该白雾为硫酸:
,请设计实验证明该白雾为硫酸:___________ 。
(5)丙组同学进一步对灰白色沉淀通过加水溶解、过滤,最后沉淀为黑色,取其黑色沉淀,进行成分探究:滴加适量稀盐酸,则发现黑色沉淀几乎不溶解,溶液也不变蓝,则说明黑色沉淀中不含有___________ 。滴加适量浓盐酸,振荡,加热,观察到黑色沉淀几乎完全溶解,生成呈略黄色的 。写出
。写出 与浓盐酸反应的离子方程式:
与浓盐酸反应的离子方程式:___________ 。
(6)某工厂将热空气通入稀硫酸中来溶解废铜屑制备 ,消耗含铜元素80%的废铜屑240kg固体时,得到500kg产品,产率为
,消耗含铜元素80%的废铜屑240kg固体时,得到500kg产品,产率为___________ (结果保留两位小数)。
| 序号 | 操作 | 现象 |
| ① | 加热 | 铜丝表面变黑 |
| ② | 继续加热 | 有大量气泡产生,溶液变为墨绿色浊液,试管底部开始有灰白色沉淀生成。品红溶液褪色。 |
| ③ | 再加热 | 试管中出现“白雾”,浊液逐渐变为澄清,溶液颜色慢慢变为浅蓝色,试管底部灰白色沉淀增多 |
| ④ | 冷却,将灰白色固体倒入水中 | 形成蓝色溶液 |
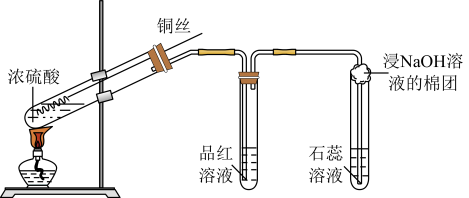
 呈黄色,
呈黄色, 呈蓝色,两者混合则成绿色,铜的化合物中
呈蓝色,两者混合则成绿色,铜的化合物中 、
、 、
、 都为黑色,其中
都为黑色,其中 溶于盐酸;
溶于盐酸; 、
、 不溶于稀盐酸,但溶于浓盐酸。
不溶于稀盐酸,但溶于浓盐酸。(1)铜丝与浓硫酸反应的化学方程式为
(2)试管中品红溶液褪色,体现
 的
的 溶液的棉团作用是
溶液的棉团作用是(3)甲组同学对实验中形成的墨绿色溶液进行探究,特进行下列实验:
| 操作 | 现象 | |
| Ⅰ组 | 直接取其铜丝(表面有聚氯乙烯薄膜)做实验 | 溶液变成墨绿色 |
| Ⅱ组 | 实验前,先将铜丝进行灼烧处理 | 溶液变蓝 |
(4)乙组同学对白雾的成分经检验为
 ,请设计实验证明该白雾为硫酸:
,请设计实验证明该白雾为硫酸:(5)丙组同学进一步对灰白色沉淀通过加水溶解、过滤,最后沉淀为黑色,取其黑色沉淀,进行成分探究:滴加适量稀盐酸,则发现黑色沉淀几乎不溶解,溶液也不变蓝,则说明黑色沉淀中不含有
 。写出
。写出 与浓盐酸反应的离子方程式:
与浓盐酸反应的离子方程式:(6)某工厂将热空气通入稀硫酸中来溶解废铜屑制备
 ,消耗含铜元素80%的废铜屑240kg固体时,得到500kg产品,产率为
,消耗含铜元素80%的废铜屑240kg固体时,得到500kg产品,产率为
您最近一年使用:0次
解题方法
9 . 工业上,处理低品位黄铜矿[二硫化亚铁铜( )]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(
)]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾( )和胆矾(
)和胆矾( )。相关流程如下图。
)。相关流程如下图。 1.0~6.0范围内可保持活性。
1.0~6.0范围内可保持活性。
②金属离子沉淀的pH如下表。
(1)Cu2+价电子轨道表示式为___________ ,生物堆浸前,需先将矿石进行研磨,目的是___________ 。
(2)生物堆浸过程的反应在T。f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为: 。第二阶段反应为
。第二阶段反应为 继续被氧化转变成
继续被氧化转变成 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(3)结合已知推断:生物堆浸过程中,应控制溶液的 在
在___________ 范围内。
(4)过程Ⅰ中,加入 固体还原堆浸液中的
固体还原堆浸液中的 ,得到溶液X。为判断堆浸液中
,得到溶液X。为判断堆浸液中 是否被还原完全,可取少量溶液X,向其中加入
是否被还原完全,可取少量溶液X,向其中加入___________ ,说明Fe3+已被完全还原。
(5)过程Ⅱ中,用 和稀硫酸处理后,
和稀硫酸处理后,
完全溶解 ,用离子方程式表示 的作用是
的作用是___________ 。
(6)绿矾的纯度可通过 滴定法测定。取
滴定法测定。取 绿矾晶体,加适量稀硫酸溶解。用物质的量浓度为cmol/L的
绿矾晶体,加适量稀硫酸溶解。用物质的量浓度为cmol/L的 溶液滴定,滴定终点的判定方法是
溶液滴定,滴定终点的判定方法是___________ 。至恰好完全反应时,消耗 溶液的体积为
溶液的体积为 。绿矾晶体质量分数的计算式为
。绿矾晶体质量分数的计算式为___________ 。
 )]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(
)]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾( )和胆矾(
)和胆矾( )。相关流程如下图。
)。相关流程如下图。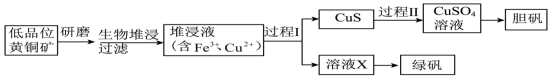
 1.0~6.0范围内可保持活性。
1.0~6.0范围内可保持活性。②金属离子沉淀的pH如下表。
| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀时的pH | 1.5 | 4.2 | 6.3 |
| 完全沉淀时的pH | 2.8 | 6.7 | 8.3 |
(2)生物堆浸过程的反应在T。f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为:
 。第二阶段反应为
。第二阶段反应为 继续被氧化转变成
继续被氧化转变成 ,反应的离子方程式为
,反应的离子方程式为(3)结合已知推断:生物堆浸过程中,应控制溶液的
 在
在(4)过程Ⅰ中,加入
 固体还原堆浸液中的
固体还原堆浸液中的 ,得到溶液X。为判断堆浸液中
,得到溶液X。为判断堆浸液中 是否被还原完全,可取少量溶液X,向其中加入
是否被还原完全,可取少量溶液X,向其中加入(5)过程Ⅱ中,用
 和稀硫酸处理后,
和稀硫酸处理后,
 的作用是
的作用是(6)绿矾的纯度可通过
 滴定法测定。取
滴定法测定。取 绿矾晶体,加适量稀硫酸溶解。用物质的量浓度为cmol/L的
绿矾晶体,加适量稀硫酸溶解。用物质的量浓度为cmol/L的 溶液滴定,滴定终点的判定方法是
溶液滴定,滴定终点的判定方法是 溶液的体积为
溶液的体积为 。绿矾晶体质量分数的计算式为
。绿矾晶体质量分数的计算式为
您最近一年使用:0次
名校
解题方法
10 . 含氮物质是一类常见物质,在人们的生产、生活活动中有重要作用。
(1)实验室中,采用一定浓度的NaNO2溶液和NH4Cl溶液作为反应物,通过加热制备少量N2。_______ ,收集N2的方法是_______ (填标号)。
②实验小组同学设计以下实验探究上述反应的速率与c(NaNO2)的关系
③V1=_______ ,V3=_______ 。
④已知该反应的速率方程为 ,k为反应速率常数。根据上述实验数据,m=
,k为反应速率常数。根据上述实验数据,m=_______ (填整数)。
(2)“侯氏制碱法”是中国人的骄傲,上述实验中需用到的NH4Cl是“侯氏制碱法”的副产物。实验小组模拟“侯氏制碱法”的原理,在实验室中制备少量NaHCO3,使用的装置如下图:_______ ←d(填接口序号);由该装置可知,该实验中制备NH3需用到的试剂是_______ (填化学式)。
(3)实验小组在实验中,将1.0mol·L-1NaNO2溶液滴入pH=0.5的1.0mol·L-1FeSO4溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①查阅资料常温下,[Fe(NO)]2+在溶液中能稳定存在,溶液为棕色,受热分解释放出NO。
②提出猜想溶液的棕色来源于[Fe(NO)]2+,且[Fe(NO)]2+的颜色掩盖了Fe3+的黄色。
③设计实验、验证猜想
④实验现象及分析
i.实验5溶液变红色,说明溶液中存在Fe3+,Fe3+的来源是_______ (写出离子方程式);
ii.实验6观察到_______ (填实验现象),证明溶液呈棕色是因为存在[Fe(NO)]2+,且其颜色掩盖了Fe3+的黄色。
(1)实验室中,采用一定浓度的NaNO2溶液和NH4Cl溶液作为反应物,通过加热制备少量N2。

②实验小组同学设计以下实验探究上述反应的速率与c(NaNO2)的关系
| 实验编号 | 溶液体积/mL | 收集1.0mLN2所用时间/s | |||
| NaNO2溶液 | NH4Cl溶液 | 醋酸 | 水 | ||
| 1 | 4.0 | 4.0 | 4.0 | 8.0 | 334 |
| 2 | V1 | 4.0 | 4.0 | V3 | 150 |
| 3 | 8.0 | 4.0 | 4.0 | 4.0 | 83 |
| 4 | 12.0 | 4.0 | 4.0 | 0.0 | 38 |
④已知该反应的速率方程为
 ,k为反应速率常数。根据上述实验数据,m=
,k为反应速率常数。根据上述实验数据,m=(2)“侯氏制碱法”是中国人的骄傲,上述实验中需用到的NH4Cl是“侯氏制碱法”的副产物。实验小组模拟“侯氏制碱法”的原理,在实验室中制备少量NaHCO3,使用的装置如下图:

(3)实验小组在实验中,将1.0mol·L-1NaNO2溶液滴入pH=0.5的1.0mol·L-1FeSO4溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①查阅资料常温下,[Fe(NO)]2+在溶液中能稳定存在,溶液为棕色,受热分解释放出NO。
②提出猜想溶液的棕色来源于[Fe(NO)]2+,且[Fe(NO)]2+的颜色掩盖了Fe3+的黄色。
③设计实验、验证猜想
| 实验编号 | 5 | 6 |
| 操作方法 | 取上述滴有NaNO2溶液的棕色混合液,向其中滴加稀KSCN溶液 | 取上述棕色混合液,按下图所示加热
|
i.实验5溶液变红色,说明溶液中存在Fe3+,Fe3+的来源是
ii.实验6观察到
您最近一年使用:0次




