| A.生成的Na2SO3和Na2S的物质的量之比为2:1 |
| B.也可以用CS2清洗试管壁上的硫 |
| C.该反应中硫单质既做氧化剂也做还原剂 |
| D.氧化产物是Na2SO3 |

(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为
(3)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为
(4)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是
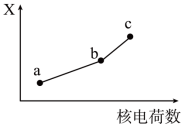
| A.若a、b、c表示氧族元素,则X表示对应氢化物的稳定性 |
| B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
| C.若a、b、c表示第IA族元素,则X表示对应离子的氧化性 |
| D.若a、b、c表示第IIA族元素,则X表示最高价氧化物对应水化物的碱性 |
3 . Na2S2O3标准溶液是氧化还原反应中常用的还原性标定试剂,但是 固体通常含有一些杂质,且易风化和潮解,Na2S2O3溶液也容易被O2氧化。因此,Na2S2O3标准溶液配制好后常用
固体通常含有一些杂质,且易风化和潮解,Na2S2O3溶液也容易被O2氧化。因此,Na2S2O3标准溶液配制好后常用 进行标定。但是由于
进行标定。但是由于 与Na2S2O3反应的产物有很多种,不能按确定的反应式进行,故无法通过氧化还原滴定法确定浓度。故应先用
与Na2S2O3反应的产物有很多种,不能按确定的反应式进行,故无法通过氧化还原滴定法确定浓度。故应先用 与过量的KI反应,定量生成
与过量的KI反应,定量生成 ,再用Na2S2O3滴定
,再用Na2S2O3滴定 ,发生反应的化学方程式为:
,发生反应的化学方程式为: 、
、 。我们将这种
。我们将这种 与
与 联用的方法称为碘量法,碘量法是分析化学中常用的分析方法,常用于一些无法直接滴定的反应的物质的间接滴定。
联用的方法称为碘量法,碘量法是分析化学中常用的分析方法,常用于一些无法直接滴定的反应的物质的间接滴定。
已知: 与KI的反应需要一定时间才能进行得比较完全,故需放置约5 min。
与KI的反应需要一定时间才能进行得比较完全,故需放置约5 min。
(1)
 标准溶液的配制:
标准溶液的配制:①配制480 mL 0.1 mol/L的 标准溶液需要用到的玻璃仪器有:玻璃棒、烧杯、量筒、胶头滴管、
标准溶液需要用到的玻璃仪器有:玻璃棒、烧杯、量筒、胶头滴管、
②将下述实验步骤A到F按实验过程先后次序排列
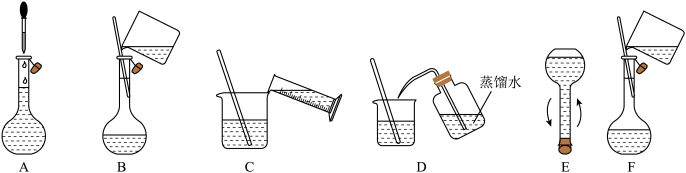
(2)
 标准溶液的标定:取20.00 mL 0.017 mol/L
标准溶液的标定:取20.00 mL 0.017 mol/L  溶液于250 mL锥形瓶中,加5 mL 6 mol/L HCl溶液,再加入10 mL 100 g/L KI溶液,摇匀后用牛皮纸扎紧瓶口,静置约5分钟。用
溶液于250 mL锥形瓶中,加5 mL 6 mol/L HCl溶液,再加入10 mL 100 g/L KI溶液,摇匀后用牛皮纸扎紧瓶口,静置约5分钟。用 溶液滴定至浅黄色后加入2 mL淀粉指示剂,继续滴定至终点,平行测定3次,计算
溶液滴定至浅黄色后加入2 mL淀粉指示剂,继续滴定至终点,平行测定3次,计算 标准溶液的浓度。
标准溶液的浓度。①用 溶液。
溶液。
②加入KI摇匀后用牛皮纸扎紧瓶口的目的是
③如何判定滴定结束?
④列式并计算 标准溶液的浓度。
标准溶液的浓度。
| KI溶液 |
|
|
20.00 mL 0.017 mol/L | 10 mL 100 g/L | 20.35 | |
20.45 | |||
20.40 | |||
21.20 |
(3)借鉴(2)的方法,用碘量法测量
 溶液的物质的量浓度:量取25.00 mL待测液于250 mL锥形瓶中,加入2 mol/L
溶液的物质的量浓度:量取25.00 mL待测液于250 mL锥形瓶中,加入2 mol/L  溶液25 mL,再加入10% KI溶液10 mL,然后用已知浓度的
溶液25 mL,再加入10% KI溶液10 mL,然后用已知浓度的 溶液滴定到淡黄色,加0.5%的淀粉溶液3 mL,用
溶液滴定到淡黄色,加0.5%的淀粉溶液3 mL,用 溶液继续滴定至终点。
溶液继续滴定至终点。①滴定时需加入硫酸。能否用盐酸代替硫酸,为什么?
②写出 溶液与KI反应的离子方程式
溶液与KI反应的离子方程式
(4)借鉴(3)的方法,某小组用碘量法测量磷酸铁锂溶液中
 的物质的量浓度。
的物质的量浓度。提出问题: 与
与 是可逆反应,
是可逆反应, 的存在是否会影响滴定?
的存在是否会影响滴定?
实验验证:①在磷酸铁锂溶液中加入过量的KI,静置一段时间后,加入KSCN,观察到溶液颜色变红;请写出 与
与 反应的离子方程式:
反应的离子方程式:
②取标准量的磷酸铁锂溶液,分成两组,其中一组加入过量的KI溶液,另一组加入等量的水。再分别使用 溶液进行标定,发现消耗的
溶液进行标定,发现消耗的 溶液体积相同。
溶液体积相同。
实验小结: 是否会影响滴定:
是否会影响滴定:
 和
和 ,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。
,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。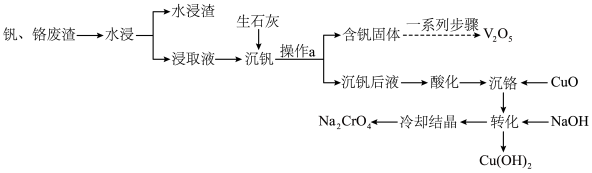
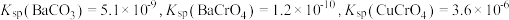 。
。回答下列问题:
(1)基态铬原子价电子轨道表示式为
(2)钒、铬废渣“水浸”前,先要进行粉碎处理,为提高浸取效率,还可采取的措施有
(3)“沉钒”的含钒产物为钒酸钙
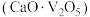 ,该过程中发生反应的化学方程式是
,该过程中发生反应的化学方程式是(4)“沉铬”时,铬转化为
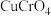 沉淀,“转化”过程中发生反应的离子方程式为
沉淀,“转化”过程中发生反应的离子方程式为(5)向“沉钒后液”中加入足量
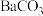 ,可将其中的铬转化为
,可将其中的铬转化为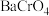 沉淀,铬的理论转化率为
沉淀,铬的理论转化率为 。
。(6)复合材料氧铬酸钙的立方晶胞如下图所示。
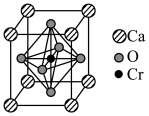
②已知该晶体的密度为
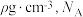 为阿伏加德罗常数的值,则相邻
为阿伏加德罗常数的值,则相邻 与
与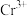 之间的最短距离为
之间的最短距离为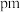 (列出计算式即可)。
(列出计算式即可)。
A.向NaHSO4中滴加少量Ba(HCO3)2溶液: |
B.向有AgCl沉淀的溶液中滴加氨水,沉淀消失: |
C.向FeI2溶液中通入一定量氯气,测得有50%的Fe2+被氧化: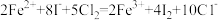 |
D.NaHCO3的水解: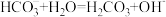 |
 )、粉尘和少量水蒸气。课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图所示:
)、粉尘和少量水蒸气。课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图所示: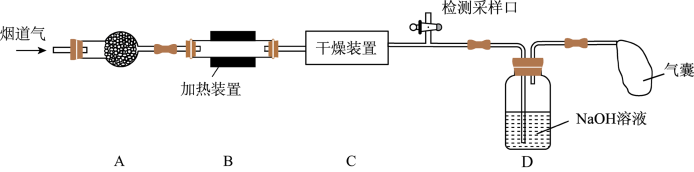
(1)装置A中放置无碱玻璃棉,其目的是除去
a.碱石灰 b.浓硫酸 c.五水合硫酸铜(
 )
)(2)装置D中主要发生:
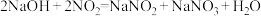 ;
;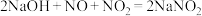

①若反应后尾气无残留,则参加反应的
 、NO物质的量比值为
、NO物质的量比值为a.≥1 b.≤1 c.任意值
②可使用适量酸性
 溶液,将溶液中的NO
溶液,将溶液中的NO 全部氧化为
全部氧化为 ,发生反应的离子方程式是
,发生反应的离子方程式是(3)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性NaClO溶液来处理,HClO氧化NO生成
 和
和 ,发生反应的离子方程式是
,发生反应的离子方程式是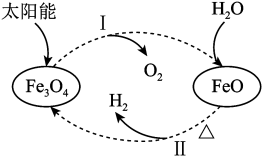
| A.过程I将太阳能转化为化学能 |
B.该转化过程中 为催化剂 为催化剂 |
C.过程I的化学方程式为: |
D.过程Ⅱ的反应中FeO为还原剂、 为氧化产物 为氧化产物 |
 (杂质为石英等)产生的红渣为原料制备铵铁蓝
(杂质为石英等)产生的红渣为原料制备铵铁蓝 颜料(该物质难溶于水)。工艺流程如图:
颜料(该物质难溶于水)。工艺流程如图:
已知:
 溶液中存在的主要离子为
溶液中存在的主要离子为 和
和 ;
; 为阿伏加德罗常数。回答下列问题:
为阿伏加德罗常数。回答下列问题:(1)在空气中焙烧黄铁矿的化学方程式为:
(2)工序①经过蒸发浓缩、冷却结晶、过滤洗涤得到一种含7个结晶水的晶体为:
(3)沉铁工序产生的白色沉淀
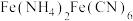 中阴离子是由
中阴离子是由 和
和 结合形成的,
结合形成的, 的电子式与氮气的电子式相似,请写出
的电子式与氮气的电子式相似,请写出 的电子式:
的电子式:(4)氧化工序发生反应的离子方程式为
(5)若用还原工序得到的滤液制备
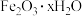 和
和 ,所加试剂为
,所加试剂为
A.该过程中可得到化工产品 |
B.该工艺流程是除去煤燃烧时产生的 |
| C.该过程中化合价发生改变的元素为Fe和S |
D.图中涉及的反应之一为 |
 及铵盐都是重要的化工原料,在工业生产和生活中有广泛的应用。
及铵盐都是重要的化工原料,在工业生产和生活中有广泛的应用。(1)氨气的制备

②欲收集一瓶干燥的氨气,选择图中的装置,其连接顺序为:发生装置→
(2)按如图装置进行
 性质实验。
性质实验。
②再打开旋塞2,B瓶中的现象是
(3)氯的氧化物(
 )是大气污染物之一,工业上在一定温度和催化剂条件下
)是大气污染物之一,工业上在一定温度和催化剂条件下 将
将 转化为无污染的
转化为无污染的 ,写出其反应的化学方程式
,写出其反应的化学方程式




