名校
解题方法
1 . 亚硝酸钙 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。 溶液能将NO氧化为
溶液能将NO氧化为 。
。
回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通 ,其目的是
,其目的是________ 。通 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是________ 。
(2)仪器a的名称为________ ,装置D中盛装的试剂是________ (填名称),装置E的作用是________ 。
(3)制备的产品 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: ;“还原
;“还原 ”时加入
”时加入 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为________ ,样品中 的纯度为
的纯度为________ (用含m、V的式子表示)。
 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。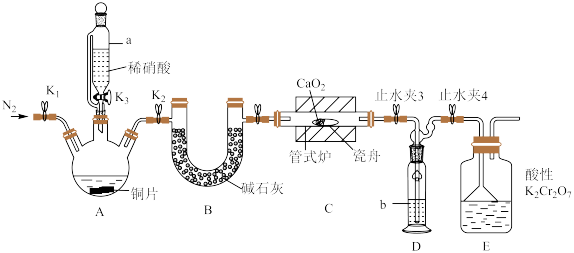
 溶液能将NO氧化为
溶液能将NO氧化为 。
。回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通
 ,其目的是
,其目的是 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是(2)仪器a的名称为
(3)制备的产品
 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: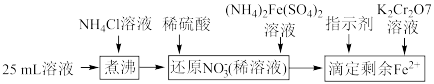
 ;“还原
;“还原 ”时加入
”时加入 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为 的纯度为
的纯度为
您最近一年使用:0次
昨日更新
|
242次组卷
|
6卷引用:广东省梅州市部分学校2024届高三下学期5月联考化学试卷
名校
解题方法
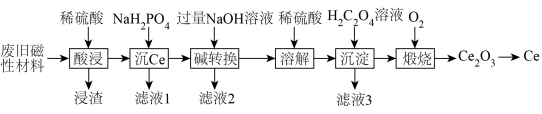
2 . 稀土金属(RE)属于战略性金属,我国的稀土提炼技术位于世界领先地位。一种从废旧磁性材料[主要成分为铈(Ce)、Al、Fe和少量不溶于酸的杂质]中回收稀土金属Ce的工艺流程如图所示。
(1)为提高酸浸的速率,可采取的措施为___________ (写一条即可)。
(2)常温下,“酸浸”后测得溶液中c(Fe2+)=1.0mol/L,c(Ce3+)=0.01mol/L,则“沉Ce”时,为了使Al3+完全沉淀,但不引人Fe(OH)2和Ce(OH)3,需要调节溶液的pH范围为___________ 。
(3)“碱转换”过程中Ce(H2PO4)所发生反应的离子方程式为___________ ,“滤液2”中铝元素的存在形式为___________ (填化学式)。
(4)“沉淀”后所得的固体为Ce2(C2O4)3·10H2O,将其煅烧可得Ce2O3和一种无毒的气体,发生反应的化学方程式为___________ 。
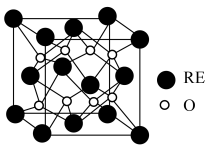
(5)某稀土金属氧化物的立方晶胞如图所示,则该氧化物的化学式为___________ ,距离RE原子最近的O原子有___________ 个。若M(晶胞)=Mg/mol,晶胞边长为anm,NA为阿伏加德罗常数的值,则晶胞的密度为___________ g/cm3(列出计算式)。
(1)为提高酸浸的速率,可采取的措施为
(2)常温下,“酸浸”后测得溶液中c(Fe2+)=1.0mol/L,c(Ce3+)=0.01mol/L,则“沉Ce”时,为了使Al3+完全沉淀,但不引人Fe(OH)2和Ce(OH)3,需要调节溶液的pH范围为
(3)“碱转换”过程中Ce(H2PO4)所发生反应的离子方程式为
(4)“沉淀”后所得的固体为Ce2(C2O4)3·10H2O,将其煅烧可得Ce2O3和一种无毒的气体,发生反应的化学方程式为
(5)某稀土金属氧化物的立方晶胞如图所示,则该氧化物的化学式为
您最近一年使用:0次
2024-03-31更新
|
1063次组卷
|
4卷引用:2024届广东省梅州市兴宁市第一中学高三下学期二模化学试题
2024届广东省梅州市兴宁市第一中学高三下学期二模化学试题2024届广东省肇庆市高三上学期二模化学试题(已下线)题型10 工艺流程题(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)化学(广东卷02)-2024年高考押题预测卷
解题方法
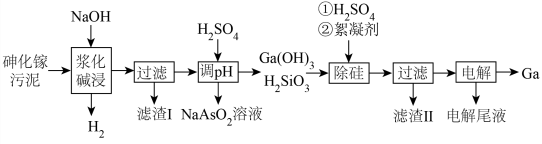
3 . 镓( )是重要的稀有金属之一,主要应用于半导体行业。一种从砷化镓污泥(主要成分为
)是重要的稀有金属之一,主要应用于半导体行业。一种从砷化镓污泥(主要成分为 )中回收镓的工艺流程如图所示:
)中回收镓的工艺流程如图所示:
已知:Ⅰ.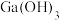 是两性氢氧化物,既能溶于强酸又能溶于强碱;
是两性氢氧化物,既能溶于强酸又能溶于强碱;
Ⅱ. 为灰白色固体,易溶于水,具有还原性。
为灰白色固体,易溶于水,具有还原性。
回答下列问题:
(1)“浆化碱浸”过程中 反应的离子方程式为
反应的离子方程式为________ ;“滤渣Ⅰ”的成分为______ (填化学式)。
(2)中和“调 ”沉镓和硅的过程中,保持
”沉镓和硅的过程中,保持 约为6,若
约为6,若 过低镓的回收率将降低,其原因是
过低镓的回收率将降低,其原因是_______ 。
(3)“除硅”时,镓和硅在溶液中的含量如表所示,由表可知,“除硅”的 调节至
调节至______ 范围内,沉淀效果最好;此过程中,加入絮凝剂的目的是_______ 。
(4) 溶液经
溶液经_________ 、______ 、抽滤、洗涤、干燥得 晶体。
晶体。
(5)用惰性电极电解得到电解尾液和 ,电解尾液可在
,电解尾液可在______ (填操作单元名称)过程中循环使用,提高经济效益。
(6) 可生成
可生成 氮化镓等半导体材料,
氮化镓等半导体材料, 氮化镓晶胞结构如图,黑球代表
氮化镓晶胞结构如图,黑球代表 ,白球代表
,白球代表 ,晶胞参数为
,晶胞参数为 。
。
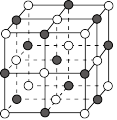
① 氮化镓晶体中每个
氮化镓晶体中每个 原子周围最近的
原子周围最近的 原子的个数为
原子的个数为_____ 。
②距离最近的两个 原子之间的距离为
原子之间的距离为_______  (用含
(用含 的代数式表示)。
的代数式表示)。
 )是重要的稀有金属之一,主要应用于半导体行业。一种从砷化镓污泥(主要成分为
)是重要的稀有金属之一,主要应用于半导体行业。一种从砷化镓污泥(主要成分为 )中回收镓的工艺流程如图所示:
)中回收镓的工艺流程如图所示:
已知:Ⅰ.
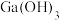 是两性氢氧化物,既能溶于强酸又能溶于强碱;
是两性氢氧化物,既能溶于强酸又能溶于强碱;Ⅱ.
 为灰白色固体,易溶于水,具有还原性。
为灰白色固体,易溶于水,具有还原性。回答下列问题:
(1)“浆化碱浸”过程中
 反应的离子方程式为
反应的离子方程式为(2)中和“调
 ”沉镓和硅的过程中,保持
”沉镓和硅的过程中,保持 约为6,若
约为6,若 过低镓的回收率将降低,其原因是
过低镓的回收率将降低,其原因是(3)“除硅”时,镓和硅在溶液中的含量如表所示,由表可知,“除硅”的
 调节至
调节至 |  |  |
| 0.0 | 2500 | 1345 |
| 0.5 | 2456 | 1267 |
| 1.0 | 2438 | 81 |
| 1.5 | 2420 | 103 |
| 2.0 | 2200 | 804 |
| 2.5 | 1879 | 952 |
(4)
 溶液经
溶液经 晶体。
晶体。(5)用惰性电极电解得到电解尾液和
 ,电解尾液可在
,电解尾液可在(6)
 可生成
可生成 氮化镓等半导体材料,
氮化镓等半导体材料, 氮化镓晶胞结构如图,黑球代表
氮化镓晶胞结构如图,黑球代表 ,白球代表
,白球代表 ,晶胞参数为
,晶胞参数为 。
。
①
 氮化镓晶体中每个
氮化镓晶体中每个 原子周围最近的
原子周围最近的 原子的个数为
原子的个数为②距离最近的两个
 原子之间的距离为
原子之间的距离为 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
4 . Ⅰ.MnO2和Zn是制造普通干电池的重要原料,现用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制备MnO2和Zn的工艺流程如图。回答下列问题:
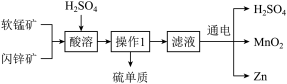
(1)能提高酸溶速率的措施为___________ 、___________ (任写两个)
(2)可循环使用的药品是___________ 。
(3)操作1为___________ 。
(4)酸溶时会生成硫酸锰,则化学反应方程式为___________ ;该反应中的氧化剂为___________ 。
Ⅱ.完成下列问题。
(5)某温度时,水的Kw=1×10-15,则该温度___________ (填“低于”“高于”或“等于”)25℃。
(6)常温下,将pH=2的盐酸与pH=13的KOH溶液混合后溶液pH=7,需盐酸和KOH的体积比为___________ 。
(7)常温下,pH=3的盐酸中水电离出的c水(H+)=_______ ;pH=12的NaOH溶液中c(OH-)=_____ 。

(1)能提高酸溶速率的措施为
(2)可循环使用的药品是
(3)操作1为
(4)酸溶时会生成硫酸锰,则化学反应方程式为
Ⅱ.完成下列问题。
(5)某温度时,水的Kw=1×10-15,则该温度
(6)常温下,将pH=2的盐酸与pH=13的KOH溶液混合后溶液pH=7,需盐酸和KOH的体积比为
(7)常温下,pH=3的盐酸中水电离出的c水(H+)=
您最近一年使用:0次
5 . 除去废水中Cr(Ⅵ)的方法有多种。请按要求回答下列问题。
(1)室温下,含Cr(Ⅵ)的微粒在水溶液中存在如下平衡:
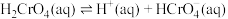

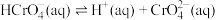

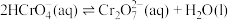

①室温下,反应
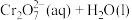 的
的
________ (用含 、
、 或
或 的代数式表示)。
的代数式表示)。
②基态 核外电子排布式为
核外电子排布式为________ 。
③室温下,初始浓度为 的
的 溶液中
溶液中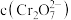 随
随 的变化如图所示。
的变化如图所示。
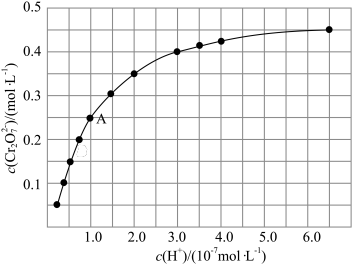
根据A点数据计算反应
 的
的
_________ ,下列关于该反应的说法不正确的是_________ 。
A.加水稀释,平衡右移,K值增大
B.若达到A点的时间为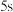 ,则
,则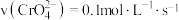
C.若升高温度,溶液中 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
(2) 与熟石灰除Cr(VI)法:向酸性废水中加入
与熟石灰除Cr(VI)法:向酸性废水中加入 ,再加入熟石灰,使
,再加入熟石灰,使 沉淀。
沉淀。
①实验中的 作用是
作用是________ 。
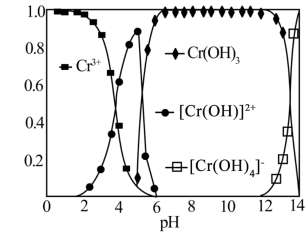
②Cr(Ⅲ)在水溶液中的存在形态分布如图所示。当 时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为
时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为_________ 。
(3)微生物法:
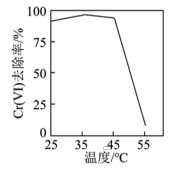
①用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水时,Cr(Ⅵ)去除率随温度的变化如图所示。 时,Cr(Ⅵ)的去除率很低的原因是
时,Cr(Ⅵ)的去除率很低的原因是____________ 。
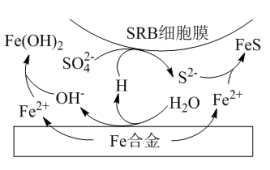
②水体中,Fe合金在SRB存在条件下腐蚀的机理如图所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为 ,
, 得到电子转化为H,
得到电子转化为H,________ 。
(4)可用电解法将废水中铬酸钾溶液制成重铬酸钾,其工作原理如图所示:
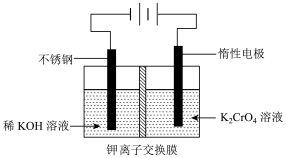
①该制备过程总反应的化学方程式为____________ 。
②电解一段时间后,阳极区溶液中 的物质的量由
的物质的量由
 变成
变成
 ,则生成的重铬酸钾的物质的量为
,则生成的重铬酸钾的物质的量为___________  。
。
(1)室温下,含Cr(Ⅵ)的微粒在水溶液中存在如下平衡:
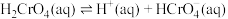

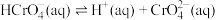

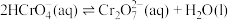

①室温下,反应

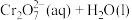 的
的
 、
、 或
或 的代数式表示)。
的代数式表示)。②基态
 核外电子排布式为
核外电子排布式为③室温下,初始浓度为
 的
的 溶液中
溶液中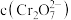 随
随 的变化如图所示。
的变化如图所示。
根据A点数据计算反应

 的
的
A.加水稀释,平衡右移,K值增大
B.若达到A点的时间为
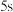 ,则
,则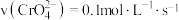
C.若升高温度,溶液中
 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
(2)
 与熟石灰除Cr(VI)法:向酸性废水中加入
与熟石灰除Cr(VI)法:向酸性废水中加入 ,再加入熟石灰,使
,再加入熟石灰,使 沉淀。
沉淀。①实验中的
 作用是
作用是②Cr(Ⅲ)在水溶液中的存在形态分布如图所示。当
 时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为
时,Cr(Ⅲ)去除率下降的原因可用离子方程式表示为
(3)微生物法:
①用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水时,Cr(Ⅵ)去除率随温度的变化如图所示。
 时,Cr(Ⅵ)的去除率很低的原因是
时,Cr(Ⅵ)的去除率很低的原因是
②水体中,Fe合金在SRB存在条件下腐蚀的机理如图所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为
 ,
, 得到电子转化为H,
得到电子转化为H,
(4)可用电解法将废水中铬酸钾溶液制成重铬酸钾,其工作原理如图所示:

①该制备过程总反应的化学方程式为
②电解一段时间后,阳极区溶液中
 的物质的量由
的物质的量由
 变成
变成
 ,则生成的重铬酸钾的物质的量为
,则生成的重铬酸钾的物质的量为 。
。
您最近一年使用:0次
名校
解题方法
6 . 请按要求书写化学用语
(1)实验室制取氯气离子方程式:___________ 。
(2)工业制漂白粉的化学方程式:___________ 。
(3)碳酸氢钠溶液中滴加少量澄清石灰水的离子方程式:___________ 。
(4)2.3克钠放在100克水中放出aKJ热量的热化学方程式:___________ 。
(5)用NaClO和Fe2(SO4)3在碱性条件下制备高铁酸钠(Na2FeO4)的离子方程式___________ 。
(1)实验室制取氯气离子方程式:
(2)工业制漂白粉的化学方程式:
(3)碳酸氢钠溶液中滴加少量澄清石灰水的离子方程式:
(4)2.3克钠放在100克水中放出aKJ热量的热化学方程式:
(5)用NaClO和Fe2(SO4)3在碱性条件下制备高铁酸钠(Na2FeO4)的离子方程式
您最近一年使用:0次
7 . 分类是认识和研究物质及其变化的一种常用的科学方法。依据物质类别和元素价态,可以对物质的性质进行解释和预测。
Ⅰ、有三种物质: 、
、 、
、
(1)其中氧元素的化合价均为___________ 价。
(2)从氧化剂和还原剂的角度,分析反应中的 作用。请完成下表内容。
作用。请完成下表内容。
(3)由 、
、 的名称可推知
的名称可推知 的名称为
的名称为___________ 。
(4)已知 可与
可与 反应产生
反应产生 ,请写出
,请写出 与水反应的化学方程式
与水反应的化学方程式___________ ,由此可推测 也可做供氧剂。
也可做供氧剂。
II、亚硝酸钠 外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食
外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食 会导致血红蛋白中的
会导致血红蛋白中的 转化为
转化为 而中毒。
而中毒。
(5)误食 后可服用维生素
后可服用维生素 解毒。下列分析错误的是___________(填序号)。
解毒。下列分析错误的是___________(填序号)。
(6)我国规定火腿肠中亚硝酸钠添加标准为每千克食品含量不超过150毫克,以此计算,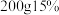 的亚硝酸钠溶液至少可用于生产火腿肠
的亚硝酸钠溶液至少可用于生产火腿肠___________ 千克。
(7)亚硝酸钠在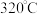 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。请填写并配平该反应的化学方程式,并用双线桥法标出此反应的电子得失和数目
时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。请填写并配平该反应的化学方程式,并用双线桥法标出此反应的电子得失和数目___________ 。

Ⅰ、有三种物质:
 、
、 、
、
(1)其中氧元素的化合价均为
(2)从氧化剂和还原剂的角度,分析反应中的
 作用。请完成下表内容。
作用。请完成下表内容。| 序号 | 化学反应方程式 | 作用 |
| ① |  | |
| ② |  | |
| ③ | 既作氧化剂,又作还原剂 |
(3)由
 、
、 的名称可推知
的名称可推知 的名称为
的名称为(4)已知
 可与
可与 反应产生
反应产生 ,请写出
,请写出 与水反应的化学方程式
与水反应的化学方程式 也可做供氧剂。
也可做供氧剂。II、亚硝酸钠
 外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食
外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食 会导致血红蛋白中的
会导致血红蛋白中的 转化为
转化为 而中毒。
而中毒。(5)误食
 后可服用维生素
后可服用维生素 解毒。下列分析错误的是___________(填序号)。
解毒。下列分析错误的是___________(填序号)。A. 被还原 被还原 | B.维生素 具有还原性 具有还原性 |
C.还原性:维生素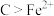 | D. 是还原剂 是还原剂 |
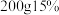 的亚硝酸钠溶液至少可用于生产火腿肠
的亚硝酸钠溶液至少可用于生产火腿肠(7)亚硝酸钠在
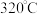 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。请填写并配平该反应的化学方程式,并用双线桥法标出此反应的电子得失和数目
时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。请填写并配平该反应的化学方程式,并用双线桥法标出此反应的电子得失和数目
您最近一年使用:0次
2022-10-23更新
|
512次组卷
|
2卷引用:广东省兴宁市齐昌中学2022-2023学年高一上学期期中考试化学试题
名校
8 . 中国科学家以 和
和 为原料,经催化可转化为有机物,其微观反应原理如下图所示。下列说法正确的是
为原料,经催化可转化为有机物,其微观反应原理如下图所示。下列说法正确的是
 和
和 为原料,经催化可转化为有机物,其微观反应原理如下图所示。下列说法正确的是
为原料,经催化可转化为有机物,其微观反应原理如下图所示。下列说法正确的是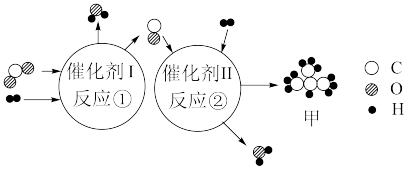
| A.反应①反应前后各元素化合价不变 |
B.反应①的化学方程式为 |
C.在反应②中,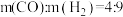 |
| D.在甲物质中,氢元素的质量分数约为17.24% |
您最近一年使用:0次
2022-09-01更新
|
225次组卷
|
3卷引用:广东省大埔县虎山中学2022-2023学年高一上学期(11月)期中考试化学试题
9 . 已知氯化亚锡分子式为SnCl2,常温时水中溶解度为2.7g,从水溶液中析出时形成SnCl2•2H2O晶体。锡的另一种盐SnCl4常温时水中溶解度为128g。某锡花中(主要成分为锡)含有杂质镁、铜、铅等金属。从锡花中制备二氯化锡晶体工艺如图:

(1)①“溶浸”时提高溶浸率的措施有____ (任写一个)。
②“溶浸”后的锡主要以SnCl4的形式存在于混合液中。写出Sn与SnCl4反应的化学方程____ 。
③“溶浸”时,加热反应器使反应液温度升高至60℃,开始通入Cl2,随着反应的进行,反应所放出的热量使溶液的温度提高,此时需保持反应温度在80~90℃之间,不宜过高。温度不宜过高的原因是____ 。“操作a”的名称是____ 。
(2)①基态Sn原子价层电子的电子排布式为____ ,在元素周期表中属于____ 区。
②铜锡合金晶体有多种结构,其中一种晶体的晶胞为立方晶胞(如图),则该晶体中铜、锡原子个数比为____ ,若阿伏加德罗常数为NA,晶胞参数为apm,则合金晶体的密度为____ g•cm-3(用含a、NA的式子表示,不必化简)。


(1)①“溶浸”时提高溶浸率的措施有
②“溶浸”后的锡主要以SnCl4的形式存在于混合液中。写出Sn与SnCl4反应的化学方程
③“溶浸”时,加热反应器使反应液温度升高至60℃,开始通入Cl2,随着反应的进行,反应所放出的热量使溶液的温度提高,此时需保持反应温度在80~90℃之间,不宜过高。温度不宜过高的原因是
(2)①基态Sn原子价层电子的电子排布式为
②铜锡合金晶体有多种结构,其中一种晶体的晶胞为立方晶胞(如图),则该晶体中铜、锡原子个数比为

您最近一年使用:0次



