广东省兴宁一中2020届高三年级3月质量检测考试(全国I卷)理综化学试题
广东
高三
阶段练习
2020-03-28
474次
整体难度:
容易
考查范围:
常见无机物及其应用、化学实验基础、化学与STSE、有机化学基础、物质结构与性质、认识化学科学、化学反应原理
广东省兴宁一中2020届高三年级3月质量检测考试(全国I卷)理综化学试题
广东
高三
阶段练习
2020-03-28
474次
整体难度:
容易
考查范围:
常见无机物及其应用、化学实验基础、化学与STSE、有机化学基础、物质结构与性质、认识化学科学、化学反应原理
一、单选题 添加题型下试题
单选题
|
容易(0.94)
名校
解题方法
1. 化学与生产、生活和技术等密切相关,下列说法正确的是( )
| A.明矾和Fe2(SO4)3可作饮用水的净水剂和消毒剂 |
| B.工业上用电解MgO、Al2O3的方法来冶炼对应的金属 |
| C.高级脂肪酸乙酯是生物柴油的一种成分,这属于油脂 |
| D.(肘后急备方)“青蒿一捏,以水二升渍,取绞汁”,该过程属于物理变化 |
您最近一年使用:0次
2020-03-26更新
|
106次组卷
|
2卷引用:广东省兴宁一中2020届高三年级3月质量检测考试(全国I卷)理综化学试题
单选题
|
较易(0.85)
名校
解题方法
2. 有专家研究发现,有机物M(结构为 )可能是合成抑制新型冠状病毒药物的重要物质,下列关于M的说法正确的是( )
)可能是合成抑制新型冠状病毒药物的重要物质,下列关于M的说法正确的是( )
 )可能是合成抑制新型冠状病毒药物的重要物质,下列关于M的说法正确的是( )
)可能是合成抑制新型冠状病毒药物的重要物质,下列关于M的说法正确的是( )| A.与乙烯互为同系物 |
| B.所有碳原子可在同一平面上 |
| C.一氯取代物有3种 |
| D.可使酸性KMnO4溶液、溴水褪色,原理相同 |
您最近一年使用:0次
单选题
|
较易(0.85)
名校
解题方法
3. 短周期主族元素X、Y、Z、W的原子序数依次增大,P、M、N均是由其中两种上述元素组成的化合物,它们存在转化关系Q P+M+N,P能使湿润的红色石蕊试纸变蓝,M的组成元素位于同一主族,N常温常压下为液体。下列说法不正确的是( )
P+M+N,P能使湿润的红色石蕊试纸变蓝,M的组成元素位于同一主族,N常温常压下为液体。下列说法不正确的是( )
 P+M+N,P能使湿润的红色石蕊试纸变蓝,M的组成元素位于同一主族,N常温常压下为液体。下列说法不正确的是( )
P+M+N,P能使湿润的红色石蕊试纸变蓝,M的组成元素位于同一主族,N常温常压下为液体。下列说法不正确的是( )| A.原子半径:Y>Z>W>X |
| B.简单气态氢化物的热稳定性:Z>Y |
| C.物质M具有漂白性 |
| D.Q既能与强酸溶液反应,又能与强碱溶液反应 |
您最近一年使用:0次
单选题
|
较易(0.85)
名校
4. 设NA为阿伏加 德罗常数的值。下列说法正确的是( )
| A.0.2mol•L-1的MgCl2溶液中含Cl-数目为0.4NA |
| B.标准状况下,11.2LH2与11.2LD2所含的质子数均为NA |
| C.6.4gCu与3.2g硫粉混合隔绝空气加热,充分反应后,转移电子数为0.2NA |
| D.1LpH=1的H2SO4溶液中,含H+数目为0.2NA |
您最近一年使用:0次
单选题
|
较易(0.85)
名校
解题方法
5. 某学习小组拟探究CO2和锌粒反应是否生成CO,已知CO能与银氨溶液反应产生黑色固体。实验装置如图所示,下列说法正确的是( )
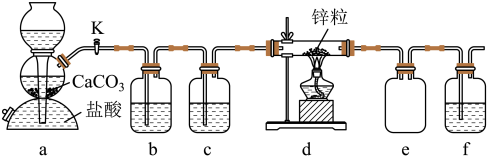

| A.实验开始时,先点燃酒精灯,后打开活塞K |
| B.a中所发生反应的离子方程式是CO32-+2H+=CO2↑+H2O |
| C.b、c、f中试剂依次为饱和碳酸氢钠溶液、浓硫酸、银氨溶液 |
| D.装置e的作用是收集一氧化碳气体 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
6. 锂碘电池的正极材料是聚2-乙烯吡啶(简写为P2VP)和I2的复合物,电解质是熔融薄膜状的碘化锂,该电池发生的总反应为2Li+P2VP·nI2 P2VP·(n-1)I2+2LiI。下列说法正确的是
P2VP·(n-1)I2+2LiI。下列说法正确的是
 P2VP·(n-1)I2+2LiI。下列说法正确的是
P2VP·(n-1)I2+2LiI。下列说法正确的是 | A.该电池放电时,锂电极发生还原反应 |
| B.该电池放电时,碘离子移向正极 |
| C.P2VP和I2的复合物是绝缘体,不能导电,充电时与外电源的负极相连 |
| D.放电时正极的电极反应式为P2VP·nI2+2e-+2Li+=P2VP·(n-1)I2+2LiI |
您最近一年使用:0次
2020-01-23更新
|
218次组卷
|
3卷引用:广东省潮州市2019-2020学年高三上学期期末考试理综化学试题
单选题
|
较易(0.85)
7. T℃时,在20.00mL0.10mol·L-1的一元酸HR溶液中滴入0.10mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系如图所示。
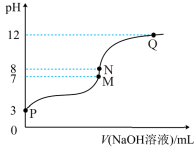
| A..T℃时,HR电离常数Ka≈1.0×10-5 |
| B.M点对应的NaOH溶液体积为20.00mL |
| C.N点与Q点所示溶液中水的电离程度:N>Q |
| D.M点所示溶液中c(Na+)=c(R-) |
您最近一年使用:0次
2020-03-26更新
|
686次组卷
|
7卷引用:广东省兴宁一中2020届高三年级3月质量检测考试(全国I卷)理综化学试题
二、解答题 添加题型下试题
解答题-实验探究题
|
较易(0.85)
名校
8. 乳酸亚铁晶体([CH3CH(OH)COO]2Fe·3H2O,Mr=288)是常用的补铁剂易溶于水,吸收效果比无机铁好。乳酸亚铁可由乳酸与FeCO3反应制得。
I.制备碳酸亚铁(FeCO3)
已知FeCO3易被氧化:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2。某兴趣小组设计如下方案制备FeCO3,实验装置如图:
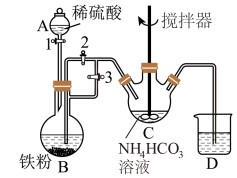
(1)仪器B的名称是__ 。
(2)利用如图所示装置进行实验,进行以下两步操作:
第一步:打开活塞1、3,关闭活塞2,反应一段时间;
第二步:关闭活塞3,打开活塞2,发现C中有白色沉淀和气体生成。
①第一步骤的目的是__ 。
②C中反应生成白色沉淀的离子方程式是:__ 。
③仪器C中的混合物经过滤,洗涤后得到FeCO3沉淀。实验室中进行过滤后沉淀洗涤的操作是:__ 。
④装置D中可盛装适量的水,该装置作用是__ 。
II.制备乳酸亚铁晶体和定量测量
(1)制备乳酸亚铁晶体。将制得的FeCO3加入到乳酸溶液中,加入少量铁粉,在70℃下搅拌使反应充分进行,一段时间后,经过分离提纯操作,从所得溶液中得到乳酸亚铁晶体。现需要设计实验检测产品在制备过程是否因氧化而发生变质,可选用的试剂__ 。
(2)用碘量法测定晶体样品中铁元素的含量并计算样品的纯度。称取3.00g晶体样品,在足量空气中灼烧成灰,加足量稀硫酸溶解,将所有可溶物配成l00mL溶液。取25.00mL该溶液加入过量的KI反应,加入几滴__ (试剂名称)作指示剂,用0.l0mol/L的硫代硫酸钠溶液滴定(I2+2S2O32-=S4O62-+2I-),重复实验3次,滴定终点时平均消耗硫代硫酸钠25.00mL,则样品纯度为__ 。
I.制备碳酸亚铁(FeCO3)
已知FeCO3易被氧化:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2。某兴趣小组设计如下方案制备FeCO3,实验装置如图:

(1)仪器B的名称是
(2)利用如图所示装置进行实验,进行以下两步操作:
第一步:打开活塞1、3,关闭活塞2,反应一段时间;
第二步:关闭活塞3,打开活塞2,发现C中有白色沉淀和气体生成。
①第一步骤的目的是
②C中反应生成白色沉淀的离子方程式是:
③仪器C中的混合物经过滤,洗涤后得到FeCO3沉淀。实验室中进行过滤后沉淀洗涤的操作是:
④装置D中可盛装适量的水,该装置作用是
II.制备乳酸亚铁晶体和定量测量
(1)制备乳酸亚铁晶体。将制得的FeCO3加入到乳酸溶液中,加入少量铁粉,在70℃下搅拌使反应充分进行,一段时间后,经过分离提纯操作,从所得溶液中得到乳酸亚铁晶体。现需要设计实验检测产品在制备过程是否因氧化而发生变质,可选用的试剂
(2)用碘量法测定晶体样品中铁元素的含量并计算样品的纯度。称取3.00g晶体样品,在足量空气中灼烧成灰,加足量稀硫酸溶解,将所有可溶物配成l00mL溶液。取25.00mL该溶液加入过量的KI反应,加入几滴
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
名校
解题方法
9. 铅精矿可用于冶炼金属铅,其主要成分为PbS。
I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
①用铅精矿火法炼铅的反应的化学方程式为___ 。
②火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为___ 。
II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如图:
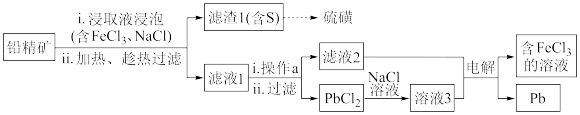
已知:①不同温度下PbCl2的溶解度如下表所示。
②PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq)+2Cl-(aq) PbCl42-(aq)。
PbCl42-(aq)。
(3)铅精矿浸取后“趁热过滤”的原因是___ 。
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出。试分析“加适量水稀释”可能的原因是___ 。
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。

①溶液3应置于___ (填“阴极室”或“阳极室”)中。
②滤液2电解后可实现FeCl3的再生,该电极的电极反应式___ 。
③若铅精矿的质量为ag,铅浸出率为b,当电解池中通过cmol电子时,金属铅全部析出,铅精矿中PbS的质量分数为___ (用a、b、c的代数式表示)。
I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
①用铅精矿火法炼铅的反应的化学方程式为
②火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为
II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如图:
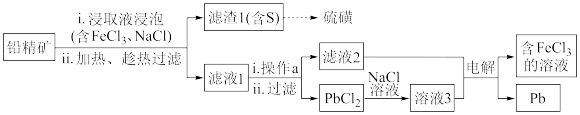
已知:①不同温度下PbCl2的溶解度如下表所示。
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 溶解(g) | 1.00 | 1.42 | 1.94 | 2.88 | 3.20 |
②PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq)+2Cl-(aq)
 PbCl42-(aq)。
PbCl42-(aq)。(3)铅精矿浸取后“趁热过滤”的原因是
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出。试分析“加适量水稀释”可能的原因是
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。

①溶液3应置于
②滤液2电解后可实现FeCl3的再生,该电极的电极反应式
③若铅精矿的质量为ag,铅浸出率为b,当电解池中通过cmol电子时,金属铅全部析出,铅精矿中PbS的质量分数为
【知识点】 氧化还原反应方程式的配平解读 电化学计算 电解原理 物质分离、提纯综合应用解读
您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
名校
解题方法
10. 随着氮氧化物对环境及人类活动影响的日趋严重,如何消除大气污染物中的氮氧化物成为人们关注的主要问题之一。
Ⅰ.利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:4NH3(g)+6NO(g) 5N2(g)+6H2O(l) △H<0
5N2(g)+6H2O(l) △H<0
(1)写出一种可以提高NO的转化率的方法:__________
(2)一定温度下,在恒容密闭容器中按照n(NH3)︰n(NO) =2︰3充入反应物,发生上述反应。下列不能 判断该反应达到平衡状态的是___________
A.c(NH3)︰c(NO) =2︰3 B.n(NH3)︰n(N2) 不变 C.容器内压强不变 D.容器内混合气体的密度不变 E.1molN—H键断裂的同时,生成1molO—H键
(3)已知该反应速率v正=k正·c4(NH3)·c6 (NO),v逆=k逆·cx(N2)·cy(H2O) (k正、k逆分别是正、逆反应速率常数),该反应的平衡常数K=k正/k逆,则x=_____ ,y=_______ 。
(4)某研究小组将2molNH3、3molNO和一定量的O2充入2L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示:
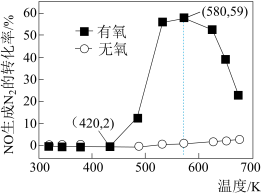
①在5min内,温度从420K升高到580K,此时段内NO的平均反应速率v(NO)=_______ ;
②在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是___________ 。
Ⅱ.用尿素[(NH2)2CO]水溶液吸收氮氧化物也是一种可行的方法。NO和NO2不同配比混合气通入尿素溶液中,总氮还原率与配比关系如图。
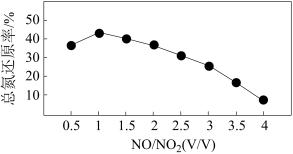
(5) 用尿素[(NH2)2CO]水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。写出该反应的化学方程式____ 。
(6)随着NO和NO2配比的提高,总氮还原率降低的主要原因是________________ 。
Ⅰ.利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:4NH3(g)+6NO(g)
 5N2(g)+6H2O(l) △H<0
5N2(g)+6H2O(l) △H<0(1)写出一种可以提高NO的转化率的方法:
(2)一定温度下,在恒容密闭容器中按照n(NH3)︰n(NO) =2︰3充入反应物,发生上述反应。下列
A.c(NH3)︰c(NO) =2︰3 B.n(NH3)︰n(N2) 不变 C.容器内压强不变 D.容器内混合气体的密度不变 E.1molN—H键断裂的同时,生成1molO—H键
(3)已知该反应速率v正=k正·c4(NH3)·c6 (NO),v逆=k逆·cx(N2)·cy(H2O) (k正、k逆分别是正、逆反应速率常数),该反应的平衡常数K=k正/k逆,则x=
(4)某研究小组将2molNH3、3molNO和一定量的O2充入2L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示:

①在5min内,温度从420K升高到580K,此时段内NO的平均反应速率v(NO)=
②在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是
Ⅱ.用尿素[(NH2)2CO]水溶液吸收氮氧化物也是一种可行的方法。NO和NO2不同配比混合气通入尿素溶液中,总氮还原率与配比关系如图。

(5) 用尿素[(NH2)2CO]水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。写出该反应的化学方程式
(6)随着NO和NO2配比的提高,总氮还原率降低的主要原因是
您最近一年使用:0次
2020-01-16更新
|
317次组卷
|
4卷引用:福建省龙岩市2020届高三上学期期末考试化学试题
福建省龙岩市2020届高三上学期期末考试化学试题(已下线)2020届高三《新题速递·化学》2月第01期(考点10-12)广东省兴宁一中2020届高三年级3月质量检测考试(全国I卷)理综化学试题湖北省武汉市华中师大一附中高三理科四调综合训化学试题
解答题-结构与性质
|
适中(0.65)
名校
解题方法
11. 第三代太阳能电池就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)晶体硅中Si原子的杂化方式是___ ,基态Ga原子核外电子排布式为___ 。
(2)向硫酸铜溶液中逐滴滴加浓氨水,先出现蓝色絮状沉淀,后沉淀逐渐溶解得到[Cu(NH3)4]SO4的深蓝色透明溶液。
①NH3极易溶于水,除因为NH3与H2O都是极性分子外,还因为____ 。
②在[Cu(NH3)4]2+中Cu2+与NH3之间形成的化学键称为___ ,提供孤电子对的成键原子是___ 。
③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___ 。
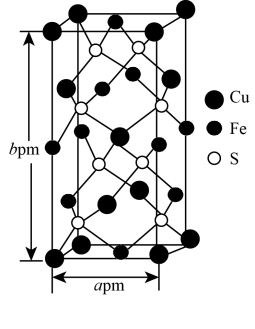
(3)某含铜化合物的晶胞如图所示,晶胞上下底面为正方形,侧面与底面垂直。则晶胞中每个Cu原子与____ 个S原子相连,含铜化合物的化学式为____ 。设NA为阿伏加 德罗常数的值,则该晶胞的密度为___ g•cm‑3(用含a、b、NA的代数式表示)。
(1)晶体硅中Si原子的杂化方式是
(2)向硫酸铜溶液中逐滴滴加浓氨水,先出现蓝色絮状沉淀,后沉淀逐渐溶解得到[Cu(NH3)4]SO4的深蓝色透明溶液。
①NH3极易溶于水,除因为NH3与H2O都是极性分子外,还因为
②在[Cu(NH3)4]2+中Cu2+与NH3之间形成的化学键称为
③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
(3)某含铜化合物的晶胞如图所示,晶胞上下底面为正方形,侧面与底面垂直。则晶胞中每个Cu原子与

您最近一年使用:0次
2020-02-14更新
|
201次组卷
|
3卷引用:山东省烟台市2020届高三上学期期末考试化学试题
山东省烟台市2020届高三上学期期末考试化学试题广东省兴宁一中2020届高三年级3月质量检测考试(全国I卷)理综化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编
解答题-有机推断题
|
适中(0.65)
名校
12. 研究发现,有机物G具有很好的抗病毒作用。合成路线如图:
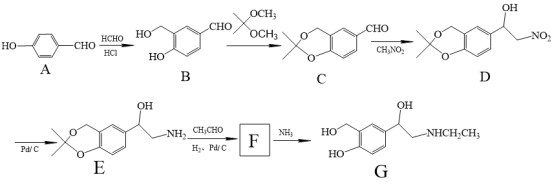
(1)物质C中官能团有__ (写名称)
(2)A→B发生反应的类型是__ 。
(3)结合整个合成路线,反应B→C的目的是___ 。
(4)化合物F的分子式为C14H21NO3,则其结构简式为___ 。
(5)同时满足下列条件的B的同分异构体有___ 种
①分子中含苯环,能与NaHCO3反应放出气体;②能使FeCl3溶液显紫色
(6)某同学设计以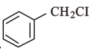 、CH3NO2为原料制备
、CH3NO2为原料制备 的合成路线如图,根据所学知识及题中信息,请将流程补充完成(无机试剂任选,格式按流程图)
的合成路线如图,根据所学知识及题中信息,请将流程补充完成(无机试剂任选,格式按流程图)___ 。

其中第二步反应的化学方程式为___ 。

(1)物质C中官能团有
(2)A→B发生反应的类型是
(3)结合整个合成路线,反应B→C的目的是
(4)化合物F的分子式为C14H21NO3,则其结构简式为
(5)同时满足下列条件的B的同分异构体有
①分子中含苯环,能与NaHCO3反应放出气体;②能使FeCl3溶液显紫色
(6)某同学设计以
 、CH3NO2为原料制备
、CH3NO2为原料制备 的合成路线如图,根据所学知识及题中信息,请将流程补充完成(无机试剂任选,格式按流程图)
的合成路线如图,根据所学知识及题中信息,请将流程补充完成(无机试剂任选,格式按流程图)
其中第二步反应的化学方程式为
您最近一年使用:0次
试卷分析
导出
整体难度:适中
考查范围:常见无机物及其应用、化学实验基础、化学与STSE、有机化学基础、物质结构与性质、认识化学科学、化学反应原理
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 明矾的净水作用及原理 萃取和分液 常见金属的冶炼 | |
| 2 | 0.85 | 同分异构体的数目的确定 含碳碳双键物质的性质的推断 有机分子中原子共面的判断 | |
| 3 | 0.85 | 既能与酸反应又能与碱反应的无机物质 元素周期律、元素周期表的推断 微粒半径大小的比较方法 | |
| 4 | 0.85 | 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 pH定义式及计算 | |
| 5 | 0.85 | 实验安全 化学实验探究 综合实验设计与评价 碳元素及其化合物 | |
| 6 | 0.65 | 原电池电子流向判断及应用 原电池正负极判断 原电池电极反应式书写 | |
| 7 | 0.85 | 水的电离 电离平衡常数及影响因素 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 | |
| 二、解答题 | |||
| 8 | 0.85 | 亚铁盐 铁盐 中和滴定 物质制备的探究 | 实验探究题 |
| 9 | 0.65 | 氧化还原反应方程式的配平 电化学计算 电解原理 物质分离、提纯综合应用 | 工业流程题 |
| 10 | 0.65 | 化学反应速率计算 化学平衡状态的判断方法 化学平衡常数的概念及表达方式 转化率的相关计算及判断 | 原理综合题 |
| 11 | 0.65 | 配合物 相似相溶原理及应用 根据晶胞结构确定晶体化学式 晶胞的有关计算 | 结构与性质 |
| 12 | 0.65 | 有机官能团的性质及结构 同分异构体书写 根据题给物质选择合适合成路线 有机合成过程中官能团的保护 | 有机推断题 |



