1 . Ⅰ.某化学兴趣小组的同学学了金属的电化学腐蚀,对教材叙述[钢铁在酸性环境中发生析氢腐蚀;在酸性很弱或呈中性,溶有 的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。
的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。
(1)用图1所示装置进行实验:打开a________ (填仪器名称)的活塞,加入1mL溶液,测得压强随时间变化曲线如图2。
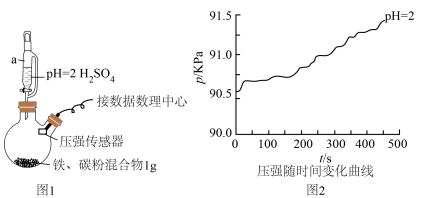
同学甲得出结论:酸性条件下,铁粉发生析氢腐蚀。
(2)同学乙认为甲的结论不科学,锥形瓶内压强变大还可能是___________ ,提出改进措施___________ 。改进后,再次实验,证明甲、乙的猜想均正确,请在图2绘制出改进后的曲线___________ 。
(3)同学丙认为甲、乙的实验不具代表性,建议用不同浓度的酸进行实验。在改进后的装置中分别用 、
、 的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是
的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是___________ 。
(4)对于图3中 时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中
时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中 浓度随时间的变化曲线如图4。
浓度随时间的变化曲线如图4。
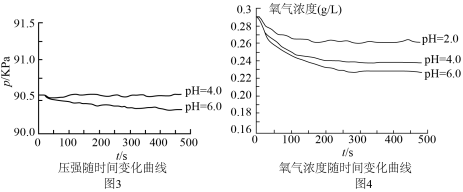
结合实验分析: 时,压强几乎不随时间改变是因为
时,压强几乎不随时间改变是因为___________ 。
综上,小组同学得出结论:教材表述科学严谨。
Ⅱ.拓展研究:
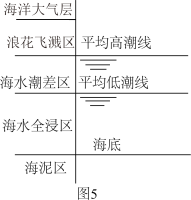
(5)侯保荣院士专门研究海洋钢架结构桥海洋大气层梁腐蚀,他发现腐蚀最严重的是浪花飞溅区浪花飞溅区(海洋环境分区如图5),请你解释原因___________ 。
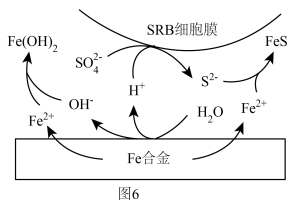
(6)科学家还发现在 浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的
浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的 完全转化为FeS,请写出该铁合金腐蚀的总反应
完全转化为FeS,请写出该铁合金腐蚀的总反应___________ (离子方程式)。
(7)请列举出生产生活中金属制品的防腐措施___________ (任写一点即可)。
 的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。
的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。(1)用图1所示装置进行实验:打开a

同学甲得出结论:酸性条件下,铁粉发生析氢腐蚀。
(2)同学乙认为甲的结论不科学,锥形瓶内压强变大还可能是
(3)同学丙认为甲、乙的实验不具代表性,建议用不同浓度的酸进行实验。在改进后的装置中分别用
 、
、 的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是
的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是(4)对于图3中
 时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中
时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中 浓度随时间的变化曲线如图4。
浓度随时间的变化曲线如图4。
结合实验分析:
 时,压强几乎不随时间改变是因为
时,压强几乎不随时间改变是因为综上,小组同学得出结论:教材表述科学严谨。
Ⅱ.拓展研究:
(5)侯保荣院士专门研究海洋钢架结构桥海洋大气层梁腐蚀,他发现腐蚀最严重的是浪花飞溅区浪花飞溅区(海洋环境分区如图5),请你解释原因

(6)科学家还发现在
 浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的
浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的 完全转化为FeS,请写出该铁合金腐蚀的总反应
完全转化为FeS,请写出该铁合金腐蚀的总反应
(7)请列举出生产生活中金属制品的防腐措施
您最近一年使用:0次
2024-01-05更新
|
939次组卷
|
2卷引用:广东省东莞中学、广州二中、惠州一中等六校联考2023-2024学年高三上学期11月期中化学试题
2 . 2023年化学诺贝尔奖授予三位科学家以表彰他们发现和合成量子点方面做出的贡献.我国化学家研究的一种新型复合光催化剂[碳量子点(CQDS)氮化碳( )纳米复合物]可利用太阳光实现高效分解水,原理如图所示.现以每生成2mol
)纳米复合物]可利用太阳光实现高效分解水,原理如图所示.现以每生成2mol 或1mol
或1mol 计,水分解、反应Ⅰ及反应Ⅱ的焓变依次为
计,水分解、反应Ⅰ及反应Ⅱ的焓变依次为 、
、 、
、 .下列说法错误的是
.下列说法错误的是
 )纳米复合物]可利用太阳光实现高效分解水,原理如图所示.现以每生成2mol
)纳米复合物]可利用太阳光实现高效分解水,原理如图所示.现以每生成2mol 或1mol
或1mol 计,水分解、反应Ⅰ及反应Ⅱ的焓变依次为
计,水分解、反应Ⅰ及反应Ⅱ的焓变依次为 、
、 、
、 .下列说法错误的是
.下列说法错误的是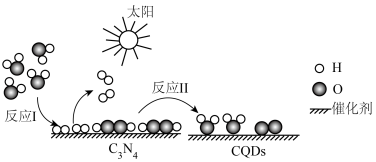
A.反应Ⅰ的化学方程式为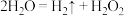 |
| B.该过程涉及太阳能、热能及化学能之间的转化 |
C.该过程实现高效分解水的同时也产生副产物 |
D.若 ,则 ,则 与 与 的大小关系为 的大小关系为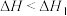 |
您最近一年使用:0次
2024-02-22更新
|
128次组卷
|
2卷引用:广东省东莞市两校联考2023-2024学年高二下学期4月月考化学试题
名校
解题方法
3 . 双碱法脱硫过程如图所示,下列说法不正确的是


| A.双碱法脱硫过程中,NaOH可以循环利用 |
| B.过程II中,1molO2可氧化2molNa2SO3 |
| C.双碱法脱硫过程中,Na2SO3起催化作用 |
D.总反应为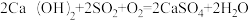 |
您最近一年使用:0次
2024-01-09更新
|
170次组卷
|
2卷引用:广东省东莞市东莞中学2023-2024学年高二上学期期中考试化学试题
名校
4 . 高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理。工业制备高铁酸钠的化学原理可用离子方程式表示为:3ClO-+2Fe3++10OH-=2 +3Cl-+5H2O。下列有关说法错误的是
+3Cl-+5H2O。下列有关说法错误的是
 +3Cl-+5H2O。下列有关说法错误的是
+3Cl-+5H2O。下列有关说法错误的是| A.高铁酸钠中铁的化合价为+6价 |
B.由上述反应可知,ClO-的氧化性强于 |
| C.上述反应中氧化剂和还原剂的物质的量之比为2∶3 |
| D.Na2FeO4处理水时,不仅能消毒,而且生成的Fe3+与水反应形成Fe(OH)3胶体能吸附水中的悬浮杂质 |
您最近一年使用:0次
2023-09-03更新
|
204次组卷
|
2卷引用:广东省东莞市2023-2024学年高一上学期12月期中四校联考化学试题
解题方法
5 . 阅读下面一段材料并回答问题。
(1)K2FeO4中铁元素的化合价为_______ 。
(2)制备K2FeO4需要在_______ (填“酸性”、“碱性”或“中性”)环境中进行。
(3)下列关于K2FeO4的说法中,不正确的是_______ 。
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)高铁酸钠Na2FeO4是一种新型的净水剂,可以通过下述反应制取:
①该反应中氧化剂是_______ (用化学式表示,下同),_______ 元素被氧化,还原产物为_______ 。
②用双线桥法在方程式中标出电子转移的情况:_______ 。
(5)将K2FeO4与水反应的化学方程式补充完整_______ 。
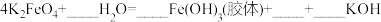
| 高铁酸钾使用说明书 【化学式】K2FeO4 【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气 K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。 K2FeO4与水反应还能产生具有强吸附性的  胶体,可除去水中细微的悬浮物,有净水作用 胶体,可除去水中细微的悬浮物,有净水作用【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1L水投放  ,即可达到卫生标准 ,即可达到卫生标准 |
(1)K2FeO4中铁元素的化合价为
(2)制备K2FeO4需要在
(3)下列关于K2FeO4的说法中,不正确的是
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)高铁酸钠Na2FeO4是一种新型的净水剂,可以通过下述反应制取:

①该反应中氧化剂是
②用双线桥法在方程式中标出电子转移的情况:
(5)将K2FeO4与水反应的化学方程式补充完整
您最近一年使用:0次
解题方法
6 . 北京市施行的《北京市小规模食品生产经营管理规定》中明确规定:小规模食品生产经营者不得购进、存放、使用亚硝酸盐等易滥用的食品添加剂。
(1)根据物质组成上分类,亚硝酸钠(NaNO2)属于___________ 填序号。
A.钠盐 B.硝酸盐 C.氧化物
(2)写出其电离方程式为___________ 。
(3)实验室中,亚硝酸钠可用来处理过量的叠氮化钠,有关反应的化学方程式如下:
a.NaNO2+H2SO4=HNO2+NaHSO4
b.2NaN3+2HNO2=3N2↑+2NO↑+2NaOH
①上述两个反应中,属于非氧化还原反应的是___________ (填“a”或b”)。
②其中的氧化还原反应的氧化剂是___________ (填化学式),用双线桥法表示该氧化还原反应中电子转移情况:___________ 。
(4)亚硝酸钠外观与食盐相似,且均有咸味。
①若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒。解毒过程的说法中,正确的是___________ 。
A.亚硝酸钠是还原剂 B.维生素C是氧化剂
C.维生素C能把铁离子还原成为亚铁离子 D.亚硝酸钠被还原
②X与亚硝酸钠发生的反应可表示为2NaNO2+2X+2H2SO4=2NO↑+I2+K2SO4+Na2SO4+2H2O (已配平),其中X是___________ (填化学式),每生成1个I2,转移___________ 个电子。
③含NaNO2的废水必须经处理后才能排放,可用铵盐来处理亚硝酸钠生成一种无毒气体,写出该反应的离子方程式___________ 。
(1)根据物质组成上分类,亚硝酸钠(NaNO2)属于
A.钠盐 B.硝酸盐 C.氧化物
(2)写出其电离方程式为
(3)实验室中,亚硝酸钠可用来处理过量的叠氮化钠,有关反应的化学方程式如下:
a.NaNO2+H2SO4=HNO2+NaHSO4
b.2NaN3+2HNO2=3N2↑+2NO↑+2NaOH
①上述两个反应中,属于非氧化还原反应的是
②其中的氧化还原反应的氧化剂是
(4)亚硝酸钠外观与食盐相似,且均有咸味。
①若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒。解毒过程的说法中,正确的是
A.亚硝酸钠是还原剂 B.维生素C是氧化剂
C.维生素C能把铁离子还原成为亚铁离子 D.亚硝酸钠被还原
②X与亚硝酸钠发生的反应可表示为2NaNO2+2X+2H2SO4=2NO↑+I2+K2SO4+Na2SO4+2H2O (已配平),其中X是
③含NaNO2的废水必须经处理后才能排放,可用铵盐来处理亚硝酸钠生成一种无毒气体,写出该反应的离子方程式
您最近一年使用:0次
名校
解题方法
7 . 把碎纸片b补充到a中,可得到一个完整的离子方程式(未配平)。下列说法不正确的是
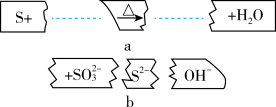

A.反应物微粒是S、 |
| B.向碎纸片b的溶液中,分别滴入稀硫酸,都能发生离子反应 |
| C.氧化剂与还原剂的质量比为1:1 |
| D.若有3个S原子参加反应,则转移的电子数为4 |
您最近一年使用:0次
2022-11-22更新
|
86次组卷
|
2卷引用:广东省东莞市东华高级中学、东华松山湖高级中学2022-2023学年高一上学期10月联考化学试题
名校
8 . 高铁酸钾纯品为暗紫色有光泽粉末。在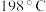 以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为
以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为 ,工业制备高铁酸钾的离子方程式为
,工业制备高铁酸钾的离子方程式为 (未配平),下列有关说法不正确的是
(未配平),下列有关说法不正确的是
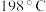 以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为
以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为 ,工业制备高铁酸钾的离子方程式为
,工业制备高铁酸钾的离子方程式为 (未配平),下列有关说法不正确的是
(未配平),下列有关说法不正确的是A.由上述反应可知, 的氧化性强于 的氧化性强于 |
| B.高铁酸钾中铁显+6价 |
C.上述反应氧化剂和还原剂的物质的量之比为 |
D. 处理水时,不仅能消毒杀菌,还生成 处理水时,不仅能消毒杀菌,还生成 水解形成 水解形成 胶体吸附水中悬浮杂质 胶体吸附水中悬浮杂质 |
您最近一年使用:0次
2022-10-30更新
|
217次组卷
|
3卷引用:广东省东莞市光正实验学校2023-2024学年高三上学期第一次月考化学试题
广东省东莞市光正实验学校2023-2024学年高三上学期第一次月考化学试题宁夏银川市第六中学2022-2023学年高三上学期第二次月考化学试题(已下线)专题04 氧化还原反应及其应用(练)-2023年高考化学二轮复习讲练测(新高考专用)
解题方法
9 . 碱式硫酸铁[Fe(OH)SO4]是一种絮凝剂,常用于污水处理。工业上利用废铁屑(含少量Al2O3、Fe2O3等)生产碱式硫酸铁的工艺流程如图所示。下列说法错误的是
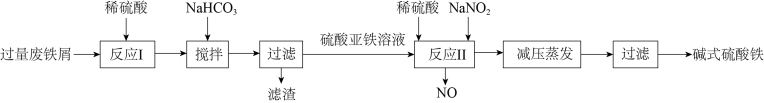

| A.“反应I”后的溶液中主要存在的阳离子有H+、Fe2+、Al3+ |
| B.“反应I”“反应II”中均发生了氧化还原反应 |
C.“反应II”对应的离子方程式为Fe2++NO +2H+=Fe3++NO↑+H2O +2H+=Fe3++NO↑+H2O |
| D.若用O2代替NaNO2,则每消耗0.005molO2相当于节约了2.76gNaNO2 |
您最近一年使用:0次
名校
解题方法
10 . CuCl为白色固体,难溶于水和乙醇,潮湿时易被氧化,常用作媒染剂。以废铜渣(主要成分为Cu,含少量Ni、Al2O3等)为原料制备CuCl的工艺流程如下:
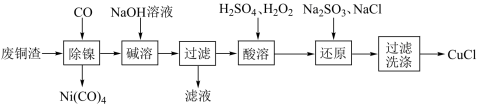
下列说法不正确的是

下列说法不正确的是
| A.“除镍”与“碱溶”过程发生的主要反应均为非氧化还原反应 |
| B.“酸溶”时可用热的氧气替换H2O2作氧化剂 |
C.“还原”时发生反应离子方程式为:SO +Cu2++Cl−+H2O=CuCl↓+SO +Cu2++Cl−+H2O=CuCl↓+SO +2H+ +2H+ |
| D.“洗涤”时采用乙醇与用蒸馏水相比较,制得CuCl纯度更高 |
您最近一年使用:0次
2022-11-13更新
|
246次组卷
|
3卷引用:广东省东莞市光正实验学校2023-2024学年高三上学期第一次月考化学试题
广东省东莞市光正实验学校2023-2024学年高三上学期第一次月考化学试题福建永春一中、培元中学、季延中学、石光中学2022-2023学年高三上学期期中考联考化学试题(已下线)专题04 氧化还原反应及其应用 (测)-2023年高考化学二轮复习讲练测(新高考专用)



