名校
1 . 某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2;已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是___________ 。
(2)该反应中,发生还原反应的过程是___________ →___________ 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目___________
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为___________ 。
(5)完成并配平化学方程式:Na2Sx+NaClO+NaOH=Na2SO4+NaCl+H2O,___________ 。
(6)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为___________ 。
(1)该反应中的还原剂是
(2)该反应中,发生还原反应的过程是
(3)写出该反应的化学方程式,并标出电子转移的方向和数目
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为
(5)完成并配平化学方程式:Na2Sx+NaClO+NaOH=Na2SO4+NaCl+H2O,
(6)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为
您最近一年使用:0次
名校
解题方法
2 . 下列离子方程式书写正确的是
A.向明矾溶液中滴加氢氧化钡至溶液呈中性:3Ba2++6OH-+2Al3++3SO =2Al(OH)3↓+3BaSO4↓ =2Al(OH)3↓+3BaSO4↓ |
| B.向Ca(ClO)2溶液通入过量的CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO |
| C.FeSO4酸性溶液暴露在空气中:4Fe2++O2+2H2O=4Fe3++4OH- |
D.CuSO4溶液与少量的Ba(OH)2溶液:Ba2++ =BaSO4↓ =BaSO4↓ |
您最近一年使用:0次
名校
解题方法
3 . Ⅰ.明胶是水溶性蛋白质混合物,溶于水形成胶体。工业明胶含有重金属 ,对人体有害。
,对人体有害。
(1)已知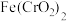 中
中 是一种酸根离子,则
是一种酸根离子,则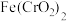 属于
属于___________ (填“酸”“碱”“盐”或“氧化物”),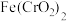 中铁元素的化合价为
中铁元素的化合价为___________ 价。
(2)明胶的水溶液和 溶液共同具有的性质是
溶液共同具有的性质是___________ (填字母)。
A.都不稳定,密封放置会产生沉淀 B.两者均有丁达尔效应 C.分散质粒子都可通过滤纸
Ⅱ. 是银白色金属,化学性质稳定,
是银白色金属,化学性质稳定, 价和
价和 价为常见价态。工业上以铬铁矿(主要成分为
价为常见价态。工业上以铬铁矿(主要成分为 ,含
,含
 等杂质)为主要原料生产金属铬和强氧化剂重铬酸钠
等杂质)为主要原料生产金属铬和强氧化剂重铬酸钠 ,其主要工艺流程如下。
,其主要工艺流程如下。

查阅资料:常温下, 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将 转化为
转化为 。
。
(3)工业上常采用热还原法制备金属铬,写出以 为原料,利用铝热反应制取金属铬的化学方程式:
为原料,利用铝热反应制取金属铬的化学方程式:___________ 。
(4)酸化滤液D时,用硫酸而不用盐酸,可能的原因是___________ 。
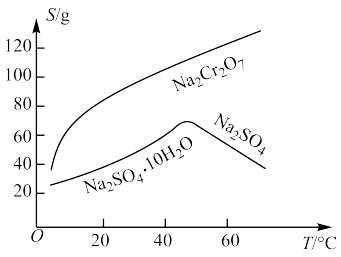
(5)固体E的主要成分是 ,根据下图分析操作a为
,根据下图分析操作a为___________ 、___________ 。
(6)电镀厂产生的镀铜废水中往往含有一定量的 ,处理该废水常用还原沉淀法,具体流程如下:
,处理该废水常用还原沉淀法,具体流程如下:

① 的化学性质与
的化学性质与 相似。在上述生产过程中加入
相似。在上述生产过程中加入 溶液时要控制溶液的
溶液时要控制溶液的 不能过高,是因为
不能过高,是因为___________ (用离子方程式表示)。
②下列溶液中可以代替上述流程中 溶液的是
溶液的是___________ (填字母)。
A.浓硫酸 B.酸性 溶液 C.
溶液 C. 溶液
溶液
③上述流程中,每消耗0.1mol 转移0.8mole-,则加入
转移0.8mole-,则加入 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为___________ 。
 ,对人体有害。
,对人体有害。(1)已知
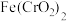 中
中 是一种酸根离子,则
是一种酸根离子,则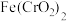 属于
属于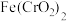 中铁元素的化合价为
中铁元素的化合价为(2)明胶的水溶液和
 溶液共同具有的性质是
溶液共同具有的性质是A.都不稳定,密封放置会产生沉淀 B.两者均有丁达尔效应 C.分散质粒子都可通过滤纸
Ⅱ.
 是银白色金属,化学性质稳定,
是银白色金属,化学性质稳定, 价和
价和 价为常见价态。工业上以铬铁矿(主要成分为
价为常见价态。工业上以铬铁矿(主要成分为 ,含
,含
 等杂质)为主要原料生产金属铬和强氧化剂重铬酸钠
等杂质)为主要原料生产金属铬和强氧化剂重铬酸钠 ,其主要工艺流程如下。
,其主要工艺流程如下。
查阅资料:常温下,
 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将 转化为
转化为 。
。(3)工业上常采用热还原法制备金属铬,写出以
 为原料,利用铝热反应制取金属铬的化学方程式:
为原料,利用铝热反应制取金属铬的化学方程式:(4)酸化滤液D时,用硫酸而不用盐酸,可能的原因是
(5)固体E的主要成分是
 ,根据下图分析操作a为
,根据下图分析操作a为
(6)电镀厂产生的镀铜废水中往往含有一定量的
 ,处理该废水常用还原沉淀法,具体流程如下:
,处理该废水常用还原沉淀法,具体流程如下:
①
 的化学性质与
的化学性质与 相似。在上述生产过程中加入
相似。在上述生产过程中加入 溶液时要控制溶液的
溶液时要控制溶液的 不能过高,是因为
不能过高,是因为②下列溶液中可以代替上述流程中
 溶液的是
溶液的是A.浓硫酸 B.酸性
 溶液 C.
溶液 C. 溶液
溶液③上述流程中,每消耗0.1mol
 转移0.8mole-,则加入
转移0.8mole-,则加入 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为
您最近一年使用:0次
2021-12-04更新
|
87次组卷
|
2卷引用:宁夏石嘴山市平罗中学2021-2022学年高三上学期期中考试化学试题
名校
4 . 下列离子方程式正确的是
A. 溶液与盐酸反应: 溶液与盐酸反应: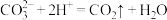 |
B.足量酸性 溶液与双氧水反应: 溶液与双氧水反应: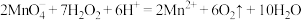 |
C. 的 的 溶液和 溶液和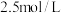 的 的 溶液等体积混合: 溶液等体积混合: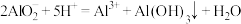 |
D.向 溶液中滴加少量氯水,反应的离子方程式为:2Br-+Cl2=Br2+2Cl- 溶液中滴加少量氯水,反应的离子方程式为:2Br-+Cl2=Br2+2Cl- |
您最近一年使用:0次
名校
解题方法
5 . I.亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:

(1)反应①阶段,参加反应的NaClO3和SO2的物质的量之比为___________
(2)若反应①通过原电池来实现,则ClO2是___________ 极产物
(3)反应②中的H2O2___________ 用NaClO4代替(填能或不能)
(4)写出反应②的离子方程式___________
II.聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。
(5)将一定量的FeSO4·7H2O溶于稀硫酸,在约70℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。H2O2氧化Fe2+的离子方程式为___________ ;水解聚合反应会导致溶液的pH___________ 。
(6)测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000g,置于250mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×10-2mol·L-1K2Cr2O7溶液滴定至终点(滴定过程中 与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。
与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。
①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将__ (填“偏大”“偏小”或“无影响”)。
②计算该样品中铁的质量分数_____ (写出计算过程)。

(1)反应①阶段,参加反应的NaClO3和SO2的物质的量之比为
(2)若反应①通过原电池来实现,则ClO2是
(3)反应②中的H2O2
(4)写出反应②的离子方程式
II.聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。
(5)将一定量的FeSO4·7H2O溶于稀硫酸,在约70℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。H2O2氧化Fe2+的离子方程式为
(6)测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000g,置于250mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×10-2mol·L-1K2Cr2O7溶液滴定至终点(滴定过程中
 与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。
与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将
②计算该样品中铁的质量分数
您最近一年使用:0次
名校
解题方法
6 . 绿水青山是习近平总书记构建美丽中国的伟大构想,某工厂拟综合处理含 废水和工业废气(主要含
废水和工业废气(主要含 、
、 、
、 、
、 、
、 ,不考虑其他成分),设计了如下流程:
,不考虑其他成分),设计了如下流程:
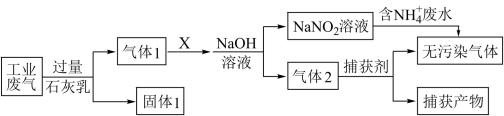
下列说法正确的是
 废水和工业废气(主要含
废水和工业废气(主要含 、
、 、
、 、
、 、
、 ,不考虑其他成分),设计了如下流程:
,不考虑其他成分),设计了如下流程:
下列说法正确的是
A.固体1的成分为 、 、 |
| B.X可以是空气 |
C.捕获剂所捕获的气体主要是 |
D.处理含 废水时,发生的反应为 废水时,发生的反应为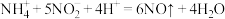 |
您最近一年使用:0次
2021-11-21更新
|
319次组卷
|
3卷引用:宁夏石嘴山市第三中学2021-2022学年高三上学期第二次月考化学试题
宁夏石嘴山市第三中学2021-2022学年高三上学期第二次月考化学试题吉林省东北师范大学附属中学2021-2022学年高三上学期第二次摸底考试化学试题(已下线)3.3 氮的循环-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)
7 . 下列反应的离子反应方程式正确的是
A.二氧化碳通入饱和碳酸钠溶液中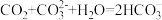 |
B.氯气通入冷的氢氧化钠溶液中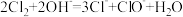 |
C.硫酸亚铁溶液中加入过氧化氢溶液 |
D. 使酸性 使酸性 溶液褪色: 溶液褪色: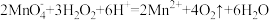 |
您最近一年使用:0次
2021-11-19更新
|
117次组卷
|
2卷引用:宁夏银川市景博中学2021-2022学年高三上学期第二次月考化学试题
8 . 高锰酸钾是一种强氧化剂,为紫黑色、细长的棱形结晶或颗粒,带蓝色的金属光泽,可溶于水。根据所学知识,回答下列问题:
(1)酸性条件下,高锰酸钾可与草酸( )溶液发生反应,其反应为
)溶液发生反应,其反应为 。
。
①补上产物,配平化学方程式___________ 。
②上述反应中 表现的性质有
表现的性质有___________ 。
(2)若将 通入硫酸酸化的
通入硫酸酸化的 溶液中,溶液褪色,生成
溶液中,溶液褪色,生成 ,此时溶液中仅有一种阴离子。写出发生反应的离子方程式:
,此时溶液中仅有一种阴离子。写出发生反应的离子方程式:___________ ,该反应中作还原剂的是___________ (填化学式)。
(3)高锰酸钾还可与浓盐酸反应,写出其化学方程式___________ ,其中浓盐酸表现酸性与还原性的物质的量之比为:___________ 。
(1)酸性条件下,高锰酸钾可与草酸(
 )溶液发生反应,其反应为
)溶液发生反应,其反应为 。
。①补上产物,配平化学方程式
②上述反应中
 表现的性质有
表现的性质有(2)若将
 通入硫酸酸化的
通入硫酸酸化的 溶液中,溶液褪色,生成
溶液中,溶液褪色,生成 ,此时溶液中仅有一种阴离子。写出发生反应的离子方程式:
,此时溶液中仅有一种阴离子。写出发生反应的离子方程式:(3)高锰酸钾还可与浓盐酸反应,写出其化学方程式
您最近一年使用:0次
9 . 水体中过量氨氮(以NH3表示)或总氮(溶液中所有可溶性的含氮化合物中氮元素总量)含量过高会导致水体富营养化。用次氯酸钠除去氨氮的一种原理如下图所示,下列说法正确的是
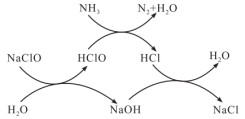

| A.NaClO除去氨氮的总反应化学方程式2NH3+3NaClO=N2+3NaCl+3H2O |
| B.整个过程中发生的反应都是氧化还原反应 |
| C.在较高温度下,氨氮去除率会升高 |
| D.NaClO投入过多,总氮去除率可能会升高 |
您最近一年使用:0次
2021-11-01更新
|
144次组卷
|
2卷引用:宁夏北方民族大学附属中学2022-2023学年高三上学期月考(一)理科综合化学试题
名校
10 . 现有下列10种物质:①铝,②纯醋酸,③CO2,④H2SO4,⑤Ba(OH)2,⑥红褐色的氢氧化铁胶体,⑦稀盐酸,⑧NaHSO4,⑨碳酸钙,⑩乙醇,请按要求书写离子方程式或化学方程式,
(1)上述物质中属于电解质的有_______ ,属于非电解质的有_______ ,既不属于电解质也不属于非电解质的有_______ (填序号)。
(2)写出⑧在水中的电离方程式为_______ 。
(3)向沸水中逐滴加入饱和FeCl3溶液,至液体呈透明的红褐色,写出化学方程式_______ 。
(4)已知酸性环境下,ClO-可将Mn2+氧化成MnO2,自身被还原成Cl-,该过程的离子反应方程式为_______ 。
(5)在酸性条件下,向含铬废水中加入FeSO4溶液,可将Cr2O 还原为Cr3+,该过程的离子方程式为
还原为Cr3+,该过程的离子方程式为_______ 。
(1)上述物质中属于电解质的有
(2)写出⑧在水中的电离方程式为
(3)向沸水中逐滴加入饱和FeCl3溶液,至液体呈透明的红褐色,写出化学方程式
(4)已知酸性环境下,ClO-可将Mn2+氧化成MnO2,自身被还原成Cl-,该过程的离子反应方程式为
(5)在酸性条件下,向含铬废水中加入FeSO4溶液,可将Cr2O
 还原为Cr3+,该过程的离子方程式为
还原为Cr3+,该过程的离子方程式为
您最近一年使用:0次
2021-10-29更新
|
212次组卷
|
2卷引用:宁夏吴忠中学2021-2022学年高三上学期线上教学测试化学试题



