1 . 叠氮化钠 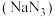 是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊等。回答下列问题:
是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊等。回答下列问题:
Ⅰ.实验室制备
水合肼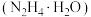 与亚硝酸甲酯
与亚硝酸甲酯 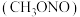 在氢氧化钠存在下制备
在氢氧化钠存在下制备  ,其反应装置如图所示:
,其反应装置如图所示: 无色无味,微溶于醇,溶于水。
无色无味,微溶于醇,溶于水。
(1)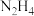 的电子式为
的电子式为_______ ; 晶体中阴离子与阳离子个数之比为
晶体中阴离子与阳离子个数之比为_______ 。
(2)装置中多孔球泡的作用是_______ 。
(3)锥形瓶中水合与亚硝酸甲酯在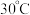 时可以反应生成叠氮化钠、甲醇等物质,写出该反应的化学方程式:
时可以反应生成叠氮化钠、甲醇等物质,写出该反应的化学方程式:_______ 。
Ⅱ.回收甲醇
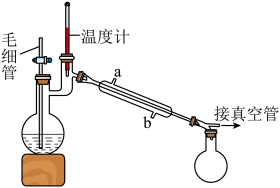
将制备反应后所得混合溶液加入烧瓶中,按照图所示装置进行减压蒸馏。
①
② 在
在 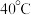 时分解。
时分解。
(4)实验时冷凝管中冷却水要_______ (填“ 进
进  出”或 “
出”或 “ 进
进  出”)。
出”)。
(5)甲醇回收时需用减压蒸馏的原因是_______ 。
Ⅲ.产品提取及纯度测定
将蒸馏后所得母液降温结晶,过滤得 湿品;再用去离子水重结晶得
湿品;再用去离子水重结晶得  产品并用碘量法测定产品纯度。取产品
产品并用碘量法测定产品纯度。取产品  加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入
加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入  溶液,溶液呈紫红色;再加入足量
溶液,溶液呈紫红色;再加入足量 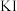 溶液消耗过量的
溶液消耗过量的 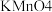 溶液;其后用
溶液;其后用 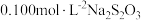 ,标准溶液滴定所产生的
,标准溶液滴定所产生的 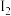 ,消耗
,消耗  溶液
溶液 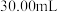 。
。
(6)实验所得产品的纯度为_______ ;若加入的 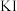 溶液有部分被空气中的氧气氧化,则测得产品的纯度
溶液有部分被空气中的氧气氧化,则测得产品的纯度_______ (填“偏低”、“偏高”、“不变”)。
已知:①产品中杂质不参与反应。
②测定过程中发生的反应:
 ;
;
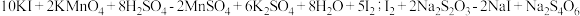 。
。
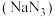 是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊等。回答下列问题:
是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊等。回答下列问题:Ⅰ.实验室制备

水合肼
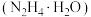 与亚硝酸甲酯
与亚硝酸甲酯 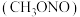 在氢氧化钠存在下制备
在氢氧化钠存在下制备  ,其反应装置如图所示:
,其反应装置如图所示:
 无色无味,微溶于醇,溶于水。
无色无味,微溶于醇,溶于水。(1)
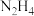 的电子式为
的电子式为 晶体中阴离子与阳离子个数之比为
晶体中阴离子与阳离子个数之比为(2)装置中多孔球泡的作用是
(3)锥形瓶中水合与亚硝酸甲酯在
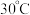 时可以反应生成叠氮化钠、甲醇等物质,写出该反应的化学方程式:
时可以反应生成叠氮化钠、甲醇等物质,写出该反应的化学方程式:Ⅱ.回收甲醇
将制备反应后所得混合溶液加入烧瓶中,按照图所示装置进行减压蒸馏。
①
| 物质 |  |  |  |
沸点  | 64.7 | 113.5 | 300 |
 在
在 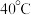 时分解。
时分解。(4)实验时冷凝管中冷却水要
 进
进  出”或 “
出”或 “ 进
进  出”)。
出”)。(5)甲醇回收时需用减压蒸馏的原因是
Ⅲ.产品提取及纯度测定
将蒸馏后所得母液降温结晶,过滤得
 湿品;再用去离子水重结晶得
湿品;再用去离子水重结晶得  产品并用碘量法测定产品纯度。取产品
产品并用碘量法测定产品纯度。取产品  加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入
加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入  溶液,溶液呈紫红色;再加入足量
溶液,溶液呈紫红色;再加入足量 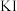 溶液消耗过量的
溶液消耗过量的 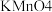 溶液;其后用
溶液;其后用 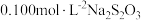 ,标准溶液滴定所产生的
,标准溶液滴定所产生的 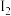 ,消耗
,消耗  溶液
溶液 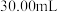 。
。(6)实验所得产品的纯度为
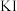 溶液有部分被空气中的氧气氧化,则测得产品的纯度
溶液有部分被空气中的氧气氧化,则测得产品的纯度已知:①产品中杂质不参与反应。
②测定过程中发生的反应:
 ;
;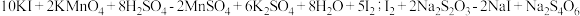 。
。
您最近一年使用:0次
名校
解题方法
2 . 控制、治理氮氧化物对大气的污染是改善大气质量的证要方面。
(1)火力发电厂的燃煤排烟中含大量的氮氧化物( ),可利用甲烷和
),可利用甲烷和 在一条件下反应消除其污染,那么
在一条件下反应消除其污染,那么 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
(2)在一密闭容器中发生反应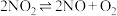 ,反应过程中
,反应过程中 的浓度随时间变化的情况如以下图所示。请回答:
的浓度随时间变化的情况如以下图所示。请回答:
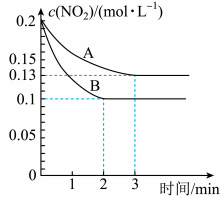
①依曲线A,反应在前3min内氧气的平均反应速率为___________ 。(保留三位有效数字)
②假设曲线A、B分别表示的是该反应在某不同条件下的反应情况,那么此条件是___________ 。(填“浓度”、“压强”、“温度”或“催化剂”)
③曲线A、B分别对应的反应平衡常数的大小关系是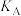
___________ 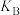 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(3)一定温度下,密闭容器中 可发生以下反应:
可发生以下反应:
 I
I
 Ⅱ
Ⅱ
那么反应I的平衡常数表达式为___________ 。假设达平衡时, ,
,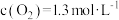 ,那么反应Ⅱ中
,那么反应Ⅱ中 的转化率为
的转化率为___________ , (g)的起始浓度不低于
(g)的起始浓度不低于___________  。
。
(1)火力发电厂的燃煤排烟中含大量的氮氧化物(
 ),可利用甲烷和
),可利用甲烷和 在一条件下反应消除其污染,那么
在一条件下反应消除其污染,那么 与
与 反应的化学方程式为
反应的化学方程式为(2)在一密闭容器中发生反应
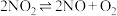 ,反应过程中
,反应过程中 的浓度随时间变化的情况如以下图所示。请回答:
的浓度随时间变化的情况如以下图所示。请回答:
①依曲线A,反应在前3min内氧气的平均反应速率为
②假设曲线A、B分别表示的是该反应在某不同条件下的反应情况,那么此条件是
③曲线A、B分别对应的反应平衡常数的大小关系是
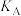
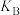 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(3)一定温度下,密闭容器中
 可发生以下反应:
可发生以下反应: I
I Ⅱ
Ⅱ那么反应I的平衡常数表达式为
 ,
,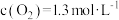 ,那么反应Ⅱ中
,那么反应Ⅱ中 的转化率为
的转化率为 (g)的起始浓度不低于
(g)的起始浓度不低于 。
。
您最近一年使用:0次
2024-04-05更新
|
69次组卷
|
2卷引用:湖南省常德市汉寿县第一中学2023-2024学年高三下学期3月月考化学试题
3 . 某研究小组以TiCl4为原料制备新型耐热材料TiN。
步骤一:TiCl4水解制备TiO2(实验装置如图A,夹持装置省略):滴入TiCl4,边搅拌边加热,使混合液升温至80℃,保温3小时。离心分离白色沉淀TiO2·xH2O并洗涤,煅烧制得TiO2。
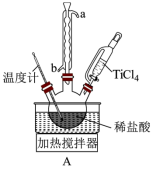
(1)装置A中冷凝水的入口为_______ (填“a”或“b”)。
(2)三颈烧瓶中预置的稀盐酸可抑制胶体形成、促进白色沉淀生成。 水解生成的胶体主要成分为
水解生成的胶体主要成分为_______ (填化学式)。
(3)判断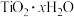 沉淀是否洗涤干净,可使用的检验试剂有
沉淀是否洗涤干净,可使用的检验试剂有_______ 。
步骤二:由 制备TiN并测定产率(实验装置如下图,夹持装置省略)。
制备TiN并测定产率(实验装置如下图,夹持装置省略)。

(4)装置C中试剂X为_______ 。
(5)装置D中反应生成TiN、N2和H2O,该反应的化学方程式为_______ 。
(6)装置E的作用是吸收水和_______ 。
(7)实验中部分操作如下:
a.反应前,称取0.800gTiO2样品; b.打开装置B中恒压滴液漏斗旋塞;
c.关闭装置B中恒压滴液漏斗旋塞; d.打开管式炉加热开关,加热至800℃左右;
e.关闭管式炉加热开关,待装置冷却; f.反应后,称得瓷舟中固体质量为0.496g。
①正确的操作顺序为:a→b→d→c→c→f。
②TiN的产率为_______ 。
步骤一:TiCl4水解制备TiO2(实验装置如图A,夹持装置省略):滴入TiCl4,边搅拌边加热,使混合液升温至80℃,保温3小时。离心分离白色沉淀TiO2·xH2O并洗涤,煅烧制得TiO2。

(1)装置A中冷凝水的入口为
(2)三颈烧瓶中预置的稀盐酸可抑制胶体形成、促进白色沉淀生成。
 水解生成的胶体主要成分为
水解生成的胶体主要成分为(3)判断
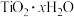 沉淀是否洗涤干净,可使用的检验试剂有
沉淀是否洗涤干净,可使用的检验试剂有步骤二:由
 制备TiN并测定产率(实验装置如下图,夹持装置省略)。
制备TiN并测定产率(实验装置如下图,夹持装置省略)。
(4)装置C中试剂X为
(5)装置D中反应生成TiN、N2和H2O,该反应的化学方程式为
(6)装置E的作用是吸收水和
(7)实验中部分操作如下:
a.反应前,称取0.800gTiO2样品; b.打开装置B中恒压滴液漏斗旋塞;
c.关闭装置B中恒压滴液漏斗旋塞; d.打开管式炉加热开关,加热至800℃左右;
e.关闭管式炉加热开关,待装置冷却; f.反应后,称得瓷舟中固体质量为0.496g。
①正确的操作顺序为:a→b→d→c→c→f。
②TiN的产率为
您最近一年使用:0次
4 . 五氧化二钒( )为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为
)为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为 ,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备
,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备 的一种流程如图所示:
的一种流程如图所示:
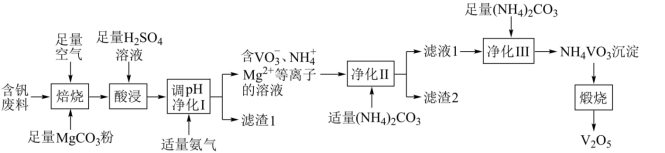
已知:①含钒离子在溶液中的存在形式与溶液pH的关系
②25℃时,难溶电解质的溶度积常数如表所示:
请回答下列问题:
(1)写出基态V原子的价层电子排布式:___________ 。
(2)“焙烧”的目的之一是将 转化成
转化成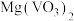 ,请写出转化的化学方程式:
,请写出转化的化学方程式:___________ 。
(3)“酸浸”时,为了提升各物质的浸出速率,除了适当升高温度外,还可以采取的措施是___________ (写一条即可)。
(4)25℃,“调pH净化Ⅰ”时需将 、
、 、
、 三种离子去除干净(浓度
三种离子去除干净(浓度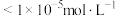 时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为
时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为___________ 。
(5)“净化Ⅱ”的目的是除 、
、 ,若该过程加入过量
,若该过程加入过量 ,可能导致的结果是
,可能导致的结果是___________ 。
(6)“滤液1”中加入 的目的是将
的目的是将 变成沉淀偏钒酸铵(
变成沉淀偏钒酸铵( ),简称“沉钒”。“沉钒”得到的
),简称“沉钒”。“沉钒”得到的 需进行洗涤、干燥,请写出证明
需进行洗涤、干燥,请写出证明 已洗净的实验操作及现象:
已洗净的实验操作及现象:___________ 。
(7)煅烧 得到的产物中,可以在该流程中循环利用的物质是
得到的产物中,可以在该流程中循环利用的物质是___________ 。
(8)为测定该产品的纯度,某同学准确称取 产品1.000g,加入过量稀硫酸使其完全转化成
产品1.000g,加入过量稀硫酸使其完全转化成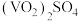 ,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的
,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的 标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中
标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中 被氧化为
被氧化为 ,该产品的纯度为
,该产品的纯度为___________ 。(计算结果保留两位小数)
 )为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为
)为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为 ,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备
,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备 的一种流程如图所示:
的一种流程如图所示:
已知:①含钒离子在溶液中的存在形式与溶液pH的关系
| 溶液pH | <4.0 | 6.0≤pH≤8.0 | >8.0 |
| 钒元素存在形式 |  |  | 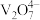 |
| 难溶电解质 |  | 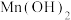 |  |  |  |  |
 | 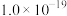 | 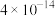 |  |  | 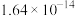 |  |
(1)写出基态V原子的价层电子排布式:
(2)“焙烧”的目的之一是将
 转化成
转化成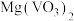 ,请写出转化的化学方程式:
,请写出转化的化学方程式:(3)“酸浸”时,为了提升各物质的浸出速率,除了适当升高温度外,还可以采取的措施是
(4)25℃,“调pH净化Ⅰ”时需将
 、
、 、
、 三种离子去除干净(浓度
三种离子去除干净(浓度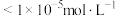 时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为
时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为(5)“净化Ⅱ”的目的是除
 、
、 ,若该过程加入过量
,若该过程加入过量 ,可能导致的结果是
,可能导致的结果是(6)“滤液1”中加入
 的目的是将
的目的是将 变成沉淀偏钒酸铵(
变成沉淀偏钒酸铵( ),简称“沉钒”。“沉钒”得到的
),简称“沉钒”。“沉钒”得到的 需进行洗涤、干燥,请写出证明
需进行洗涤、干燥,请写出证明 已洗净的实验操作及现象:
已洗净的实验操作及现象:(7)煅烧
 得到的产物中,可以在该流程中循环利用的物质是
得到的产物中,可以在该流程中循环利用的物质是(8)为测定该产品的纯度,某同学准确称取
 产品1.000g,加入过量稀硫酸使其完全转化成
产品1.000g,加入过量稀硫酸使其完全转化成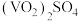 ,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的
,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的 标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中
标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中 被氧化为
被氧化为 ,该产品的纯度为
,该产品的纯度为
您最近一年使用:0次
解题方法
5 . 如图,是工业生产中除去电石渣浆(含CaO)中的 并制取硫酸盐的一种常用流程。下列说法错误的是
并制取硫酸盐的一种常用流程。下列说法错误的是
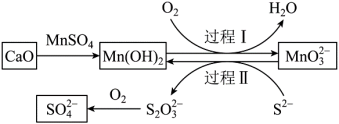
 并制取硫酸盐的一种常用流程。下列说法错误的是
并制取硫酸盐的一种常用流程。下列说法错误的是
A.碱性条件下,氧化性: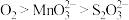 |
| B.过程Ⅰ中氧化剂和还原剂物质的量之比为1∶2 |
C.过程Ⅰ中,反应的离子方程式为 |
D.将1mol  转化为 转化为 理论上需要 理论上需要 的体积为22.4L(标准状况) 的体积为22.4L(标准状况) |
您最近一年使用:0次
解题方法
6 . 下列方程式错误的是
A.在弱碱性条件下,FeS与 反应: 反应: |
B.将少量浓氨水滴入盛有CaO的烧瓶制备 : : |
C.小苏打与明矾共溶于水,产生大量气泡: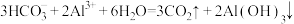 |
D.铅酸蓄电池正极反应: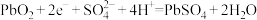 |
您最近一年使用:0次
名校
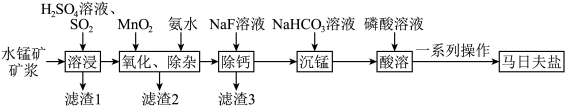
7 . 马日夫盐[Mn(H2PO4)2•2H2O]常用于机械设备的磷化处理,可起到防锈效果。以水锰矿[主要成分为MnO(OH),还含有少量的Fe2O3、SiO2及微量的CaO、Al2O3]为原料制备马日夫盐的一种工艺流程如图所示。
已知:①25℃时,金属离子在水溶液中的平衡浓度的对数与溶液的pH的关系如图所示。此实验条件下Mn2+开始沉淀的pH=7.54。
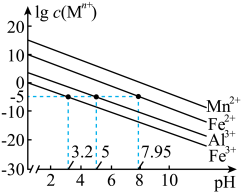
②当溶液中剩余的某金属离子浓度≤1×10-5mol/L时,通常认为该金属离子已沉淀完全。
回答下列问题:
(1)“溶浸”过程中主要成分发生反应的化学方程式为_______ ,为提高SO2的吸收率,可采取的措施是_______ (写出两条即可)。
(2)“滤渣2”的主要成分为_______ (写化学式)。“氧化、除杂”步骤中不宜使用H2O2替代MnO2,原因是_______ 。加入氨水的目的是调节pH,应控制pH的范围是________ 之间。
(3)加入NaF可以使Ca2+转化为CaF,沉淀除去,要使Ca2+完全沉淀,该步骤中应控制溶液中F-浓度不小于______ mol/L。[已知:Ksp(CaF2)=3.6×10-12]。
(4)“沉锰”步骤中Mn2+转化为MnCO3沉淀,反应的离子方程式为_______ 。
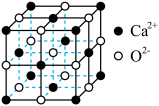
(5)CaO晶胞的结构如图所示,CaO晶体中Ca2+的配位数为______ ,距离最近的Ca2+和O2-的核间距为apm,则CaO晶体的密度为_______ g/cm3(列出计算式,阿伏加德罗常数的值为NA)。

已知:①25℃时,金属离子在水溶液中的平衡浓度的对数与溶液的pH的关系如图所示。此实验条件下Mn2+开始沉淀的pH=7.54。

②当溶液中剩余的某金属离子浓度≤1×10-5mol/L时,通常认为该金属离子已沉淀完全。
回答下列问题:
(1)“溶浸”过程中主要成分发生反应的化学方程式为
(2)“滤渣2”的主要成分为
(3)加入NaF可以使Ca2+转化为CaF,沉淀除去,要使Ca2+完全沉淀,该步骤中应控制溶液中F-浓度不小于
(4)“沉锰”步骤中Mn2+转化为MnCO3沉淀,反应的离子方程式为
(5)CaO晶胞的结构如图所示,CaO晶体中Ca2+的配位数为

您最近一年使用:0次
2024-03-18更新
|
385次组卷
|
3卷引用:湖南省衡阳市第八中学2024届高三模拟预测信息卷(一)化学试题
解题方法
8 . 钴(Co)合金广泛应用于机械制造等领域。
(1)Co2+和Fe3+与KSCN溶液发生的反应相似。向CoCl2溶液中加入KSCN溶液,生成某种带有两个单位负电荷的蓝色离子,其化学式为_____ 。
(2)推测Co+催化剂表面促进NH3还原NOx的反应历程如图所示。
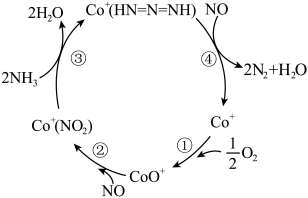
①在反应②中NO作_____ (填“氧化剂”或“还原剂”),与反应④中NO的作用_____ (填“是”或“不是”)一样的。
②写出步骤③对应的离子方程式:_____ 。
③整个历程中氧化剂与还原剂的物质的量之比为_____ 。
(3)现将35.7gCoCO3在空气中加热,可得24.1g钴的氧化物和另一种氧化物。试写出CoCO3在空气中受热时发生反应的化学方程式:_____ 。
(1)Co2+和Fe3+与KSCN溶液发生的反应相似。向CoCl2溶液中加入KSCN溶液,生成某种带有两个单位负电荷的蓝色离子,其化学式为
(2)推测Co+催化剂表面促进NH3还原NOx的反应历程如图所示。

①在反应②中NO作
②写出步骤③对应的离子方程式:
③整个历程中氧化剂与还原剂的物质的量之比为
(3)现将35.7gCoCO3在空气中加热,可得24.1g钴的氧化物和另一种氧化物。试写出CoCO3在空气中受热时发生反应的化学方程式:
您最近一年使用:0次
解题方法
9 . 下列离子方程式与实验对应正确的是
| 选项 | 实验 | 离子方程式 |
| A | 向Na2S2O3溶液中加入稀硝酸 | S2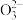 +2H+=SO2↑+S↓+H2O +2H+=SO2↑+S↓+H2O |
| B | 用K3[Fe(CN)6]溶液检测FeCl2溶液中的Fe2+ | 2[Fe(CN)6]3-+3Fe2+=Fe3[Fe(CN)6]2↓ |
| C | 向NH4Al(SO4)2溶液中滴加过量NaOH溶液 | N +Al3++4OH-=NH3·H2O+Al(OH)3↓ +Al3++4OH-=NH3·H2O+Al(OH)3↓ |
| D | 向K2MnO4溶液(墨绿色)中加入适量醋酸 溶液变为紫色且有黑色沉淀生成 | 3Mn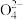 +4H+=2Mn +4H+=2Mn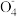 +MnO2↓+2H2O +MnO2↓+2H2O |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
10 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 和
和 )。实现钴、镍、镁元素的回收。
)。实现钴、镍、镁元素的回收。
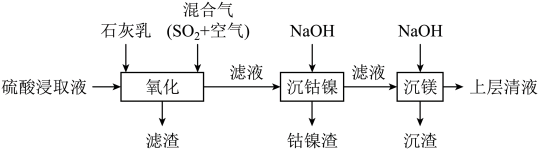
已知:
回答下列问题:
(1)基态Co原子的价层电子轨道表示式为___________ 。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(已知 的电离方程式为:
的电离方程式为: 、
、 )。“氧化”中先用石灰乳调节
)。“氧化”中先用石灰乳调节 ,再加入“混合气”,
,再加入“混合气”, 被
被 氧化为
氧化为 ,该氧化还原反应过程的离子方程式为:
,该氧化还原反应过程的离子方程式为:___________ ;得到滤渣的主要成分为 、
、___________ (填化学式)。
(3)“沉钴镍”中得到的 在空气中可被氧化成
在空气中可被氧化成 ,该反应的化学方程式为:
,该反应的化学方程式为:___________ 。
(4)“沉镁”中为使 沉淀完全(25℃),需控制pH不低于
沉淀完全(25℃),需控制pH不低于___________ (精确至0.1)。
(5)钴镍渣是湿法炼锌净化渣之一,其中含有少量Co(Ⅱ)、Cd(Ⅱ)、Fe(Ⅱ)、Ni(Ⅱ)的硫酸盐及氢氧化物。利用以下工艺流程回收金属并制备氧化锌:

下列说法正确的是:___________(填标号)。
(6)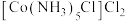 可用作聚氯乙烯的染色剂和稳定剂。氨气中
可用作聚氯乙烯的染色剂和稳定剂。氨气中 的键角比该配合物中
的键角比该配合物中 的键角小,其原因是
的键角小,其原因是___________ 。
 、
、 、
、 、
、 、
、 和
和 )。实现钴、镍、镁元素的回收。
)。实现钴、镍、镁元素的回收。
已知:
| 物质 |  |  |  |  |
 |  | 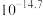 | 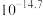 | 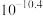 |
(1)基态Co原子的价层电子轨道表示式为
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(已知
 的电离方程式为:
的电离方程式为: 、
、 )。“氧化”中先用石灰乳调节
)。“氧化”中先用石灰乳调节 ,再加入“混合气”,
,再加入“混合气”, 被
被 氧化为
氧化为 ,该氧化还原反应过程的离子方程式为:
,该氧化还原反应过程的离子方程式为: 、
、(3)“沉钴镍”中得到的
 在空气中可被氧化成
在空气中可被氧化成 ,该反应的化学方程式为:
,该反应的化学方程式为:(4)“沉镁”中为使
 沉淀完全(25℃),需控制pH不低于
沉淀完全(25℃),需控制pH不低于(5)钴镍渣是湿法炼锌净化渣之一,其中含有少量Co(Ⅱ)、Cd(Ⅱ)、Fe(Ⅱ)、Ni(Ⅱ)的硫酸盐及氢氧化物。利用以下工艺流程回收金属并制备氧化锌:

下列说法正确的是:___________(填标号)。
| A.粉碎矿渣、升高温度均可以提高“溶浸”率 |
B.通过高温焙烧可以将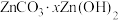 制得氧化锌 制得氧化锌 |
C.根据 中S的化合价分析, 中S的化合价分析, 具有强还原性 具有强还原性 |
D. 可与浓盐酸反应生成 可与浓盐酸反应生成 , , 参与反应可生成 参与反应可生成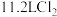 |
(6)
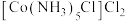 可用作聚氯乙烯的染色剂和稳定剂。氨气中
可用作聚氯乙烯的染色剂和稳定剂。氨气中 的键角比该配合物中
的键角比该配合物中 的键角小,其原因是
的键角小,其原因是
您最近一年使用:0次



