 、
、 ,还有少量其他不溶于酸溶液和碱溶液的物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体
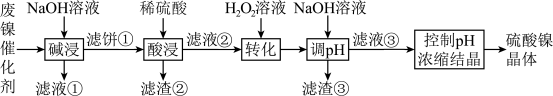
,还有少量其他不溶于酸溶液和碱溶液的物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体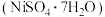 :
:
室温下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 |
|
|
|
|
开始沉淀时 | 7 | 4 | 2 | 8 |
沉淀完全时 | 9 | 5 | 3 | 9 |
(1)“碱浸”时需要充分搅拌,其目的是
(2)“碱浸”中NaOH的作用除去除催化剂表面的油脂外,还与催化剂中Al和
 反应生成
反应生成(3)“滤液②”中主要含有金属离子“
 ”和“
”和“ ”,则“转化”中加入
”,则“转化”中加入 的主要作用是
的主要作用是(4)写出
 的溶度积常数的表达式
的溶度积常数的表达式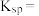
 的溶度积常数
的溶度积常数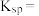
 浓度为
浓度为 ,则“调pH”应控制pH不超过
,则“调pH”应控制pH不超过(1)美国科学家曾宣称:普通盐水在某种无线电波照射下可以燃烧,这一发现有望解决用水作人类能源的重大问题。无线电波可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种电波下持续燃烧。上述“结合力”的实质是___________(填标号)。
| A.范德华力 | B.氢键 | C.非极性共价键 | D.极性共价键 |
①一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其模拟图如图所示:

采用弱电场使水结成“热冰”,说明水分子是
②用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。释放出来的电子可以被若干水分子形成的“网”捕获而形成水合电子,你认为水分子间能形成“网”的原因是
已知:①常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Mn(OH)2]=2×10-13;
②离子浓度小于等于10-5mol/L时认为沉淀完全;
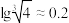 。
。回答下列问题:
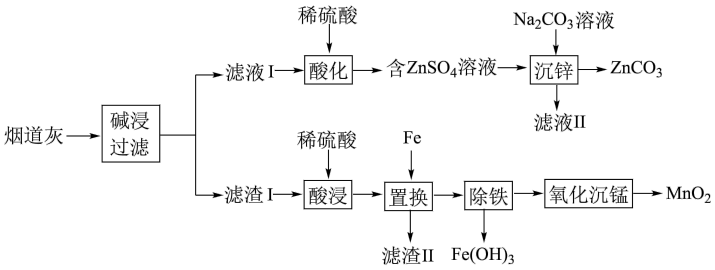
(1)“碱浸”时,Zn被浸出转化为Na2Zn(OH)4,Na2Zn(OH)4中Zn元素的化合价为
(2)“沉锌”时防止碱性过强生成Zn(OH)2,可采取的措施为
(3)滤渣II的主要成分为
(4)“除铁”时先加入过量的H2O2溶液将Fe2+氧化为Fe3+,发生反应的离子方程式为
(5)“氧化沉锰”过程中,MnSO4经O2氧化转化为MnO2,该反应中氧化剂和还原剂的物质的量之比为
(1)KMnO4溶液应放在
(2)写出KMnO4与H2C2O4反应的离子方程式
(3)滴定终点的现象为
(4)某学生根据 3次实验分别记录有关数据如下表:
滴定次数 | 待测H2C2O4溶液的体积/mL | 0.1000 mol·L-1 KMnO4的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
②下列操作中可能使测定结果偏低的是
A.酸式滴定管未用标准液润洗就直接注入 KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
(5)滴定实验中一般要选择合适的指示剂,下列滴定中指示剂的选择或滴定终点颜色变化错误的是
提示:2KMnO4+5K2SO3+3H2SO4=6K2SO4+2MnSO4+3H2O、I2+Na2S=2NaI+S↓。
选项 | 滴定管中的溶液 | 锥形瓶中的溶液 | 指示剂 | 滴定终点颜色变化 |
A | NaOH溶液 | CH3COOH溶液 | 酚酞 | 无色→浅红色 |
B | 盐酸 | 氨水 | 甲基橙 | 黄色→橙色 |
C | 酸性KMnO4溶液 | K2SO3溶液 | 无 | 无色→浅紫红色 |
D | 碘水 | Na2S溶液 | 淀粉 | 蓝色→无色 |
(1)NaNO2是一种重要的化工原料,有毒,NaNO2也是一种食品添加剂,使用时须严格控制用量。已知:HNO2有强氧化性,酸性H2SO3>HNO2>CH3COOH。
①氮原子核外共有
②亚硝酰氯(NOCl)是一种红褐色液体,每个原子最外层都达到8e-结构,则其电子式为
③往冷的NaNO2溶液中加入下列某种物质可得HNO2稀溶液,该物质是
a.稀硫酸 b.二氧化碳 c.二氧化硫 d.醋酸
(2)砷化镓(GaAs)是当前最重要,技术成熟度最高的半导体材料之一,我国“玉兔二号”月球车就是通过砷化镓太阳能电池提供能量。基态As原子外围电子排布式为
(3)GaN是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中。工业上以镓粉为原料,用镍催化法生产GaN,在氨气流中于1050~1100℃下加热30min可制得疏松的灰色粉末状GaN,同时得到一种单质,请写出对应的化学方程式
(1)Z在周期表中的位置是
(2)RZ2的结构式是
(3)H2ZW3在水中电离的方程式为
(4)某传感器可以检测空气中ZW2的含量,工作原理如图所示。则电流流向为
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | H2O/mL | 温度/℃ | KMnO4溶液褪色时间(s) | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||||
| ① | 0.20 | 2.0 | 0.010 | 4.0 | V | 25 | t1 |
| ② | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
| ③ | 0.20 | 4.0 | 0.010 | 4.0 | 0 | T | t3 |
(2)上述反应的化学方程式为
(3)t1
(4)有同学做实验时发现,反应开始时溶液褪色慢,但反应一段时间后溶液褪色明显加快。该同学猜测是催化剂加快了化学反应速率,要证实猜测,除选择硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择以下试剂中的
A.硫酸钾 B.硫酸锰 C.硫酸 D.氯化锰 E.蒸馏水
(1)NaNO2俗称“工业盐”,其外观与食盐相似,误食会中毒,可通过化学实验加以鉴别。如向NaNO2的酸性溶液中加入KI固体,析出的碘单质可以使淀粉溶液变蓝色,据此检验
 。
。①该反应中被氧化的元素是
②完成下列反应的化学方程式并配平:NaNO2+KI+H2SO4= + +I2+NO↑+ ,
③标准状况下,该反应中每转移1mol e-,生成气体的体积是
(2)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:2NO2+Na2CO3=NaNO2+NaNO3+CO2↑。每产生33.6L(标准状况下)CO2,吸收液质量将增加
| A.Cl2 | B.Cl2O7 | C.ClO2 | D.Cl2O |
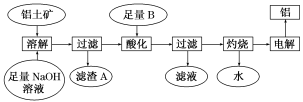
已知:(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为2Na2SiO3+2NaAlO2+2H2O===Na2Al2Si2O8↓+4NaOH。
请回答下列问题:
(1)铝土矿中Al2O3与氢氧化钠溶液反应的离子方程式为
(2)在工艺流程中“酸化”时,加入的最佳物质B是
写出酸化过程发生反应的化学方程式
(3)工业上用Al2O3与C、Cl2在高温条件下反应制取AlCl3,理论上每消耗6.0 g碳单质,转移1 mol电子,则反应的化学方程式为
(4)某同学推测铝与氧化铁发生铝热反应得到的熔融物中还含有Fe2O3,设计了如下方案来验证:取一块该熔融物投入少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3。
则物质甲是



 的pH
的pH 的pH
的pH

