1 . 采用选择性催化还原技术(SCR)可以有效脱除烟气中的氮氧化物( )。
)。
(1)钒基催化剂(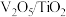 催化剂)可用于
催化剂)可用于 ,反应机理与催化剂表面
,反应机理与催化剂表面 的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示:
的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示: 的总反应化学方程式为
的总反应化学方程式为___________ ,该反应的中间体有___________ 种。
②若烟气中含有硫的氧化物,则会降低 的速率,可能的原因是
的速率,可能的原因是___________ 。
(2)研究发现:当烟气中 和
和 的物质的量相同时,会发生快速SCR反应过程:
的物质的量相同时,会发生快速SCR反应过程: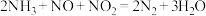 。臭氧对
。臭氧对 具有一定的辅助作用。臭氧先氧化
具有一定的辅助作用。臭氧先氧化 ,发生反应:
,发生反应: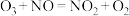 。在不同温度下,经过相同时间后测得
。在不同温度下,经过相同时间后测得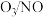 的物质的量之比与
的物质的量之比与 的脱除率关系如图乙所示。
的脱除率关系如图乙所示。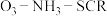 中
中 脱除率均有不同程度的降低,其原因是
脱除率均有不同程度的降低,其原因是___________ (写两条)。
②温度低于250℃,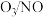 物质的量之比为0.5时,
物质的量之比为0.5时, 脱除率较高的原因是
脱除率较高的原因是___________ 。
③实验发现,向烟气中先通入 ,
, 脱除率低于先通入
脱除率低于先通入 ,可能的原因是
,可能的原因是___________
(3)以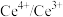 为媒介的间接电化学氧化法可以同时除去烟气中的
为媒介的间接电化学氧化法可以同时除去烟气中的 和
和 ,装置如图丙所示:
,装置如图丙所示:___________ , 参与反应的离子方程式为
参与反应的离子方程式为___________ 。
 )。
)。(1)钒基催化剂(
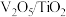 催化剂)可用于
催化剂)可用于 ,反应机理与催化剂表面
,反应机理与催化剂表面 的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示:
的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示: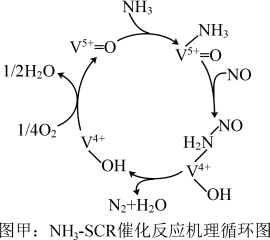
 的总反应化学方程式为
的总反应化学方程式为②若烟气中含有硫的氧化物,则会降低
 的速率,可能的原因是
的速率,可能的原因是(2)研究发现:当烟气中
 和
和 的物质的量相同时,会发生快速SCR反应过程:
的物质的量相同时,会发生快速SCR反应过程: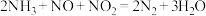 。臭氧对
。臭氧对 具有一定的辅助作用。臭氧先氧化
具有一定的辅助作用。臭氧先氧化 ,发生反应:
,发生反应: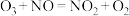 。在不同温度下,经过相同时间后测得
。在不同温度下,经过相同时间后测得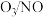 的物质的量之比与
的物质的量之比与 的脱除率关系如图乙所示。
的脱除率关系如图乙所示。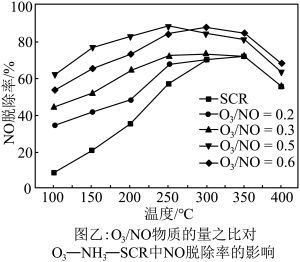
 中
中 脱除率均有不同程度的降低,其原因是
脱除率均有不同程度的降低,其原因是②温度低于250℃,
 物质的量之比为0.5时,
物质的量之比为0.5时, 脱除率较高的原因是
脱除率较高的原因是③实验发现,向烟气中先通入
 ,
, 脱除率低于先通入
脱除率低于先通入 ,可能的原因是
,可能的原因是(3)以
 为媒介的间接电化学氧化法可以同时除去烟气中的
为媒介的间接电化学氧化法可以同时除去烟气中的 和
和 ,装置如图丙所示:
,装置如图丙所示: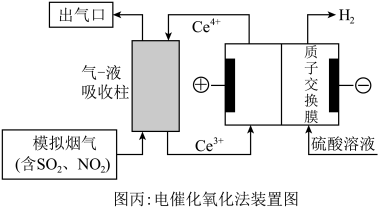
 参与反应的离子方程式为
参与反应的离子方程式为
您最近半年使用:0次
名校
解题方法
2 . 工业上以软锰矿(主要成分为MnO2,还含有少量Fe2O3)和辉钼矿(主要成分为MoS2,还含有少量Si、Ni的氧化物)为原料,制备四钼酸铵晶体[(NH4)2Mo4O13 2H2O]和硫酸锰晶体的工艺流程如下:
2H2O]和硫酸锰晶体的工艺流程如下:  分别为19.4和12.6;
分别为19.4和12.6; 。
。
回答下列问题:
(1)为了提高焙烧效率,可以采取的措施有___________ (写一条即可);“高温焙烧”时MnO2、MoS2转化为MnMoO4、MnSO4,写出该反应的化学方程式___________ 。
(2)“除铁”过程中加入碳酸钠调节溶液的pH至2,生成难溶于水的黄钠铁矾[NaFe3(SO4)2(OH)6],写出该反应的离子方程式___________ 。
(3)“除铁”后的溶液中c(Mn2+)=0.5 mol L-1,当溶液中可溶组分浓度c≤10-5mol
L-1,当溶液中可溶组分浓度c≤10-5mol L-1时,可认为已除尽,则“除镍”应控制溶液pH的范围是
L-1时,可认为已除尽,则“除镍”应控制溶液pH的范围是___________ [已知pc(S2-)=-lgc(S2-),该溶液中pc(S2-)和pH的关系为pc(S2-)=15.1-pH;忽略溶液体积变化]。
(4)硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如下图所示。从过滤所得的滤液中获得较高纯度MnSO4 H2O的操作是:控制温度在80~90 ℃之间蒸发结晶,
H2O的操作是:控制温度在80~90 ℃之间蒸发结晶,___________ ,使固体MnSO4 H2O与溶液分离,
H2O与溶液分离,___________ ,真空干燥。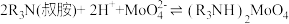 ,则“反萃取”中的试剂X最适宜选用
,则“反萃取”中的试剂X最适宜选用___________ (填标号)。
a.稀硫酸 b.(NH4)2SO4溶液 c.NaOH溶液 d.氨水
从“母液”中回收的副产品主要是___________ (填名称)。
 2H2O]和硫酸锰晶体的工艺流程如下:
2H2O]和硫酸锰晶体的工艺流程如下: 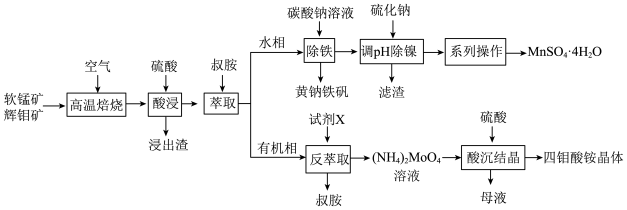
 分别为19.4和12.6;
分别为19.4和12.6; 。
。回答下列问题:
(1)为了提高焙烧效率,可以采取的措施有
(2)“除铁”过程中加入碳酸钠调节溶液的pH至2,生成难溶于水的黄钠铁矾[NaFe3(SO4)2(OH)6],写出该反应的离子方程式
(3)“除铁”后的溶液中c(Mn2+)=0.5 mol
 L-1,当溶液中可溶组分浓度c≤10-5mol
L-1,当溶液中可溶组分浓度c≤10-5mol L-1时,可认为已除尽,则“除镍”应控制溶液pH的范围是
L-1时,可认为已除尽,则“除镍”应控制溶液pH的范围是(4)硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如下图所示。从过滤所得的滤液中获得较高纯度MnSO4
 H2O的操作是:控制温度在80~90 ℃之间蒸发结晶,
H2O的操作是:控制温度在80~90 ℃之间蒸发结晶, H2O与溶液分离,
H2O与溶液分离,
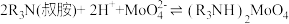 ,则“反萃取”中的试剂X最适宜选用
,则“反萃取”中的试剂X最适宜选用a.稀硫酸 b.(NH4)2SO4溶液 c.NaOH溶液 d.氨水
从“母液”中回收的副产品主要是
您最近半年使用:0次
名校
解题方法
3 . FeO(OH)在高档涂料、油墨等领域有着广泛的应用。以铁泥(主要含Fe2O3,以及少量的 、
、 、SiO2)为原料制备FeO(OH)的流程如图所示。
、SiO2)为原料制备FeO(OH)的流程如图所示。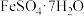 溶于水,不溶于乙醇。回答下列问题:
溶于水,不溶于乙醇。回答下列问题:
(1)滤液①的溶质为H2SO4和_______ 、_______ (填化学式)。
(2)“提纯”步骤中所有可能的反应的离子方程式为_______ 、__________ 。
(3)加入乙醇的目的是_______ 。
(4)“氧化”步骤中主要反应的化学方程式为_______ 。
(5)按照以上流程回收处理1 kg铁泥(含Fe元素的质量分数为56%),得到890 g纯度为95%的产品,Fe元素的回收率为_______ 。
(6)镍铁电池放电时也可产生FeO(OH),其工作原理如图所示。 放电生成FeO(OH)2后,继续放电时,电极上的FeO(OH)2可转化为FeO(OH),写出该过程的电极反应式
放电生成FeO(OH)2后,继续放电时,电极上的FeO(OH)2可转化为FeO(OH),写出该过程的电极反应式_______ 。
 、
、 、SiO2)为原料制备FeO(OH)的流程如图所示。
、SiO2)为原料制备FeO(OH)的流程如图所示。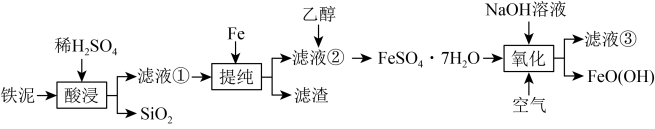
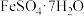 溶于水,不溶于乙醇。回答下列问题:
溶于水,不溶于乙醇。回答下列问题:(1)滤液①的溶质为H2SO4和
(2)“提纯”步骤中所有可能的反应的离子方程式为
(3)加入乙醇的目的是
(4)“氧化”步骤中主要反应的化学方程式为
(5)按照以上流程回收处理1 kg铁泥(含Fe元素的质量分数为56%),得到890 g纯度为95%的产品,Fe元素的回收率为
(6)镍铁电池放电时也可产生FeO(OH),其工作原理如图所示。
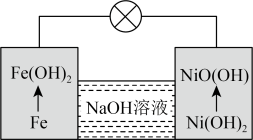
 放电生成FeO(OH)2后,继续放电时,电极上的FeO(OH)2可转化为FeO(OH),写出该过程的电极反应式
放电生成FeO(OH)2后,继续放电时,电极上的FeO(OH)2可转化为FeO(OH),写出该过程的电极反应式
您最近半年使用:0次
解题方法
4 . 某电镀厂产生的废水经预处理后含有 和少量的Cu2+、Ni2+,能够采用以下流程进行逐一分离,实现资源再利用。
和少量的Cu2+、Ni2+,能够采用以下流程进行逐一分离,实现资源再利用。
①常温下,物质的Ksp数据:
②Cr(OH)3性质与Al(OH)3相似。
③设H2S平衡浓度为1.0×10-6mol/L,已知H2S的K1=1.0×10-7,K2=7.0×10-15。
回答下列问题:
(1)还原池中溶液调pH___________ (填“能”或“否")使用盐酸。
(2)还原池中有Cr3+和CO2气体生成,反应的离子方程式为___________ 。
(3)沉淀池1中溶液的pH应为___________ 时才能使c(Cr3+)降至10-5mol/L,若溶液pH过高将会导致___________ 沉铬率下降。
(4)沉淀池2中加入的Na2S溶液呈碱性,原因是___________ (用主要反应的离子方程式表示),根据溶度积常数可确定沉淀2为___________ 。
(5)沉淀池3中沉淀结束,pH=7时,溶液中主要离子是___________ 。
 和少量的Cu2+、Ni2+,能够采用以下流程进行逐一分离,实现资源再利用。
和少量的Cu2+、Ni2+,能够采用以下流程进行逐一分离,实现资源再利用。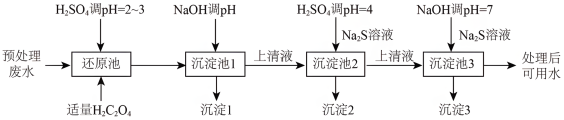
①常温下,物质的Ksp数据:
| 物质 | Cr(OH)3 | CuS | NiS |
| Ksp | 1×10-32 | 6.3×10-36 | 3.0×10-19 |
③设H2S平衡浓度为1.0×10-6mol/L,已知H2S的K1=1.0×10-7,K2=7.0×10-15。
回答下列问题:
(1)还原池中溶液调pH
(2)还原池中有Cr3+和CO2气体生成,反应的离子方程式为
(3)沉淀池1中溶液的pH应为
(4)沉淀池2中加入的Na2S溶液呈碱性,原因是
(5)沉淀池3中沉淀结束,pH=7时,溶液中主要离子是
您最近半年使用:0次
解题方法
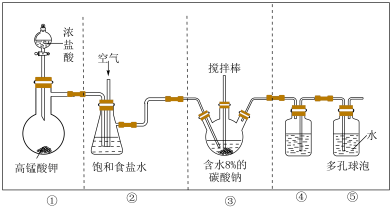
5 . 次氯酸作为消毒剂,被广泛应用于物体表面、织物等污染物品的消毒。某小组涉及如下装置(部分夹持装置略)制备 。
。 混合通入潮湿的碳酸钠中能生成
混合通入潮湿的碳酸钠中能生成 ,且反应放热;
,且反应放热;
ⅱ. 浓度过高时易爆炸,不含
浓度过高时易爆炸,不含 的
的 易与水反应生成
易与水反应生成 ;
;
ⅲ. 在
在 以上会分解。
以上会分解。
请回答下列问题:
(1)写出装置①中发生反应的化学方程式:_____ 。
(2)试从平衡角度分析装置②中试剂选择饱和食盐水的原因:_____ ;饱和食盐水也可替换为_____ 。
(3)制备 的一种产物为
的一种产物为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_____ 。
(4)装置④的作用是_____ ;装置⑤中多孔球泡的作用是_____ 。
(5)实验小组成员发现该套制备装置的设计存在一定问题并制订了修正方案:
a.将装置④的导管改为左长右短;b._____ 。
 。
。
 混合通入潮湿的碳酸钠中能生成
混合通入潮湿的碳酸钠中能生成 ,且反应放热;
,且反应放热;ⅱ.
 浓度过高时易爆炸,不含
浓度过高时易爆炸,不含 的
的 易与水反应生成
易与水反应生成 ;
;ⅲ.
 在
在 以上会分解。
以上会分解。请回答下列问题:
(1)写出装置①中发生反应的化学方程式:
(2)试从平衡角度分析装置②中试剂选择饱和食盐水的原因:
(3)制备
 的一种产物为
的一种产物为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(4)装置④的作用是
(5)实验小组成员发现该套制备装置的设计存在一定问题并制订了修正方案:
a.将装置④的导管改为左长右短;b.
您最近半年使用:0次
解题方法
6 . 一种处理废旧电池正极材料(主要成分为 ),制备三元锂电池正极材料
),制备三元锂电池正极材料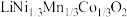 的工业流程如下:
的工业流程如下:
② 时相关物质的溶度积数据如下表。
时相关物质的溶度积数据如下表。
回答下列问题:
(1)基态 价层电子排布图是
价层电子排布图是_____ 。
(2)“酸浸”中 发生反应的化学方程式为
发生反应的化学方程式为_____ ;“酸浸”中 消耗量较大程度地超过理论用量,其原因可能是
消耗量较大程度地超过理论用量,其原因可能是_____ 。
(3)假设正极材料酸浸后溶液中金属阳离子浓度均为 ,则“调
,则“调 ”过程中
”过程中 调控的范围是
调控的范围是_____ (溶液中某离子浓度小于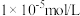 时,视为该离子沉淀完全)。
时,视为该离子沉淀完全)。
(4)“沉锂”过程发生反应的离子方程式为_____ 。
(5)产品的粒径和结晶度直接关系着三元电极的性能。为防止反应中产生的 和
和 影响晶体生长,需在“焙烧”前进行
影响晶体生长,需在“焙烧”前进行_____ (填“预烧”、“酸洗”或“搅拌”)。
(6)某三元锂电池以有机聚合物为电解质,电池放电时总反应方程式为: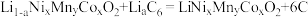 (石墨)
(石墨)
放电时工作装置简图如下,写出放电时A电极的电极反应式_____ 。
 ),制备三元锂电池正极材料
),制备三元锂电池正极材料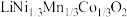 的工业流程如下:
的工业流程如下: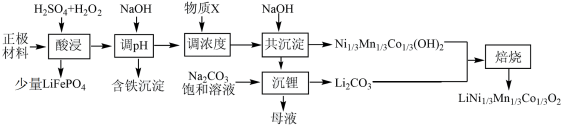

②
 时相关物质的溶度积数据如下表。
时相关物质的溶度积数据如下表。| 物质 |  |  |  |  |
 | 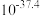 | 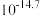 | 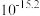 |  |
(1)基态
 价层电子排布图是
价层电子排布图是(2)“酸浸”中
 发生反应的化学方程式为
发生反应的化学方程式为 消耗量较大程度地超过理论用量,其原因可能是
消耗量较大程度地超过理论用量,其原因可能是(3)假设正极材料酸浸后溶液中金属阳离子浓度均为
 ,则“调
,则“调 ”过程中
”过程中 调控的范围是
调控的范围是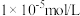 时,视为该离子沉淀完全)。
时,视为该离子沉淀完全)。(4)“沉锂”过程发生反应的离子方程式为
(5)产品的粒径和结晶度直接关系着三元电极的性能。为防止反应中产生的
 和
和 影响晶体生长,需在“焙烧”前进行
影响晶体生长,需在“焙烧”前进行(6)某三元锂电池以有机聚合物为电解质,电池放电时总反应方程式为:
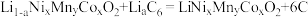 (石墨)
(石墨)放电时工作装置简图如下,写出放电时A电极的电极反应式

您最近半年使用:0次
2024-04-29更新
|
54次组卷
|
2卷引用:湖北省黄冈市2023-2024学年高二上学期期末调研考试化学试题
解题方法
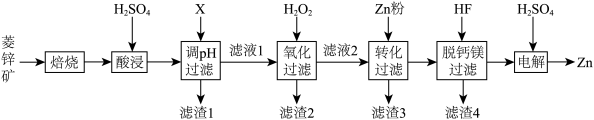
7 . 以菱锌矿(主要含有ZnCO3,另含有少量CaO、Fe2O3、FeO、CoO、CuO、SiO2等)为原料电解制Zn的流程如图:
(1)“酸浸”时为提高锌的浸出率,可采取的措施有___________ (写出一种即可)。
(2)“调pH过滤”中,物质X最适宜选择___________ (填标号)。
A.NaOH B.Ca(OH)2 C.NH3·H2O
(3)“氧化过滤”中,Fe2+转化为Fe(OH)3沉淀的离子方程式为___________ 。若反应结束时,溶液pH为5,则残留的c(Fe3+)=___________ mol·L-l。
(4)H2O2是常见绿色氧化剂,原因是___________ 。
(5)“脱钙镁过滤”后,溶液中 =
=___________ 。
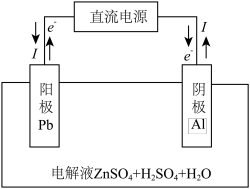
(6)“电解”装置示意如图,开始通电后,阳极表面生成PbO2,保护阳极不被酸性电解液腐蚀,相应的电极反应式为___________ 。
| 物质 | Fe(OH)3 | Zn(OH)2 | MgF2 | CaF2 |
| Ksp | 2.7×10-39 | 1.3×10-17 | 5.2×10-11 | 3.9×10-9 |
(1)“酸浸”时为提高锌的浸出率,可采取的措施有
(2)“调pH过滤”中,物质X最适宜选择
A.NaOH B.Ca(OH)2 C.NH3·H2O
(3)“氧化过滤”中,Fe2+转化为Fe(OH)3沉淀的离子方程式为
(4)H2O2是常见绿色氧化剂,原因是
(5)“脱钙镁过滤”后,溶液中
 =
=(6)“电解”装置示意如图,开始通电后,阳极表面生成PbO2,保护阳极不被酸性电解液腐蚀,相应的电极反应式为
您最近半年使用:0次
解题方法
8 . 高压氢还原法可直接从溶液中提取金属粉。以硫化铜(CuS)精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如下: 如下表所示:
如下表所示:
请回答下列问题:
(1)“浸取”时能提高反应速率的措施有_____ (答一条即可)。
(2)“浸取”时增大 压强可促进
压强可促进 的浸出,从沉淀溶解平衡角度进行解释:
的浸出,从沉淀溶解平衡角度进行解释:_____ 。
(3)固体 的主要成分是
的主要成分是 和
和_____ (填化学式)。
(4)利用上述表格数据,计算 的
的
_____ 。
(5)“中和调 ”应控制的
”应控制的 范围是
范围是_____ 。
(6)“还原”中发生反应的离子方程式为_____ 。
(7)金属 为
为_____ 。

 如下表所示:
如下表所示:| 物质 |  |  |  |
开始沉淀 的 的 | 2.2 | 5.2 | 6.7 |
沉淀完全 的 的 | 3.2 | 6.7 | 8.2 |
(1)“浸取”时能提高反应速率的措施有
(2)“浸取”时增大
 压强可促进
压强可促进 的浸出,从沉淀溶解平衡角度进行解释:
的浸出,从沉淀溶解平衡角度进行解释:(3)固体
 的主要成分是
的主要成分是 和
和(4)利用上述表格数据,计算
 的
的
(5)“中和调
 ”应控制的
”应控制的 范围是
范围是(6)“还原”中发生反应的离子方程式为
(7)金属
 为
为
您最近半年使用:0次
解题方法
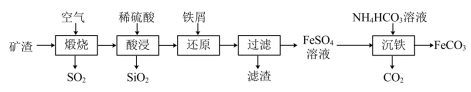
9 . 利用金属矿渣(含有FeS2、SiO2及Cu2O)制备FeCO3的实验流程如下。已知煅烧过程中FeS2和Cu2O转化为Fe2O3和CuO。 的反应外,还发生反应的
的反应外,还发生反应的离子方程式 有___________ 、___________ 。
(2)检验Fe3+是否完全被还原的实验操作是___________ 。
(3)FeSO4溶液浓度的测定。取制得的FeSO4溶液25.00mL,置于锥形瓶中,加入一定量的酸溶液,用0.1000mol/L的KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液19.50mL。计算FeSO4溶液的物质的是浓度___________ 。(写出计算过程)
(4)制备 FeCO3.写出“沉铁”步骤发生反应的离子方程式 :___________ 。
 的反应外,还发生反应的
的反应外,还发生反应的(2)检验Fe3+是否完全被还原的实验操作是
(3)FeSO4溶液浓度的测定。取制得的FeSO4溶液25.00mL,置于锥形瓶中,加入一定量的酸溶液,用0.1000mol/L的KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液19.50mL。计算FeSO4溶液的物质的是浓度
(4)制备 FeCO3.写出“沉铁”步骤发生反应的
您最近半年使用:0次
解题方法
10 . 金属钛( )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
(1) 元素在周期表中的分区是位于
元素在周期表中的分区是位于___________ 区。基态 原子中含有的未成对电子数是
原子中含有的未成对电子数是___________ 。
(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为 和
和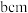 ,结构如下图所示。
,结构如下图所示。___________ , 位于距离最近的
位于距离最近的 构成的
构成的___________ 中心(填字母序号,下同)。
a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为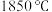 ,其晶体类型
,其晶体类型最不可 能是___________ 。
a.共价晶体 b.离子晶体 c.分子晶体
③若已知 该氧化物晶体体积为
该氧化物晶体体积为 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为___________  。
。
(3)以钓铁矿 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下: 元素在元素周期表中的位置是
元素在元素周期表中的位置是___________ 。
②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:___________ 。
③结合流程及下表数据,“分离”时所需控制的最低温度应为___________  。
。
④已知 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:___________ 。
 )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。(1)
 元素在周期表中的分区是位于
元素在周期表中的分区是位于 原子中含有的未成对电子数是
原子中含有的未成对电子数是(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为
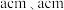 和
和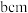 ,结构如下图所示。
,结构如下图所示。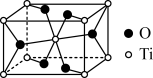
 位于距离最近的
位于距离最近的 构成的
构成的a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为
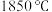 ,其晶体类型
,其晶体类型a.共价晶体 b.离子晶体 c.分子晶体
③若已知
 该氧化物晶体体积为
该氧化物晶体体积为 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为 。
。(3)以钓铁矿
 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下:
 元素在元素周期表中的位置是
元素在元素周期表中的位置是②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:
③结合流程及下表数据,“分离”时所需控制的最低温度应为
 。
。 |  |  | |
熔点/ | 1668 | 651 | 714 |
沸点/ | 3287 | 1107 | 1412 |
 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:
您最近半年使用:0次



