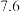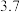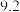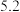解题方法
1 . 三氧化二镍( )是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(
)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍( ),再高温煅烧草酸镍制取
),再高温煅烧草酸镍制取 。工艺流程图如下所示:
。工艺流程图如下所示:

已知:i.草酸的钙、镁、镍盐以及 、
、 均难溶于水。
均难溶于水。
ii.溶液中金属阳离子的氢氧化物开始沉淀和沉淀完全的 (20℃)如下表:
(20℃)如下表:
请回答下列问题:
(1) 中
中 的化合价为
的化合价为______ ;进行操作b时的温度为______ 。
(2) 、
、 ,
, 三者的氧化性由弱到强是顺序为
三者的氧化性由弱到强是顺序为______ 。滤渣B中的主要物质是______ 。
(3)滤液B加入 的离子方程式为
的离子方程式为______ 。
(4)草酸镍( )在热空气中干燥脱水后,再高温下煅烧,可制得
)在热空气中干燥脱水后,再高温下煅烧,可制得 ,同时获得混合气体。
,同时获得混合气体。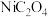 热分解的化学方程式为
热分解的化学方程式为______ 。
(5)若镍废料中镍含量为50.0%,用该方法处理1.00t镍废料得到0.415t (假设不含杂质),则产率为
(假设不含杂质),则产率为______ (保留3位有效数字)。
 )是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(
)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍( ),再高温煅烧草酸镍制取
),再高温煅烧草酸镍制取 。工艺流程图如下所示:
。工艺流程图如下所示:
已知:i.草酸的钙、镁、镍盐以及
 、
、 均难溶于水。
均难溶于水。ii.溶液中金属阳离子的氢氧化物开始沉淀和沉淀完全的
 (20℃)如下表:
(20℃)如下表:金属离子 |
|
|
|
|
|
开始沉淀时( | 7.7 | 7.5 | 2.2 | 12.3 | 9.6 |
完全时( | 9.2 | 9.0 | 3.2 | 微溶 | 11.1 |
(1)
 中
中 的化合价为
的化合价为(2)
 、
、 ,
, 三者的氧化性由弱到强是顺序为
三者的氧化性由弱到强是顺序为(3)滤液B加入
 的离子方程式为
的离子方程式为(4)草酸镍(
 )在热空气中干燥脱水后,再高温下煅烧,可制得
)在热空气中干燥脱水后,再高温下煅烧,可制得 ,同时获得混合气体。
,同时获得混合气体。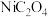 热分解的化学方程式为
热分解的化学方程式为(5)若镍废料中镍含量为50.0%,用该方法处理1.00t镍废料得到0.415t
 (假设不含杂质),则产率为
(假设不含杂质),则产率为
您最近一年使用:0次
名校
解题方法
2 . 利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥Cr(Ⅲ)的处理工艺流程如图:
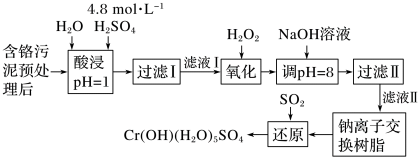
已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有_______ 、_______ 。(答出两点)
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O ,则此反应中氧化剂和还原剂物质的量之比为
,则此反应中氧化剂和还原剂物质的量之比为_______ 。
(3)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O 转化为CrO
转化为CrO ,写出上述流程中用SO2进行还原时发生反应的离子方程式:
,写出上述流程中用SO2进行还原时发生反应的离子方程式:_______ 。

已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O
 ,则此反应中氧化剂和还原剂物质的量之比为
,则此反应中氧化剂和还原剂物质的量之比为(3)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O
 转化为CrO
转化为CrO ,写出上述流程中用SO2进行还原时发生反应的离子方程式:
,写出上述流程中用SO2进行还原时发生反应的离子方程式:
您最近一年使用:0次
解题方法
3 . CoC2O4是制备氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、CaO、MgO碳及有机物等)制取CoC2O4的工艺流程如下:
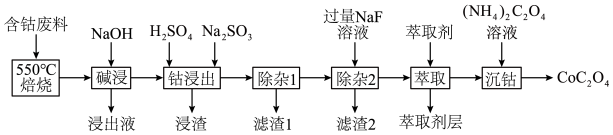
(1)为了加快“碱浸”速率,可采用的方法有________ (写一种即可)。“浸出液”的主要成分是_______ (填化学式)。
(2)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为___________ 。
(3)“除杂1”过程中,在40~50℃加入H2O2,写出加入H2O2反应的主要离子方程式为_______________ 。
(4)“除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×10-5mol/L,则滤液中c(Mg2+)为______ [已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2) =1.05×10-10]。
(5)萃取剂对金属离子的萃取率与pH的关系如图所示,经过萃取可除去Mn2+,需控制溶液的pH范围是__________ (填字母)。
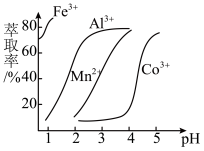
A.1.0~2.0 B.2.0~3.0 C.3.0~3.5

(1)为了加快“碱浸”速率,可采用的方法有
(2)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为
(3)“除杂1”过程中,在40~50℃加入H2O2,写出加入H2O2反应的主要离子方程式为
(4)“除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×10-5mol/L,则滤液中c(Mg2+)为
(5)萃取剂对金属离子的萃取率与pH的关系如图所示,经过萃取可除去Mn2+,需控制溶液的pH范围是

A.1.0~2.0 B.2.0~3.0 C.3.0~3.5
您最近一年使用:0次
名校
解题方法
4 .  在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。
(1)在 下,向
下,向 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液
溶液,使溶液 控制在4~4.5之间。一段时间后,过滤、洗涤得
控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。
①制备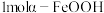 理论上需要
理论上需要 的物质的量为
的物质的量为___________  ;实际生产过程中所加
;实际生产过程中所加 低于理论用量的原因是
低于理论用量的原因是___________ 。
②为检验 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是___________ 。
(2) 的结构中,每个
的结构中,每个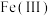 与羟基氧和非羟基氧构成了
与羟基氧和非羟基氧构成了 八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构
八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构___________ 。 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 (结构如图2所示)覆盖在
(结构如图2所示)覆盖在 的表面。
的表面。___________ 。
②工业可使用四氯乙烯 溶解
溶解 并实现与
并实现与 分离。四氯乙烯能溶解
分离。四氯乙烯能溶解 的原因是
的原因是___________ 。
③部分环状分子(如苯)中由于存在大 键,增强了分子的稳定性。
键,增强了分子的稳定性。 分子中不能形成大
分子中不能形成大 键的原因是
键的原因是___________ 。
 在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。(1)在
 下,向
下,向 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液
溶液,使溶液 控制在4~4.5之间。一段时间后,过滤、洗涤得
控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。①制备
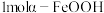 理论上需要
理论上需要 的物质的量为
的物质的量为 ;实际生产过程中所加
;实际生产过程中所加 低于理论用量的原因是
低于理论用量的原因是②为检验
 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是(2)
 的结构中,每个
的结构中,每个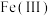 与羟基氧和非羟基氧构成了
与羟基氧和非羟基氧构成了 八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构
八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构
 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 (结构如图2所示)覆盖在
(结构如图2所示)覆盖在 的表面。
的表面。
②工业可使用四氯乙烯
 溶解
溶解 并实现与
并实现与 分离。四氯乙烯能溶解
分离。四氯乙烯能溶解 的原因是
的原因是③部分环状分子(如苯)中由于存在大
 键,增强了分子的稳定性。
键,增强了分子的稳定性。 分子中不能形成大
分子中不能形成大 键的原因是
键的原因是
您最近一年使用:0次
2024-02-13更新
|
692次组卷
|
4卷引用:江苏省南菁高中、常州市第一中学2023-2024学年高二下学期3月月考化学试题
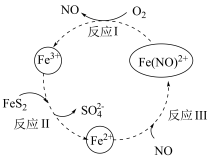
5 . 黄铁矿(主要成分为FeS2)的利用对资源和环境具有重要意义,一种酸性条件下催化氧化黄铁矿的物质转化关系如图所示,回答下列问题:
(1)基态氮原子的价层电子排布式为____________ 。
(2)基态氧原子的核外电子有________ 种空间运动状态,其电子占据的最高能级的电子云轮廓图为____ 形。
(3)第一电离能:N________ (填“>”“<”或“=”)O。
(4)反应Ⅱ的离子方程式为____________________ ,Fe3+的半径比Fe2+________ (填“大”或“小”),Fe3+的稳定性比Fe2+更________ (填“强”或“弱”)。

(1)基态氮原子的价层电子排布式为
(2)基态氧原子的核外电子有
(3)第一电离能:N
(4)反应Ⅱ的离子方程式为
您最近一年使用:0次
名校
6 . I.人类活动中的碳排放无可避免。
(1)配平下列反应,并标出电子转移的方向和数目。___________
___________CH4+___________NO2 ___________NO+___________CO2+___________H2O
___________NO+___________CO2+___________H2O
(2)有一种处理废水中的HCOOH的微型原电池。电池含有Fe-C,使用时通入空气,便可以在___________ 生成H2O2。
A.阴极 B.负极 C.阳极 D.正极
写出H2O2与HCOOH反应生成CO2的化学方程式:___________ 。
Ⅱ.一种富集CO2的原电池模拟装置如下图。
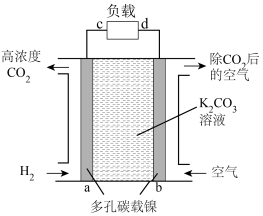
(3)b极为___________ 极(填“正”或“负”),a电极上发生的电极反应为___________ 。
(4)上述电极材料采用多孔碳载镍,“多孔”的优点是___________ 。
(5)该装置若消耗2 mol H2,则理论上在b极除去CO2的体积约为___________ L(标准状况下)。
(1)配平下列反应,并标出电子转移的方向和数目。
___________CH4+___________NO2
 ___________NO+___________CO2+___________H2O
___________NO+___________CO2+___________H2O(2)有一种处理废水中的HCOOH的微型原电池。电池含有Fe-C,使用时通入空气,便可以在
A.阴极 B.负极 C.阳极 D.正极
写出H2O2与HCOOH反应生成CO2的化学方程式:
Ⅱ.一种富集CO2的原电池模拟装置如下图。

(3)b极为
(4)上述电极材料采用多孔碳载镍,“多孔”的优点是
(5)该装置若消耗2 mol H2,则理论上在b极除去CO2的体积约为
您最近一年使用:0次
名校
7 . 氨气是重要的化工原料,氨水、硝酸盐、铵盐等均可作化肥产品。
(1)在VL浓度为 的氨水中滴加等体积
的氨水中滴加等体积 的盐酸,使pH=7,则产物中一水合氨浓度为
的盐酸,使pH=7,则产物中一水合氨浓度为___________  。
。
(2)在自然界的氮循环过程中,硝化细菌将土壤中的 转化为
转化为 后,土壤中的O2进一步将
后,土壤中的O2进一步将 氧化为
氧化为 ,在氧气较少的环境下,
,在氧气较少的环境下, 又可以在反硝化细菌的作用下与
又可以在反硝化细菌的作用下与 反应,使氮以N2形式放出。氧气与
反应,使氮以N2形式放出。氧气与 反应时,反应物
反应时,反应物 与O2的物质的量之比为
与O2的物质的量之比为___________ ,写出 与
与 作用生成N2的离子方程式
作用生成N2的离子方程式___________ 。
(1)在VL浓度为
 的氨水中滴加等体积
的氨水中滴加等体积 的盐酸,使pH=7,则产物中一水合氨浓度为
的盐酸,使pH=7,则产物中一水合氨浓度为 。
。(2)在自然界的氮循环过程中,硝化细菌将土壤中的
 转化为
转化为 后,土壤中的O2进一步将
后,土壤中的O2进一步将 氧化为
氧化为 ,在氧气较少的环境下,
,在氧气较少的环境下, 又可以在反硝化细菌的作用下与
又可以在反硝化细菌的作用下与 反应,使氮以N2形式放出。氧气与
反应,使氮以N2形式放出。氧气与 反应时,反应物
反应时,反应物 与O2的物质的量之比为
与O2的物质的量之比为 与
与 作用生成N2的离子方程式
作用生成N2的离子方程式
您最近一年使用:0次
解题方法
8 . 碱式碳酸铜可用作有机催化剂。工业上以辉铜矿(主要成分为 ,含
,含 及少量
及少量 )为原料制备碱式碳酸铜,工业流程如下:
)为原料制备碱式碳酸铜,工业流程如下:
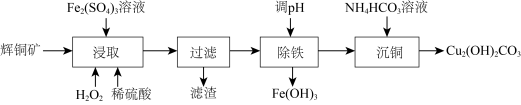
(1)滤渣可能含S、___________ (填化学式)。
(2)①“浸取”时能提高辉铜矿Cu浸取率的措施有___________ (填2条)。
②某小组测得Cu浸取率随 浓度及温度影响的变化曲线如下:
浓度及温度影响的变化曲线如下:

a.由图一可知 适宜的浓度范围为
适宜的浓度范围为___________ ;由图一中的a点分析,浸取时 也起到了氧化辉铜矿的作用,该反应的离子方程式为
也起到了氧化辉铜矿的作用,该反应的离子方程式为___________ 。
b.图二中高于85℃时Cu浸取率下降的原因是___________ 。
(3)“除铁”步骤调pH可加入试剂___________ (填选项字母);
a.氨气 b. c.
c. d.
d.
(4)常温下,“过滤”后的滤液中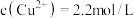 ,则“除铁”步骤调pH应小于
,则“除铁”步骤调pH应小于___________ 。[常温下, ]。
]。
 ,含
,含 及少量
及少量 )为原料制备碱式碳酸铜,工业流程如下:
)为原料制备碱式碳酸铜,工业流程如下:
(1)滤渣可能含S、
(2)①“浸取”时能提高辉铜矿Cu浸取率的措施有
②某小组测得Cu浸取率随
 浓度及温度影响的变化曲线如下:
浓度及温度影响的变化曲线如下:
a.由图一可知
 适宜的浓度范围为
适宜的浓度范围为 也起到了氧化辉铜矿的作用,该反应的离子方程式为
也起到了氧化辉铜矿的作用,该反应的离子方程式为b.图二中高于85℃时Cu浸取率下降的原因是
(3)“除铁”步骤调pH可加入试剂
a.氨气 b.
 c.
c. d.
d.
(4)常温下,“过滤”后的滤液中
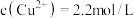 ,则“除铁”步骤调pH应小于
,则“除铁”步骤调pH应小于 ]。
]。
您最近一年使用:0次
解题方法
9 . 草酸钴可用于指示剂和催化剂的制备。用含钴废料(主要成分为 ,含有一定量的
,含有一定量的 、
、 、
、 、
、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的流程如下:
)的流程如下:
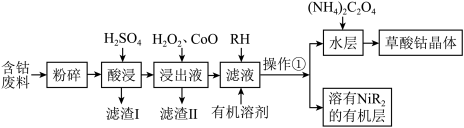
已知:①草酸钴晶体难溶于水。
②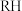 为有机物(难电离)、
为有机物(难电离)、 代表金属离子,
代表金属离子, 。
。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的 见下表:
见下表:
④滤液中 元素以
元素以 形式存在。
形式存在。
回答下列问题:
(1) 是常用的氧化剂,
是常用的氧化剂, 的电子式为
的电子式为______ 。
(2)“浸出液”中加入 后发生反应的离子方程式为
后发生反应的离子方程式为______ 。
(3)加入氧化钴调节溶液的 ,调节的
,调节的 范围是
范围是______ ,滤渣Ⅱ的主要成分是______ 。
(4)操作①在实验室所用的仪器为____________ 。
(5)可向操作①后溶有 的有机层中加入
的有机层中加入______ (反萃取剂)使 从有机相返回水相,实现金属回收利用。
从有机相返回水相,实现金属回收利用。
(6)若先将 转化为
转化为 ,再利用反应
,再利用反应 ,却不能实现
,却不能实现 转化为
转化为 ,请说明理由:
,请说明理由:____________ 。[ ,
, ]
]
 ,含有一定量的
,含有一定量的 、
、 、
、 、
、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的流程如下:
)的流程如下:
已知:①草酸钴晶体难溶于水。
②
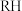 为有机物(难电离)、
为有机物(难电离)、 代表金属离子,
代表金属离子, 。
。③流程中部分阳离子以氢氧化物形式沉淀时溶液的
 见下表:
见下表:沉淀物 |
|
|
|
|
|
开始沉淀 |
|
|
|
|
|
完全沉淀 |
|
|
|
|
|
 元素以
元素以 形式存在。
形式存在。回答下列问题:
(1)
 是常用的氧化剂,
是常用的氧化剂, 的电子式为
的电子式为(2)“浸出液”中加入
 后发生反应的离子方程式为
后发生反应的离子方程式为(3)加入氧化钴调节溶液的
 ,调节的
,调节的 范围是
范围是(4)操作①在实验室所用的仪器为
(5)可向操作①后溶有
 的有机层中加入
的有机层中加入 从有机相返回水相,实现金属回收利用。
从有机相返回水相,实现金属回收利用。(6)若先将
 转化为
转化为 ,再利用反应
,再利用反应 ,却不能实现
,却不能实现 转化为
转化为 ,请说明理由:
,请说明理由: ,
, ]
]
您最近一年使用:0次
10 . 磷及其化合物在生产、生活中具有广泛的用途,回答下列问题:
(1)白磷(结构如图所示)在潮湿的空气中发生缓慢氧化,在40℃左右即可自燃。

①白磷( )的相对分子质量为
)的相对分子质量为___________ 。
②基态P原子中成对电子数与未成对电子数之比为___________ 。
③基态P原子中能量最高的电子所占据原子轨道的电子云轮廓图为___________ 形。
(2)磷及其部分重要化合物的相互转化如图所示。

①基态钙原子的简化电子排布式为___________ 。
②第一电离能:Si___________ (填“>”“<”或“=”)C。
③ 和
和 的组成元素相同,但二者的性质不完全相同,其原因为
的组成元素相同,但二者的性质不完全相同,其原因为___________ 。
④常温下, 与少量
与少量 溶液反应的化学方程式为
溶液反应的化学方程式为___________ 。
(3)反应Ⅲ的离子方程式为___________ (已知: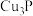 不溶于水)。
不溶于水)。
(1)白磷(结构如图所示)在潮湿的空气中发生缓慢氧化,在40℃左右即可自燃。

①白磷(
 )的相对分子质量为
)的相对分子质量为②基态P原子中成对电子数与未成对电子数之比为
③基态P原子中能量最高的电子所占据原子轨道的电子云轮廓图为
(2)磷及其部分重要化合物的相互转化如图所示。

①基态钙原子的简化电子排布式为
②第一电离能:Si
③
 和
和 的组成元素相同,但二者的性质不完全相同,其原因为
的组成元素相同,但二者的性质不完全相同,其原因为④常温下,
 与少量
与少量 溶液反应的化学方程式为
溶液反应的化学方程式为(3)反应Ⅲ的离子方程式为
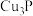 不溶于水)。
不溶于水)。
您最近一年使用:0次




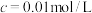 )的
)的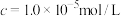 )的
)的