23-24高三上·辽宁大连·期中
1 . 氮氧化物(NOx)会对生态系统和人体健康造成危害。一种以沸石笼作为载体对NOₓ进行催化还原的原理如图所示。下列说法错误的是
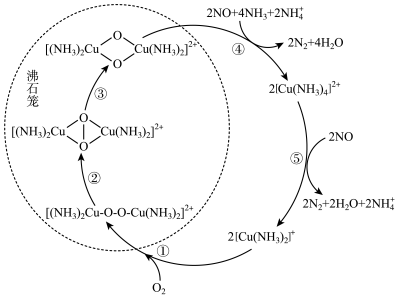
| A.反应①每消耗lmolO2, 转移 2mol电子 |
| B.反应⑤中[Cu(NH3)4]2+作还原剂 |
| C.反应④有σ键和π键的形成 |
D.脱除NO 的总反应可表示为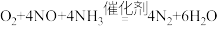 |
您最近一年使用:0次
2023-10-19更新
|
290次组卷
|
4卷引用:热点03 共价键
23-24高二上·全国·课时练习
解题方法
2 . 将氧化铁还原为铁的技术在人类文明的进步中占有十分重要的地位。炼铁高炉中发生的关键反应如下:
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
CO2(g)+C(s)=2CO(g) ΔH=+172.46 kJ/mol
Fe2O3+CO→Fe+CO2
若已知:2Fe(s)+ O2(g)=Fe2O3(s) ΔH=-824.21 kJ/mol
O2(g)=Fe2O3(s) ΔH=-824.21 kJ/mol
根据上面三个热化学方程式,回答下列问题:
(1)CO的摩尔燃烧焓为_______ ;写出其热化学方程式:_______ 。
(2)高炉内Fe2O3被CO还原为Fe的热化学方程式为_______ 。
(3)炼制1吨含铁96%的生铁所需焦炭的理论用量是_______ 吨,实际生产中所需焦炭远高于理论用量,其原因是_______ 。
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
CO2(g)+C(s)=2CO(g) ΔH=+172.46 kJ/mol
Fe2O3+CO→Fe+CO2
若已知:2Fe(s)+
 O2(g)=Fe2O3(s) ΔH=-824.21 kJ/mol
O2(g)=Fe2O3(s) ΔH=-824.21 kJ/mol根据上面三个热化学方程式,回答下列问题:
(1)CO的摩尔燃烧焓为
(2)高炉内Fe2O3被CO还原为Fe的热化学方程式为
(3)炼制1吨含铁96%的生铁所需焦炭的理论用量是
您最近一年使用:0次
名校
3 . KI淀粉溶液在酸性条件下能与氧气反应。现有以下实验记录:
回答下列问题:
(1)该反应的离子方程式为___________ 。
(2)该实验的目的是___________ 。
(3)实验试剂除了1 KI溶液、0.1
KI溶液、0.1 H2SO4溶液外,还需要的试剂是
H2SO4溶液外,还需要的试剂是___________ ,实验现象为___________ 。
(4)实验操作中除了需要上述条件外,还必须控制___________ (填字母)不变。
A.温度B.试剂的用量(体积)C.试剂添加的顺序
(5)由上述实验记录可得出的结论是___________ 。
(6)若要进行溶液酸性强弱对反应速率影响的探究实验,你会采取的实验方案是___________ 。
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度/℃ | 30 | 40 | 50 | 60 | 70 |
| 显色时间/s | 160 | 80 | 40 | 20 | 10 |
(1)该反应的离子方程式为
(2)该实验的目的是
(3)实验试剂除了1
 KI溶液、0.1
KI溶液、0.1 H2SO4溶液外,还需要的试剂是
H2SO4溶液外,还需要的试剂是(4)实验操作中除了需要上述条件外,还必须控制
A.温度B.试剂的用量(体积)C.试剂添加的顺序
(5)由上述实验记录可得出的结论是
(6)若要进行溶液酸性强弱对反应速率影响的探究实验,你会采取的实验方案是
您最近一年使用:0次
2021-10-19更新
|
147次组卷
|
21卷引用:2019年10月21日《每日一题》2019-2020学年高二化学人教选修4——化学反应速率的实验探究
2019年10月21日《每日一题》2019-2020学年高二化学人教选修4——化学反应速率的实验探究(已下线)2.3.3 化学反应速率综合分析-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修1)(已下线)2013-2014学年广东省执信中学高二上学期期中考试理科化学试卷2015-2016学年安徽师大附中高二下期中化学试卷江西省赣县三中2018-2019学年高二上学期9月月考化学试题【校级联考】安徽省定远重点中学2018-2019学年高二下学期开学考试化学试题广东省揭阳市惠来县第一中学2019-2020学年高二上学期第一次阶段考试化学试题山西省阳泉市2019-2020学年高二上学期期末考试化学试题(已下线)2.2+影响化学反应速率的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)陕西省汉中市五校2020-2021学年高二上学期第一次月考化学试题云南省新平县一中2020-2021学年高二下学期期中考试化学试题(已下线)考向21 化学反应速率及影响因素-备战2022年高考化学一轮复习考点微专题福建省福州格致中学2021-2022学年高二上学期第一阶段测试化学试题(10月)四川省凉山宁南中学2019-2020学年高二上学期第一次月考化学试题云南省丘北县第一中学2021-2022学年高二下学期3月份考试 化学试题云南省玉龙县第一中学2021-2022学年高二下学期3月份考试化学试题四川省广元市八二一中学2021-2022学年高二上学期期中考试化学试题云南省广南县二中2021-2022年学年高二下学期开学考试化学试题云南省楚雄第一中学2022-2023学年高二下学期期末考试化学试题安徽省滁州市定远县第三中学等2校2022-2023学年高二上学期12月月考化学试题(已下线)专题03 化学反应速率及影响因素、活化能【考题猜想】(9大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
21-22高二上·浙江·开学考试
4 . NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图1;研究发现在催化剂上可能发生的反应过程如图2。下列说法不正确的是
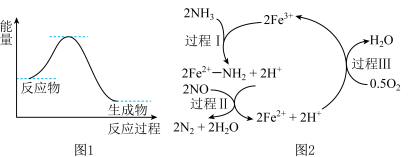

| A.NH3催化还原NO为放热反应 |
| B.过程I中NH3断裂极性键,需要吸收能量,Fe3+体现了氧化性 |
C.过程III的离子方程式: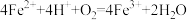 |
| D.反应过程中,反应物为NH3、O2、NO,Fe3+、Fe2+为中间产物 |
您最近一年使用:0次
2021-09-26更新
|
982次组卷
|
16卷引用:第二单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)
(已下线)第二单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)浙江省“精诚联盟”2021-2022学年高二上学期返校考试化学试题(已下线)必考点02 化学反应速率-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)浙江省金华市第六中学2022-2023学年高二上学期开学考试化学试题四川省成都市郫都区2021-2022学年高二上学期期中考试化学试题湖南省宁乡市四校联考2022-2023学年高二上学期10月月考化学试题四川省凉山州西昌市第二中学2021-2022学年高二上学期期末检测化学试题浙江省名校协作体2023-2024学年高二上学期开学适应性考试化学试题湖南省常德市第一中学2023-2024学年高二上学期入学考试化学试题上海市控江中学2023-2024学年高二上学期10月阶段测验化学试题江西省抚州市临川一中、临川一中实验学校2022届高三第一次月考化学试题吉林省长春市北师大附属学校2021-2022学年高三上学期第一次月考化学试题天津市红桥区2021-2022学年高三上学期期中考试化学试题山东省“学情空间”区域教研共同体2022-2023学年高三上学期10月检测化学试题湖北省襄阳市第三中学2021-2022学年高一下学期3月月考化学试题吉林省通化市梅河口市第五中学2022-2023学年高三上学期10月期中考试化学试题
20-21高二上·江西宜春·阶段练习
解题方法
5 . 某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。请回答以下问题:
表1几种盐的Ksp
表2工厂污染物排放浓度及允许排放标准
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=___________ mol·L-1。
(2)若酸性废水中Fe3+的浓度为1.0×10-4 mol·L-1,c(AsO )=
)=___________ mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为___________ 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为___________ 。
②砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3,K2=1.7×10-7,K3=4.0×10-12,第三步电离的平衡常数的表达式为K3=___________ 。Na3AsO4的第一步水解的离子方程式为:AsO +H2O
+H2O HAsO
HAsO +OH-,该步水解的平衡常数(25℃)为
+OH-,该步水解的平衡常数(25℃)为___________ (保留两位有效数字)。
表1几种盐的Ksp
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| CaSO4 | 9.1×10-6 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 废水浓度 | 29.4 g·L-1 | 1.6 g·L-1 |
| 排放标准 | pH 6~9 | 0.5 mg·L-1 |
(2)若酸性废水中Fe3+的浓度为1.0×10-4 mol·L-1,c(AsO
 )=
)=(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为
②砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3,K2=1.7×10-7,K3=4.0×10-12,第三步电离的平衡常数的表达式为K3=
 +H2O
+H2O HAsO
HAsO +OH-,该步水解的平衡常数(25℃)为
+OH-,该步水解的平衡常数(25℃)为
您最近一年使用:0次
21-22高三上·江苏南通·开学考试
6 . 烟气中SO2和NO的转化和综合利用既有利于节约资源,又有利于保护环境。
(1)采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,在一定浓度的NaClO2溶液中通入含有SO2和NO的烟气,反应温度为323K。
已知: 4H++ClO =4ClO2+Cl-+2H2O;ClO2氧化性大于NaClO2。
=4ClO2+Cl-+2H2O;ClO2氧化性大于NaClO2。
①写出NaClO2溶液将NO氧化为NO 的离子方程式:
的离子方程式:___________ 。
②已知脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________ 。
③当调节溶液初始pH由7升至12时,通入烟气后,NO转化率由100%降为51%,可能的原因是___________ 。
(2)有氧条件下,NO在催化剂作用下可被NH3还原为N2。在钒基催化剂(V2O5)作用下的脱硝反应机理如图1所示。
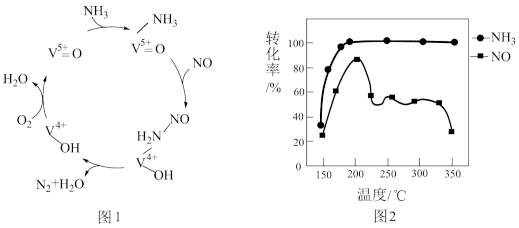
①根据图1机理,NO、NH3在有氧条件下的总化学方程式是___________ 。
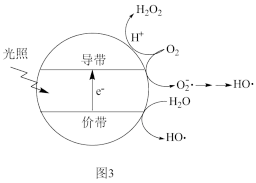
②按上述图1中NH3、NO和O2的比例进行催化脱硝反应。相同反应时间,NH3和NO的转化率与温度的关系如图2所示,200℃后,NO转化率急剧下降的原因是___________ 。
(3)羟基自由基(HO·)也可以用于脱硫脱硝。图3表示光催化氧化技术可生成HO·:光照时,价带失去电子产生有强氧化性的空穴,价带上生成HO·;描述产生HO·的另一种过程:___________ 。
(1)采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,在一定浓度的NaClO2溶液中通入含有SO2和NO的烟气,反应温度为323K。
已知: 4H++ClO
 =4ClO2+Cl-+2H2O;ClO2氧化性大于NaClO2。
=4ClO2+Cl-+2H2O;ClO2氧化性大于NaClO2。①写出NaClO2溶液将NO氧化为NO
 的离子方程式:
的离子方程式:②已知脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是
③当调节溶液初始pH由7升至12时,通入烟气后,NO转化率由100%降为51%,可能的原因是
(2)有氧条件下,NO在催化剂作用下可被NH3还原为N2。在钒基催化剂(V2O5)作用下的脱硝反应机理如图1所示。

①根据图1机理,NO、NH3在有氧条件下的总化学方程式是
②按上述图1中NH3、NO和O2的比例进行催化脱硝反应。相同反应时间,NH3和NO的转化率与温度的关系如图2所示,200℃后,NO转化率急剧下降的原因是
(3)羟基自由基(HO·)也可以用于脱硫脱硝。图3表示光催化氧化技术可生成HO·:光照时,价带失去电子产生有强氧化性的空穴,价带上生成HO·;描述产生HO·的另一种过程:

您最近一年使用:0次
2021-09-12更新
|
527次组卷
|
4卷引用:第12讲 化学反应的调控-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)
(已下线)第12讲 化学反应的调控-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)常见无机物的性质江苏省海安市2021-2022学年高三上学期期初学业质量监测化学试题江苏省宿迁青华中学2021-2022学年高三上学期9月月考化学试题
20-21高三上·黑龙江哈尔滨·期中
名校
7 . 一种以“火法粗炼”、“电解精练”相结合炼制精铜的工艺流程如图所示。已知:黄铜矿石的主要成分为CuFeS2;“冰铜”还原中的Cu2S先转化为Cu2O,然后Cu2O再与Cu2S反应生成粗铜。下列叙述正确的是


| A.“焙烧”过程中,CuFeS2既是氧化剂又是还原剂 |
| B.在Cu2S“还原”为Cu的总反应中,Cu2O作催化剂 |
| C.“电解”过程中阴极增重6.4g的同时,粗铜质量减少6.4g |
| D.该炼铜工艺零污染,对环境友好 |
您最近一年使用:0次
20-21高三上·安徽池州·阶段练习
名校
解题方法
8 . 将1.800gFeC2O4·2H2O固体样品放在热重分析仪中进行热重分析,测得其热重分析曲线(样品质量随温度变化的曲线)如图所示:

已知:①草酸盐受热分解易放出碳的氧化物。
②500℃之前,该热重分析仪的样品池处于氩气气氛中,500℃时起,样品池与大气相通。回答下列问题:
(1)300℃时是样品脱水的过程,试确定350℃时样品是否脱水完全___________ (填“是”或“否”)
(2)400℃时发生变化的化学方程式是___________ 。
(3)将600℃时样品池中残留的固体隔绝空气冷却至室温,再向该固体中加入一定量的稀盐酸刚好完全溶解,用pH试纸测得所得溶液的pH=3,其原因是___________ (用离子方程式回答)。向该溶液中滴加适量NaOH溶液,生成红褐色沉淀,测得此时溶液中铁元素的离子浓度为4.0×10-11mol·L-1,则此时溶液的pH=___________ (已知:Ksp[Fe(OH)2]=8.0×10-16,Ksp[Fe(OH)3]=4.0×10-38)。
(4)将1500℃时样品池中残留的固体隔绝空气冷却后,用稀盐酸溶解得到一棕黄色溶液。取少量该溶液滴加KSCN溶液,溶液显血红色;另取少量的该溶液滴加K3[Fe(CN)6](铁氰化钾)溶液,产生特征蓝色沉淀。写出残留固体与稀盐酸反应的化学方程式___________

已知:①草酸盐受热分解易放出碳的氧化物。
②500℃之前,该热重分析仪的样品池处于氩气气氛中,500℃时起,样品池与大气相通。回答下列问题:
(1)300℃时是样品脱水的过程,试确定350℃时样品是否脱水完全
(2)400℃时发生变化的化学方程式是
(3)将600℃时样品池中残留的固体隔绝空气冷却至室温,再向该固体中加入一定量的稀盐酸刚好完全溶解,用pH试纸测得所得溶液的pH=3,其原因是
(4)将1500℃时样品池中残留的固体隔绝空气冷却后,用稀盐酸溶解得到一棕黄色溶液。取少量该溶液滴加KSCN溶液,溶液显血红色;另取少量的该溶液滴加K3[Fe(CN)6](铁氰化钾)溶液,产生特征蓝色沉淀。写出残留固体与稀盐酸反应的化学方程式
您最近一年使用:0次
19-20高二上·四川成都·期末
解题方法
9 . 含铬(+6价)废水严重危害人体健康,工业上常用还原法进行处理。其部分工艺流程如下:

(1)废水中,六价铬以CrO42-;或者Cr2O72-的形式存在,写出其相互转化的离子方程式______ 。我国常用NaHSO3做还原剂,写出还原池中反应的离子方程式__________ 。
(2)废水中残留六价铬的浓度随溶液pH变化如图所示。实际生产中需控制pH=2.5~3.0,原因可能是_____________ 。

(3)沉淀池中生成Cr(OH)3的颗粒太细,为促使其更好地沉淀,可采取的措施是________ 。
(4)我国规定,工业废水中含Cr(VI)量的排放标准为0.1 mg/L。已知:Cr的相对原子质量为52,Ksp(BaCrO4)=1.2×10-10。若用Ba2+除去废水中的CrO42-,达到废水排放标准时,废水中Ba2+浓度最低为___________ mol/L(保留小数点后2位)。用Ba2+除去废水中的CrO42-是否可行,为什么?请简要回答。________________

(1)废水中,六价铬以CrO42-;或者Cr2O72-的形式存在,写出其相互转化的离子方程式
(2)废水中残留六价铬的浓度随溶液pH变化如图所示。实际生产中需控制pH=2.5~3.0,原因可能是

(3)沉淀池中生成Cr(OH)3的颗粒太细,为促使其更好地沉淀,可采取的措施是
(4)我国规定,工业废水中含Cr(VI)量的排放标准为0.1 mg/L。已知:Cr的相对原子质量为52,Ksp(BaCrO4)=1.2×10-10。若用Ba2+除去废水中的CrO42-,达到废水排放标准时,废水中Ba2+浓度最低为
您最近一年使用:0次
2020-02-12更新
|
269次组卷
|
3卷引用:综合复习与测试(2)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)
(已下线)综合复习与测试(2)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)四川省成都市2019—2020学年高二上学期期末调研考试化学试题四川省简阳市阳安中学2019-2020学年高二上期期末调研考试化学试题
2014·福建·高考真题
真题
名校
10 . 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为__________________ 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是________ (填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液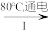 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□_____ 。
②Ⅱ中转化的基本反应类型是___________________ ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是______________________________ 。
(4)一定条件,在水溶液中1 mol Cl-、ClO (x=1,2,3,4)的能量(KJ)相对大小如图所示。
(x=1,2,3,4)的能量(KJ)相对大小如图所示。
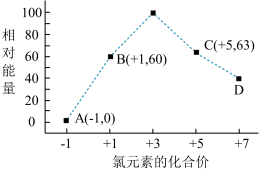
①D是_________________ (填离子符号)。
②B→A+C反应的热化学方程式为_____________________ (用离子符号表示)。
(1)与氯元素同族的短周期元素的原子结构示意图为
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液
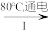 NaClO3溶液
NaClO3溶液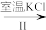 KClO3晶体
KClO3晶体①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□
②Ⅱ中转化的基本反应类型是
(4)一定条件,在水溶液中1 mol Cl-、ClO
 (x=1,2,3,4)的能量(KJ)相对大小如图所示。
(x=1,2,3,4)的能量(KJ)相对大小如图所示。
①D是
②B→A+C反应的热化学方程式为
您最近一年使用:0次
2019-01-30更新
|
2007次组卷
|
9卷引用:【知识图鉴】单元讲练测选择性必修1第1单元03巩固练
(已下线)【知识图鉴】单元讲练测选择性必修1第1单元03巩固练(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(教学案)(已下线)2019高考备考二轮复习精品资料-专题7 物质结构与元素周期律(教学案)(已下线)2019高考备考二轮复习精品资料-专题8 化学反应中与能量变化(教学案)江西省九江一中2020-2021学年高二上学期月考化学试题2014年全国普通高等学校招生统一考试理科综合能力测试化学(福建卷)(已下线)2015届江西省金溪一中高三暑期化学试卷(已下线)上海市格致中学2015届高三上学期摸底考试化学试题



