名校
解题方法
1 . 工业上以软锰矿(主要成分为MnO2,还含有少量Fe2O3)和辉钼矿(主要成分为MoS2,还含有少量Si、Ni的氧化物)为原料,制备四钼酸铵晶体[(NH4)2Mo4O13 2H2O]和硫酸锰晶体的工艺流程如下:
2H2O]和硫酸锰晶体的工艺流程如下:  分别为19.4和12.6;
分别为19.4和12.6; 。
。
回答下列问题:
(1)为了提高焙烧效率,可以采取的措施有___________ (写一条即可);“高温焙烧”时MnO2、MoS2转化为MnMoO4、MnSO4,写出该反应的化学方程式___________ 。
(2)“除铁”过程中加入碳酸钠调节溶液的pH至2,生成难溶于水的黄钠铁矾[NaFe3(SO4)2(OH)6],写出该反应的离子方程式___________ 。
(3)“除铁”后的溶液中c(Mn2+)=0.5 mol L-1,当溶液中可溶组分浓度c≤10-5mol
L-1,当溶液中可溶组分浓度c≤10-5mol L-1时,可认为已除尽,则“除镍”应控制溶液pH的范围是
L-1时,可认为已除尽,则“除镍”应控制溶液pH的范围是___________ [已知pc(S2-)=-lgc(S2-),该溶液中pc(S2-)和pH的关系为pc(S2-)=15.1-pH;忽略溶液体积变化]。
(4)硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如下图所示。从过滤所得的滤液中获得较高纯度MnSO4 H2O的操作是:控制温度在80~90 ℃之间蒸发结晶,
H2O的操作是:控制温度在80~90 ℃之间蒸发结晶,___________ ,使固体MnSO4 H2O与溶液分离,
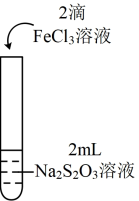
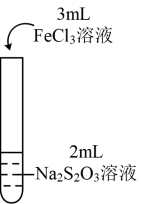
H2O与溶液分离,___________ ,真空干燥。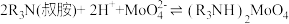 ,则“反萃取”中的试剂X最适宜选用
,则“反萃取”中的试剂X最适宜选用___________ (填标号)。
a.稀硫酸 b.(NH4)2SO4溶液 c.NaOH溶液 d.氨水
从“母液”中回收的副产品主要是___________ (填名称)。
 2H2O]和硫酸锰晶体的工艺流程如下:
2H2O]和硫酸锰晶体的工艺流程如下: 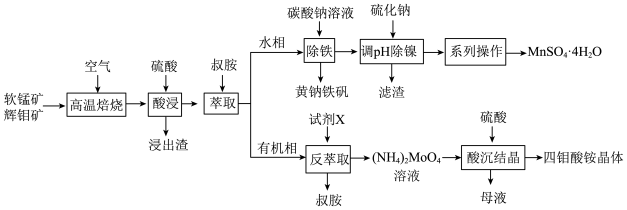
 分别为19.4和12.6;
分别为19.4和12.6; 。
。回答下列问题:
(1)为了提高焙烧效率,可以采取的措施有
(2)“除铁”过程中加入碳酸钠调节溶液的pH至2,生成难溶于水的黄钠铁矾[NaFe3(SO4)2(OH)6],写出该反应的离子方程式
(3)“除铁”后的溶液中c(Mn2+)=0.5 mol
 L-1,当溶液中可溶组分浓度c≤10-5mol
L-1,当溶液中可溶组分浓度c≤10-5mol L-1时,可认为已除尽,则“除镍”应控制溶液pH的范围是
L-1时,可认为已除尽,则“除镍”应控制溶液pH的范围是(4)硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如下图所示。从过滤所得的滤液中获得较高纯度MnSO4
 H2O的操作是:控制温度在80~90 ℃之间蒸发结晶,
H2O的操作是:控制温度在80~90 ℃之间蒸发结晶, H2O与溶液分离,
H2O与溶液分离,
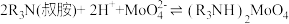 ,则“反萃取”中的试剂X最适宜选用
,则“反萃取”中的试剂X最适宜选用a.稀硫酸 b.(NH4)2SO4溶液 c.NaOH溶液 d.氨水
从“母液”中回收的副产品主要是
您最近一年使用:0次
解题方法
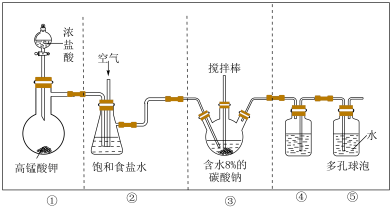
2 . 次氯酸作为消毒剂,被广泛应用于物体表面、织物等污染物品的消毒。某小组涉及如下装置(部分夹持装置略)制备 。
。 混合通入潮湿的碳酸钠中能生成
混合通入潮湿的碳酸钠中能生成 ,且反应放热;
,且反应放热;
ⅱ. 浓度过高时易爆炸,不含
浓度过高时易爆炸,不含 的
的 易与水反应生成
易与水反应生成 ;
;
ⅲ. 在
在 以上会分解。
以上会分解。
请回答下列问题:
(1)写出装置①中发生反应的化学方程式:_____ 。
(2)试从平衡角度分析装置②中试剂选择饱和食盐水的原因:_____ ;饱和食盐水也可替换为_____ 。
(3)制备 的一种产物为
的一种产物为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_____ 。
(4)装置④的作用是_____ ;装置⑤中多孔球泡的作用是_____ 。
(5)实验小组成员发现该套制备装置的设计存在一定问题并制订了修正方案:
a.将装置④的导管改为左长右短;b._____ 。
 。
。
 混合通入潮湿的碳酸钠中能生成
混合通入潮湿的碳酸钠中能生成 ,且反应放热;
,且反应放热;ⅱ.
 浓度过高时易爆炸,不含
浓度过高时易爆炸,不含 的
的 易与水反应生成
易与水反应生成 ;
;ⅲ.
 在
在 以上会分解。
以上会分解。请回答下列问题:
(1)写出装置①中发生反应的化学方程式:
(2)试从平衡角度分析装置②中试剂选择饱和食盐水的原因:
(3)制备
 的一种产物为
的一种产物为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(4)装置④的作用是
(5)实验小组成员发现该套制备装置的设计存在一定问题并制订了修正方案:
a.将装置④的导管改为左长右短;b.
您最近一年使用:0次
解题方法
3 . 以菱锌矿(主要含有ZnCO3,另含有少量CaO、Fe2O3、FeO、CoO、CuO、SiO2等)为原料电解制Zn的流程如图:
(1)“酸浸”时为提高锌的浸出率,可采取的措施有___________ (写出一种即可)。
(2)“调pH过滤”中,物质X最适宜选择___________ (填标号)。
A.NaOH B.Ca(OH)2 C.NH3·H2O
(3)“氧化过滤”中,Fe2+转化为Fe(OH)3沉淀的离子方程式为___________ 。若反应结束时,溶液pH为5,则残留的c(Fe3+)=___________ mol·L-l。
(4)H2O2是常见绿色氧化剂,原因是___________ 。
(5)“脱钙镁过滤”后,溶液中 =
=___________ 。
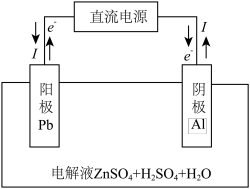
(6)“电解”装置示意如图,开始通电后,阳极表面生成PbO2,保护阳极不被酸性电解液腐蚀,相应的电极反应式为___________ 。
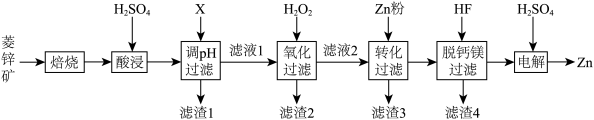
| 物质 | Fe(OH)3 | Zn(OH)2 | MgF2 | CaF2 |
| Ksp | 2.7×10-39 | 1.3×10-17 | 5.2×10-11 | 3.9×10-9 |
(1)“酸浸”时为提高锌的浸出率,可采取的措施有
(2)“调pH过滤”中,物质X最适宜选择
A.NaOH B.Ca(OH)2 C.NH3·H2O
(3)“氧化过滤”中,Fe2+转化为Fe(OH)3沉淀的离子方程式为
(4)H2O2是常见绿色氧化剂,原因是
(5)“脱钙镁过滤”后,溶液中
 =
=(6)“电解”装置示意如图,开始通电后,阳极表面生成PbO2,保护阳极不被酸性电解液腐蚀,相应的电极反应式为
您最近一年使用:0次
解题方法
4 . 高压氢还原法可直接从溶液中提取金属粉。以硫化铜(CuS)精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如下: 如下表所示:
如下表所示:
请回答下列问题:
(1)“浸取”时能提高反应速率的措施有_____ (答一条即可)。
(2)“浸取”时增大 压强可促进
压强可促进 的浸出,从沉淀溶解平衡角度进行解释:
的浸出,从沉淀溶解平衡角度进行解释:_____ 。
(3)固体 的主要成分是
的主要成分是 和
和_____ (填化学式)。
(4)利用上述表格数据,计算 的
的
_____ 。
(5)“中和调 ”应控制的
”应控制的 范围是
范围是_____ 。
(6)“还原”中发生反应的离子方程式为_____ 。
(7)金属 为
为_____ 。

 如下表所示:
如下表所示:| 物质 |  |  |  |
开始沉淀 的 的 | 2.2 | 5.2 | 6.7 |
沉淀完全 的 的 | 3.2 | 6.7 | 8.2 |
(1)“浸取”时能提高反应速率的措施有
(2)“浸取”时增大
 压强可促进
压强可促进 的浸出,从沉淀溶解平衡角度进行解释:
的浸出,从沉淀溶解平衡角度进行解释:(3)固体
 的主要成分是
的主要成分是 和
和(4)利用上述表格数据,计算
 的
的
(5)“中和调
 ”应控制的
”应控制的 范围是
范围是(6)“还原”中发生反应的离子方程式为
(7)金属
 为
为
您最近一年使用:0次
5 . 次磷酸 是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:
是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:
(1)次磷酸中 的化合价为
的化合价为___________ ,画出 的原子结构示意图:
的原子结构示意图:___________ 。
(2)写出 与足量
与足量 溶液反应的化学方程式:
溶液反应的化学方程式:___________ 。
(3)工业上次磷酸 常用于化学镀银,发生的反应如下:
常用于化学镀银,发生的反应如下: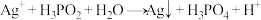 (方程式未配平)
(方程式未配平)
①该反应中___________ (填化学式)被还原。
②配平该反应方程式并标出电子转移的方向和数目:___________ 。
 。
。
③据该反应判断,还原性:___________ >___________ (填化学式)。
④若有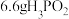 参加该反应,则反应中转移电子的物质的量为
参加该反应,则反应中转移电子的物质的量为___________  。
。
(4)若将氯气通入 溶液中,也发生
溶液中,也发生 的转化,写出该反应的化学方程式:
的转化,写出该反应的化学方程式:___________ 。
 是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:
是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:(1)次磷酸中
 的化合价为
的化合价为 的原子结构示意图:
的原子结构示意图:(2)写出
 与足量
与足量 溶液反应的化学方程式:
溶液反应的化学方程式:(3)工业上次磷酸
 常用于化学镀银,发生的反应如下:
常用于化学镀银,发生的反应如下: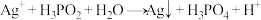 (方程式未配平)
(方程式未配平)①该反应中
②配平该反应方程式并标出电子转移的方向和数目:
 。
。③据该反应判断,还原性:
④若有
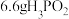 参加该反应,则反应中转移电子的物质的量为
参加该反应,则反应中转移电子的物质的量为 。
。(4)若将氯气通入
 溶液中,也发生
溶液中,也发生 的转化,写出该反应的化学方程式:
的转化,写出该反应的化学方程式:
您最近一年使用:0次
6 . 近日,中科院上海硅酸盐研究所施剑林团队报道了MnOOH催化谷胱甘肽自氧化产生活性氧。某小组以菱锰矿(主要成分为 ,含少量
,含少量 、FeO、CoO、
、FeO、CoO、 、
、 等)为原料制备高纯度MnOOH,流程如下:
等)为原料制备高纯度MnOOH,流程如下:
②几种金属离子沉淀的pH如表所示:
下列叙述正确的是
 ,含少量
,含少量 、FeO、CoO、
、FeO、CoO、 、
、 等)为原料制备高纯度MnOOH,流程如下:
等)为原料制备高纯度MnOOH,流程如下: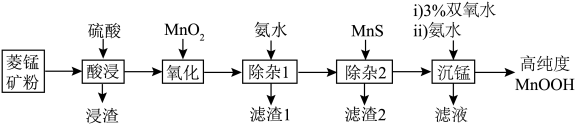
②几种金属离子沉淀的pH如表所示:
| 金属氢氧化物 |  |  |  |  |  |
| 开始沉淀的pH | 2.7 | 7.6 | 4.0 | 7.6 | 8.1 |
| 完全沉淀的pH | 3.7 | 9.6 | 5.2 | 9.2 | 10.1 |
A.滤渣1的成分是 和 和 |
B.“氧化”反应的离子方程式为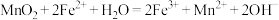 |
C.“除杂2”的原理是 |
D.双氧水氧化 ,滤液一定显酸性 ,滤液一定显酸性 |
您最近一年使用:0次
7 . 为探究 能否氧化
能否氧化 ,某兴趣小组用0.1
,某兴趣小组用0.1 的
的 溶液(pH≈7)和0.1
溶液(pH≈7)和0.1 的
的 溶液(pH≈1)进行如下操作并记录现象。
溶液(pH≈1)进行如下操作并记录现象。
已知:
① (紫色)
(紫色)
② 遇
遇 无明显现象
无明显现象
③ 能显著减慢
能显著减慢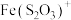 的紫色褪去
的紫色褪去
④在水溶液中 能自发的发生反应
能自发的发生反应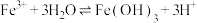
(1)分析实验Ⅰ:若向紫色溶液中加入酸,会使体系Ⅰ中___________ (填离子符号)浓度增大,导致 平衡
平衡___________ (填“正向”或“逆向”)移动;出现淡黄色浑浊是因为 与
与 发生了反应,该反应的离子方程式为
发生了反应,该反应的离子方程式为___________ 。
(2)分析实验Ⅱ:溶液紫色褪去,是因为 被
被___________ (填“氧化”或“还原”)生成 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(3)实验Ⅰ中出现淡黄色浑浊,而实验Ⅱ中未出现淡黄色浑浊的原因是___________ 。
 能否氧化
能否氧化 ,某兴趣小组用0.1
,某兴趣小组用0.1 的
的 溶液(pH≈7)和0.1
溶液(pH≈7)和0.1 的
的 溶液(pH≈1)进行如下操作并记录现象。
溶液(pH≈1)进行如下操作并记录现象。已知:
①
 (紫色)
(紫色)②
 遇
遇 无明显现象
无明显现象③
 能显著减慢
能显著减慢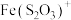 的紫色褪去
的紫色褪去④在水溶液中
 能自发的发生反应
能自发的发生反应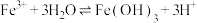
| 实验编号 | Ⅰ | Ⅱ |
| 实验操作 |
|
|
| 实验现象 | 溶液呈紫色,静置后紫色迅速褪去,久置后出现淡黄色浑浊 | 溶液呈紫色,静置后紫色较快褪去,久置后未出现淡黄色浑浊 |
(1)分析实验Ⅰ:若向紫色溶液中加入酸,会使体系Ⅰ中
 平衡
平衡 与
与 发生了反应,该反应的离子方程式为
发生了反应,该反应的离子方程式为(2)分析实验Ⅱ:溶液紫色褪去,是因为
 被
被 ,该反应的离子方程式为
,该反应的离子方程式为(3)实验Ⅰ中出现淡黄色浑浊,而实验Ⅱ中未出现淡黄色浑浊的原因是
您最近一年使用:0次
8 . 碱式硫酸铁[Fe(OH)SO4]难溶于水,可做净水剂、媒染剂、颜料和药物。可由硫酸亚铁与稀硝酸共热制得。某实验小组欲用如图所示装置进行实验,回答下列问题:

(1) 的空间结构为
的空间结构为___________ ;锥形瓶中发生反应的化学方程式为___________ ;某同学认为用H2O2溶液代替稀硝酸更好,理由是___________ 。
(2)酸性高锰酸钾溶液可除去一氧化氮,反应的离子方程式为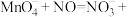
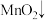 。该反应分两步进行。第一步是高锰酸钾把一氧化氮氧化为二氧化氮,反应的离子方程式为
。该反应分两步进行。第一步是高锰酸钾把一氧化氮氧化为二氧化氮,反应的离子方程式为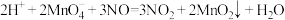 ,则第二步反应的离子方程式为
,则第二步反应的离子方程式为___________ 。
(3)某同学测定产物纯度的方法如下:称取2.5g产物溶于适量稀硫酸中,加入足量KI溶液,充分反应后,滴入几滴淀粉溶液,用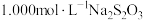 标准溶液滴定至终点,消耗标准液
标准溶液滴定至终点,消耗标准液 (涉及的反应方程式为
(涉及的反应方程式为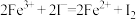 、
、 )。
)。
①盛装Na2S2O3标准溶液的滴定管应选用___________ (填“酸式”或“碱式”)滴定管。
②判断达到滴定终点的方法为___________ 。
③该产品的纯度为___________ %。滴定过程中,如果滴定速度过慢,可能导致所测结果___________ (填“偏高”“偏低”或“无影响”)。

(1)
 的空间结构为
的空间结构为(2)酸性高锰酸钾溶液可除去一氧化氮,反应的离子方程式为
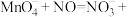
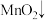 。该反应分两步进行。第一步是高锰酸钾把一氧化氮氧化为二氧化氮,反应的离子方程式为
。该反应分两步进行。第一步是高锰酸钾把一氧化氮氧化为二氧化氮,反应的离子方程式为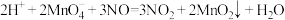 ,则第二步反应的离子方程式为
,则第二步反应的离子方程式为(3)某同学测定产物纯度的方法如下:称取2.5g产物溶于适量稀硫酸中,加入足量KI溶液,充分反应后,滴入几滴淀粉溶液,用
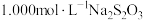 标准溶液滴定至终点,消耗标准液
标准溶液滴定至终点,消耗标准液 (涉及的反应方程式为
(涉及的反应方程式为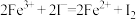 、
、 )。
)。①盛装Na2S2O3标准溶液的滴定管应选用
②判断达到滴定终点的方法为
③该产品的纯度为
您最近一年使用:0次
解题方法
9 . “声名大振”学习小组围绕新型绿色消毒剂——高铁酸钠( )展开探究。如图所示物质转化关系为高铁酸钠的一种制备方法及有关性质实验(部分反应产物已略去)。已知A为气态非金属单质,B为金属单质,E为生活中常见的调味品,F在标准状况下密度为
)展开探究。如图所示物质转化关系为高铁酸钠的一种制备方法及有关性质实验(部分反应产物已略去)。已知A为气态非金属单质,B为金属单质,E为生活中常见的调味品,F在标准状况下密度为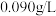 。
。

请回答:
(1)化合物D中的化学键类型是______ 。
(2) 的电子式是
的电子式是______ 。
(3)反应②的离子方程式是______ 。
(4)反应③,F在A中燃烧的反应现象是______ 。
(5)反应⑤的化学方程式是______ 。
(6)请在方框内填入相应物质的化学式,完成反应④的化学方程式,并标明电子转移的方向和数目:______ 。
2 +3
+3 +
+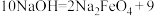
 +5
+5
 )展开探究。如图所示物质转化关系为高铁酸钠的一种制备方法及有关性质实验(部分反应产物已略去)。已知A为气态非金属单质,B为金属单质,E为生活中常见的调味品,F在标准状况下密度为
)展开探究。如图所示物质转化关系为高铁酸钠的一种制备方法及有关性质实验(部分反应产物已略去)。已知A为气态非金属单质,B为金属单质,E为生活中常见的调味品,F在标准状况下密度为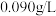 。
。
请回答:
(1)化合物D中的化学键类型是
(2)
 的电子式是
的电子式是(3)反应②的离子方程式是
(4)反应③,F在A中燃烧的反应现象是
(5)反应⑤的化学方程式是
(6)请在方框内填入相应物质的化学式,完成反应④的化学方程式,并标明电子转移的方向和数目:
2
 +3
+3 +
+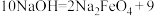
 +5
+5
您最近一年使用:0次
解题方法
10 . 高铁酸盐( )被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
)被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
(1)KClO饱和溶液与 饱和溶液反应可制备K2FeO4,反应的离子方程为
饱和溶液反应可制备K2FeO4,反应的离子方程为___________ 。
(2)聚合硫酸铁[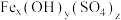 ]的组成可通过下列实验测定:
]的组成可通过下列实验测定:
①称取一定质量的聚合硫酸铁配成100.00 mL溶液A;
②准确量取20.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65 g;
③准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00 mL溶液B;
④准确量取25.00 mL溶液B,用 的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
通过计算确定该聚合硫酸铁的化学式_______ (写出计算过程)。
 )被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
)被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。(1)KClO饱和溶液与
 饱和溶液反应可制备K2FeO4,反应的离子方程为
饱和溶液反应可制备K2FeO4,反应的离子方程为(2)聚合硫酸铁[
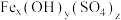 ]的组成可通过下列实验测定:
]的组成可通过下列实验测定:①称取一定质量的聚合硫酸铁配成100.00 mL溶液A;
②准确量取20.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65 g;
③准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00 mL溶液B;
④准确量取25.00 mL溶液B,用
 的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。通过计算确定该聚合硫酸铁的化学式
您最近一年使用:0次