1 .  可作为水溶液中
可作为水溶液中 歧化反应
歧化反应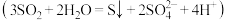 的催化剂。某实验小组为探究浓度、催化剂和溶液酸性对
的催化剂。某实验小组为探究浓度、催化剂和溶液酸性对 歧化反应速率的影响,分别在盛有反应物的试管中加入2mL相应试剂,密闭放置观察现象。
歧化反应速率的影响,分别在盛有反应物的试管中加入2mL相应试剂,密闭放置观察现象。
回答下列问题:
(1)实验①、②说明 是水溶液中
是水溶液中 歧化反应的催化剂,则a应是
歧化反应的催化剂,则a应是___________ (填化学式)。
(2)实验②、③的目的是___________ 。
(3)实验①、⑤说明___________ ,实验②是实验④的对比实验,则
___________ ,可得出的结论是___________ 。
(4) 可作为水溶液中
可作为水溶液中 歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.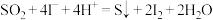
ii.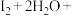 ___________
___________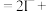 ___________+
___________+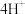 。
。___________
 可作为水溶液中
可作为水溶液中 歧化反应
歧化反应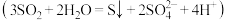 的催化剂。某实验小组为探究浓度、催化剂和溶液酸性对
的催化剂。某实验小组为探究浓度、催化剂和溶液酸性对 歧化反应速率的影响,分别在盛有反应物的试管中加入2mL相应试剂,密闭放置观察现象。
歧化反应速率的影响,分别在盛有反应物的试管中加入2mL相应试剂,密闭放置观察现象。| 实验编号 | 反应物 | 试剂组成 | 实验现象 |
| ① | 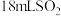 饱和溶液 饱和溶液 | a | 无明显现象 |
| ② | 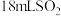 饱和溶液 饱和溶液 | 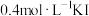 | 一段时间出现浑浊 |
| ③ | 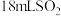 稀溶液 稀溶液 | 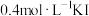 | 出现浑浊较②慢 |
| ④ | 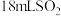 饱和溶液 饱和溶液 | 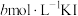 、 、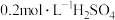 | 出现浑浊较②快 |
| ⑤ | 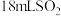 饱和溶液 饱和溶液 | 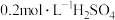 | 无明显现象 |
(1)实验①、②说明
 是水溶液中
是水溶液中 歧化反应的催化剂,则a应是
歧化反应的催化剂,则a应是(2)实验②、③的目的是
(3)实验①、⑤说明

(4)
 可作为水溶液中
可作为水溶液中 歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
歧化反应的催化剂,可能的催化过程如下。将ii补充完整。i.
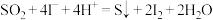
ii.
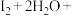 ___________
___________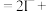 ___________+
___________+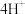 。
。
您最近一年使用:0次
2 . 氮氧化合物的排放造成了一系列环境问题,研究氮氧化合物的治理有利于环境保护。回答下列问题:
(1)在催化剂作用下,用 还原NO能较好消除烟气中的NO,发生反应的过程如图所示。
还原NO能较好消除烟气中的NO,发生反应的过程如图所示。
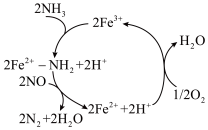
①铁元素在周期表中位于___________ 族,属于___________ 区,基态 的价电子排布式为
的价电子排布式为___________ 。
②该反应的催化剂是___________ ,用 还原NO的总反应为
还原NO的总反应为___________ 。
(2)为实现NO再利用,可以用烟气中NO制作燃料电池,其工作原理如图所示,其中电极a和电极b均为石墨电极, 在电池反应中可以循环使用。
在电池反应中可以循环使用。
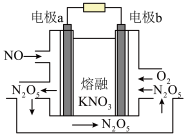
①电极b为燃料电池的_______ 极,放电时熔融 中
中 向
向________ (填“左”或“右”)移动。
②电极a上的电极反应式为___________ 。
(3)工业上还可以通过电解NO制备 ,其工作原理如图所示,其中电极均为石墨电极。
,其工作原理如图所示,其中电极均为石墨电极。
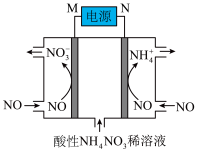
①M为电源的___________ 极,NO在M极发生___________ 反应。
②N电极上的电极反应式为___________ 。
③电解结束后,为使电解产物完全转化为 ,需补充物质
,需补充物质___________ 。
(1)在催化剂作用下,用
 还原NO能较好消除烟气中的NO,发生反应的过程如图所示。
还原NO能较好消除烟气中的NO,发生反应的过程如图所示。
①铁元素在周期表中位于
 的价电子排布式为
的价电子排布式为②该反应的催化剂是
 还原NO的总反应为
还原NO的总反应为(2)为实现NO再利用,可以用烟气中NO制作燃料电池,其工作原理如图所示,其中电极a和电极b均为石墨电极,
 在电池反应中可以循环使用。
在电池反应中可以循环使用。
①电极b为燃料电池的
 中
中 向
向②电极a上的电极反应式为
(3)工业上还可以通过电解NO制备
 ,其工作原理如图所示,其中电极均为石墨电极。
,其工作原理如图所示,其中电极均为石墨电极。
①M为电源的
②N电极上的电极反应式为
③电解结束后,为使电解产物完全转化为
 ,需补充物质
,需补充物质
您最近一年使用:0次
名校
3 . 根据所学知识,回答下列问题:
(1)自来水厂用氯气杀菌、消毒,其消毒原理主要是氯气溶于水后生成了 。氯水中存在的离子有
。氯水中存在的离子有___________ ; 的结构式为
的结构式为___________ ; 在溶液中电离本质是
在溶液中电离本质是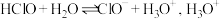 的电子式是
的电子式是___________ 。
(2) 氮的氧化物
氮的氧化物 中,含
中,含 物质的量为
物质的量为 ,则
,则 的摩尔质量为
的摩尔质量为___________ 。
(3)已知反应: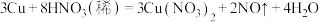 。若有
。若有 被氧化,则被还原的
被氧化,则被还原的 的物质的量是
的物质的量是___________  。
。
(4) 是一种黄绿色气体,被称为“第四代”饮用水消毒剂。制备
是一种黄绿色气体,被称为“第四代”饮用水消毒剂。制备 的一种方法为在平底烧瓶中加入
的一种方法为在平底烧瓶中加入 固体、足量草酸
固体、足量草酸 、稀硫酸,
、稀硫酸, 水浴加热。已知草酸被氧化为
水浴加热。已知草酸被氧化为 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(5)消毒效率是指消毒剂的有效氯。有效氯 有效系数
有效系数 含氯量,其中有效系数
含氯量,其中有效系数 夺取电子数,含氯量
夺取电子数,含氯量 的消毒效率为
的消毒效率为___________ 。
(1)自来水厂用氯气杀菌、消毒,其消毒原理主要是氯气溶于水后生成了
 。氯水中存在的离子有
。氯水中存在的离子有 的结构式为
的结构式为 在溶液中电离本质是
在溶液中电离本质是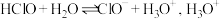 的电子式是
的电子式是(2)
 氮的氧化物
氮的氧化物 中,含
中,含 物质的量为
物质的量为 ,则
,则 的摩尔质量为
的摩尔质量为(3)已知反应:
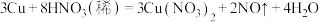 。若有
。若有 被氧化,则被还原的
被氧化,则被还原的 的物质的量是
的物质的量是 。
。(4)
 是一种黄绿色气体,被称为“第四代”饮用水消毒剂。制备
是一种黄绿色气体,被称为“第四代”饮用水消毒剂。制备 的一种方法为在平底烧瓶中加入
的一种方法为在平底烧瓶中加入 固体、足量草酸
固体、足量草酸 、稀硫酸,
、稀硫酸, 水浴加热。已知草酸被氧化为
水浴加热。已知草酸被氧化为 ,该反应的化学方程式为
,该反应的化学方程式为(5)消毒效率是指消毒剂的有效氯。有效氯
 有效系数
有效系数 含氯量,其中有效系数
含氯量,其中有效系数 夺取电子数,含氯量
夺取电子数,含氯量 的消毒效率为
的消毒效率为
您最近一年使用:0次
解题方法
4 . 草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4 2H2O实验流程如下:
2H2O实验流程如下:
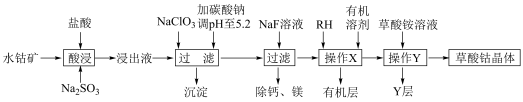
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)写出1种能提高酸浸速率的措施___________ ,“沉淀”的化学式为___________ 。
(2)操作X所用的玻璃仪器的名称为___________ 。
(3)“酸浸”过程中加入Na2SO3的目的是将___________ 还原(填离子符号);NaClO3的作用是将浸出液中的Fe2+氧化,产物中氯元素处于最低化合价,该反应的离子方程式为___________ 。
(4)试剂RH对金属离子的萃取率与pH的关系如图所示,加入萃取剂的作用是___________ ;使用萃取剂适宜的pH是___________ 。

A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为氟化物沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液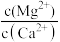 =
=___________ 。
 2H2O实验流程如下:
2H2O实验流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出1种能提高酸浸速率的措施
(2)操作X所用的玻璃仪器的名称为
(3)“酸浸”过程中加入Na2SO3的目的是将
(4)试剂RH对金属离子的萃取率与pH的关系如图所示,加入萃取剂的作用是

A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为氟化物沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液
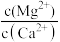 =
=
您最近一年使用:0次
5 . 硫氰化钾主要用于合成树脂、杀虫杀菌剂等,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
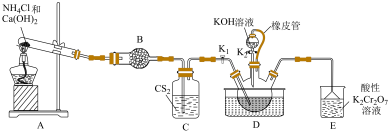
已知:① 不溶于
不溶于 ,
, 密度比水大且不溶于水;
密度比水大且不溶于水;
②三颈烧瓶内盛放: 、水和催化剂;
、水和催化剂;
③ ,该反应比较缓慢且
,该反应比较缓慢且 在高于170℃易分解。
在高于170℃易分解。
回答下列问题:
(1)装置A中发生反应的化学方程式为___________ 。
(2)装置B的仪器名称为___________ ;装置C的作用是___________ 。
(3)装置E可吸收还原性气体,防止污染环境,写出吸收 时发生反应的离子方程式
时发生反应的离子方程式___________ 。
(4)先通过过滤除去三颈烧瓶中的固体催化剂,再通过减压蒸发浓缩、___________ 、___________ 、洗涤、干燥,得到硫氰化钾晶体。
(5)测定晶体中KSCN的含量:称取10.0g样品。配成1000mL溶液后量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴 溶液作指示剂,用
溶液作指示剂,用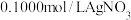 标准溶液滴定,达到滴定终点时平均消耗
标准溶液滴定,达到滴定终点时平均消耗 标准溶液20.00mL。[注:①滴定时发生的反应:
标准溶液20.00mL。[注:①滴定时发生的反应: (白色);②实验过程中不考虑SCN被硝酸氧化。]
(白色);②实验过程中不考虑SCN被硝酸氧化。]
①晶体中KSCN的质量分数为___________ (计算结果保留3位有效数字)。
②滴定前滴定管尖嘴部分有气泡,达到终点后气泡消失,则KSCN的质量分数___________ 。(填“偏大”、“偏小”或“无影响”)

已知:①
 不溶于
不溶于 ,
, 密度比水大且不溶于水;
密度比水大且不溶于水;②三颈烧瓶内盛放:
 、水和催化剂;
、水和催化剂;③
 ,该反应比较缓慢且
,该反应比较缓慢且 在高于170℃易分解。
在高于170℃易分解。回答下列问题:
(1)装置A中发生反应的化学方程式为
(2)装置B的仪器名称为
(3)装置E可吸收还原性气体,防止污染环境,写出吸收
 时发生反应的离子方程式
时发生反应的离子方程式(4)先通过过滤除去三颈烧瓶中的固体催化剂,再通过减压蒸发浓缩、
(5)测定晶体中KSCN的含量:称取10.0g样品。配成1000mL溶液后量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
 溶液作指示剂,用
溶液作指示剂,用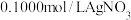 标准溶液滴定,达到滴定终点时平均消耗
标准溶液滴定,达到滴定终点时平均消耗 标准溶液20.00mL。[注:①滴定时发生的反应:
标准溶液20.00mL。[注:①滴定时发生的反应: (白色);②实验过程中不考虑SCN被硝酸氧化。]
(白色);②实验过程中不考虑SCN被硝酸氧化。]①晶体中KSCN的质量分数为
②滴定前滴定管尖嘴部分有气泡,达到终点后气泡消失,则KSCN的质量分数
您最近一年使用:0次
名校
6 . 五氧化二钒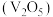 在冶金、催化剂、磁性材料等领域有重要作用。实验室以含钥废料(含
在冶金、催化剂、磁性材料等领域有重要作用。实验室以含钥废料(含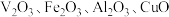 等)来制备
等)来制备 的一种工艺流程如下图:
的一种工艺流程如下图:

已知:I.含钒离子在溶液中的主要存在形式与溶液 的关系:
的关系:
II.25℃时,难溶电解质的溶度积常数如下表所示:
当金属离子浓度小于 时,沉淀完全。
时,沉淀完全。
请回答下列问题:
(1)基态钒原子的价电子轨道表示式为___________
(2)“焙烧”时, 生成
生成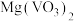 的反应中,氧化剂与还原剂物质的量之比为
的反应中,氧化剂与还原剂物质的量之比为___________
(3)“调 净化I”的步骤中,金属阳离子完全沉淀顺序依次是
净化I”的步骤中,金属阳离子完全沉淀顺序依次是___________ ,该步骤除了沉淀某些金属阳离子外,还有的作用是___________ 。
(4)“煅烧”时,除生成 外,还生成参与大气循环的气体,该反应的化学方程式为
外,还生成参与大气循环的气体,该反应的化学方程式为________
(5)全钒液流电池是一种新型储能转化装置,该电池是将不同价态的含钥离子溶液分别作为正极和负极的活性物质,储存在各自的酸性电解质储罐中。其结构原理如图所示:
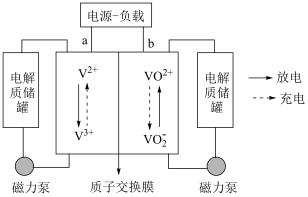
①放电时,正极的电极反应式为___________
②充电时,理论上电路中转移 电子时,右侧电解质储罐中
电子时,右侧电解质储罐中 变化的数目为
变化的数目为___________ 。
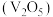 在冶金、催化剂、磁性材料等领域有重要作用。实验室以含钥废料(含
在冶金、催化剂、磁性材料等领域有重要作用。实验室以含钥废料(含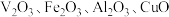 等)来制备
等)来制备 的一种工艺流程如下图:
的一种工艺流程如下图:
已知:I.含钒离子在溶液中的主要存在形式与溶液
 的关系:
的关系: |  |  |  |
| 主要离子 |  |  | 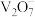 |
| 难溶电解质 |  |  |  |  |
 | 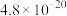 | 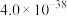 |  | 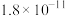 |
 时,沉淀完全。
时,沉淀完全。请回答下列问题:
(1)基态钒原子的价电子轨道表示式为
(2)“焙烧”时,
 生成
生成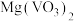 的反应中,氧化剂与还原剂物质的量之比为
的反应中,氧化剂与还原剂物质的量之比为(3)“调
 净化I”的步骤中,金属阳离子完全沉淀顺序依次是
净化I”的步骤中,金属阳离子完全沉淀顺序依次是(4)“煅烧”时,除生成
 外,还生成参与大气循环的气体,该反应的化学方程式为
外,还生成参与大气循环的气体,该反应的化学方程式为(5)全钒液流电池是一种新型储能转化装置,该电池是将不同价态的含钥离子溶液分别作为正极和负极的活性物质,储存在各自的酸性电解质储罐中。其结构原理如图所示:

①放电时,正极的电极反应式为
②充电时,理论上电路中转移
 电子时,右侧电解质储罐中
电子时,右侧电解质储罐中 变化的数目为
变化的数目为
您最近一年使用:0次
名校
7 . 二氯化二硫 是广泛用于橡胶工业的硫化剂,广泛用于石油化工,其分子结构如下图所示。制备方法:在120℃向硫磺粉(用
是广泛用于橡胶工业的硫化剂,广泛用于石油化工,其分子结构如下图所示。制备方法:在120℃向硫磺粉(用 浸润)中通入
浸润)中通入 。已知:常温下
。已知:常温下 遇水易水解,并产生能使品红裉色的气体。下列说法错误的是
遇水易水解,并产生能使品红裉色的气体。下列说法错误的是

 是广泛用于橡胶工业的硫化剂,广泛用于石油化工,其分子结构如下图所示。制备方法:在120℃向硫磺粉(用
是广泛用于橡胶工业的硫化剂,广泛用于石油化工,其分子结构如下图所示。制备方法:在120℃向硫磺粉(用 浸润)中通入
浸润)中通入 。已知:常温下
。已知:常温下 遇水易水解,并产生能使品红裉色的气体。下列说法错误的是
遇水易水解,并产生能使品红裉色的气体。下列说法错误的是
A. 分子中所有原子均满足8电子结构 分子中所有原子均满足8电子结构 |
B. 中 中 原子的杂化类型为 原子的杂化类型为 杂化 杂化 |
C.用 浸润可加快反应速率,体现相似相溶原理 浸润可加快反应速率,体现相似相溶原理 |
D. 与 与 反应的化学方程式可能为: 反应的化学方程式可能为: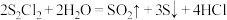 |
您最近一年使用:0次
2024-02-16更新
|
245次组卷
|
3卷引用:安徽省合肥市第一中学2023-2024学年高二上学期期末考试化学试题
解题方法
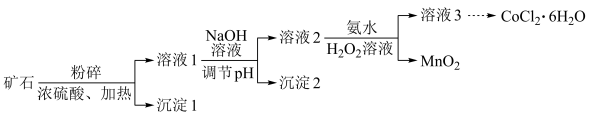
8 . 金属钴是一种非常稀缺的金属之一,具有耐高温、高压的特性,可应用于催化剂。电池方面,电子设备和航空设备中。某钴矿石的主要成分包括 、
、 、
、 和
和 。由该矿石制
。由该矿石制 固体的方法如图(部分分离操作省略):
固体的方法如图(部分分离操作省略):
资料:25℃时有关金属离子沉淀的相关PH见下表
(1)上述矿石溶解过程中,粉碎的目的是___________ 。
(2) 溶于浓硫酸是非氧化还原反应,溶液1中阳离子包括
溶于浓硫酸是非氧化还原反应,溶液1中阳离子包括 、
、 和
和___________ 。
(3)沉淀2是___________ ,此时调节溶液的pH范围是___________ 。
(4)①已知:当c(Co2+)≤1×10-5mol/L时可认为 完全沉淀,则
完全沉淀,则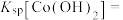
___________ 。
②溶液2中加入氨水和 溶液,发生反应的离子方程式为:
溶液,发生反应的离子方程式为:___________ 。
(5)溶液3中加入 溶液生成
溶液生成 沉淀,沉淀剂若选择
沉淀,沉淀剂若选择 ,所得到的沉淀中可能会混有
,所得到的沉淀中可能会混有___________ 。
 、
、 、
、 和
和 。由该矿石制
。由该矿石制 固体的方法如图(部分分离操作省略):
固体的方法如图(部分分离操作省略):
资料:25℃时有关金属离子沉淀的相关PH见下表
| 离子 |  |  |  |
| 开始沉淀时的PH | 1.9 | 7.15 | 8.2 |
| 沉淀完全时的PH | 2.8 | 9.15 | 10.2 |
(1)上述矿石溶解过程中,粉碎的目的是
(2)
 溶于浓硫酸是非氧化还原反应,溶液1中阳离子包括
溶于浓硫酸是非氧化还原反应,溶液1中阳离子包括 、
、 和
和(3)沉淀2是
(4)①已知:当c(Co2+)≤1×10-5mol/L时可认为
 完全沉淀,则
完全沉淀,则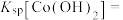
②溶液2中加入氨水和
 溶液,发生反应的离子方程式为:
溶液,发生反应的离子方程式为:(5)溶液3中加入
 溶液生成
溶液生成 沉淀,沉淀剂若选择
沉淀,沉淀剂若选择 ,所得到的沉淀中可能会混有
,所得到的沉淀中可能会混有
您最近一年使用:0次
解题方法
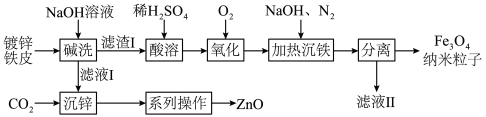
9 . 纳米 在生物医学等方面具有广泛的用途。利用废旧镀锌铁皮(含
在生物医学等方面具有广泛的用途。利用废旧镀锌铁皮(含 、
、 、
、 、
、 )制备纳米
)制备纳米 及副产物
及副产物 的流程如下:
的流程如下:
查阅资料: 、
、 、
、 的化学性质与铝及其化合物类似。
的化学性质与铝及其化合物类似。
回答下列问题:
(1)“碱洗”时, 溶液的作用是
溶液的作用是___________________ 。
(2)“沉锌”时,选用 而不用盐酸的依据是
而不用盐酸的依据是___________________ ,该反应的离子方程式为__________________________ 。
(3)“系列操作”包括过滤、____________ 。
(4)“氧化”后的溶液中所含金属阳离子有________________________ (填离子符号)。
(5)文献表明,若“氧化”时,溶液 过低,
过低, 容易转化为
容易转化为 ,该反应的化学方程式为
,该反应的化学方程式为_______________________ 。
(6)检验“分离”得到的 是否洗净的操作为
是否洗净的操作为______________________ 。
(7)某化学兴趣小组用 废旧镀锌铁皮(
废旧镀锌铁皮( 元素的质量分数为
元素的质量分数为 )制备纳米
)制备纳米 ,最终得到
,最终得到 产品,则产率为
产品,则产率为______ (保留三位有效数字)。
 在生物医学等方面具有广泛的用途。利用废旧镀锌铁皮(含
在生物医学等方面具有广泛的用途。利用废旧镀锌铁皮(含 、
、 、
、 、
、 )制备纳米
)制备纳米 及副产物
及副产物 的流程如下:
的流程如下:
查阅资料:
 、
、 、
、 的化学性质与铝及其化合物类似。
的化学性质与铝及其化合物类似。回答下列问题:
(1)“碱洗”时,
 溶液的作用是
溶液的作用是(2)“沉锌”时,选用
 而不用盐酸的依据是
而不用盐酸的依据是(3)“系列操作”包括过滤、
(4)“氧化”后的溶液中所含金属阳离子有
(5)文献表明,若“氧化”时,溶液
 过低,
过低, 容易转化为
容易转化为 ,该反应的化学方程式为
,该反应的化学方程式为(6)检验“分离”得到的
 是否洗净的操作为
是否洗净的操作为(7)某化学兴趣小组用
 废旧镀锌铁皮(
废旧镀锌铁皮( 元素的质量分数为
元素的质量分数为 )制备纳米
)制备纳米 ,最终得到
,最终得到 产品,则产率为
产品,则产率为
您最近一年使用:0次
10 .  常用于制钡盐和立德粉,也作橡胶硫化剂。实验室利用下图装置探究制取
常用于制钡盐和立德粉,也作橡胶硫化剂。实验室利用下图装置探究制取 时气体产物的成分(夹持仪器略去),并测定固体产品的纯度。
时气体产物的成分(夹持仪器略去),并测定固体产品的纯度。
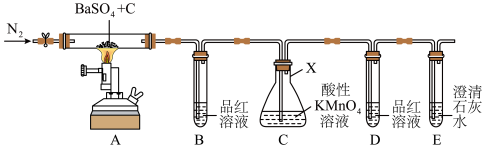
(1)仪器 的名称为
的名称为____________ 。
(2)一段时间后, 中品红溶液褪色,
中品红溶液褪色, 中溶液颜色变淡,
中溶液颜色变淡, 、
、 中无明显现象,则实验生成的气体为
中无明显现象,则实验生成的气体为____________ (填化学式),装置 中发生反应的离子方程式是
中发生反应的离子方程式是____________________________________ 。
(3)该装置的明显缺陷是____________________________________ 。
(4)测定 样品纯度的实验步骤如下:
样品纯度的实验步骤如下:
Ⅰ.称取 样品,加水溶解,配制成
样品,加水溶解,配制成 溶液;
溶液;
Ⅱ.取一锥形瓶,向其中加入 醋酸溶液、
醋酸溶液、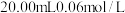 碘溶液、
碘溶液、 Ⅰ中所配制的溶液,待其充分反应(硫元素完全转化为硫单质);
Ⅰ中所配制的溶液,待其充分反应(硫元素完全转化为硫单质);
Ⅲ.向充分反应后的溶液中,加入 滴淀粉溶液,用
滴淀粉溶液,用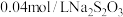 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 (
( )。
)。
①滴定终点时的现象为____________________________________________________________ 。
②样品中 的纯度为
的纯度为____________  (保留三位有效数字)。
(保留三位有效数字)。
③下列情况会导致测定 的纯度偏小的是
的纯度偏小的是____________ (填标号)。
a.称量样品时,发生了潮解
b.配制 溶液时,未洗涤烧杯
溶液时,未洗涤烧杯
c.达滴定终点时,俯视读数
 常用于制钡盐和立德粉,也作橡胶硫化剂。实验室利用下图装置探究制取
常用于制钡盐和立德粉,也作橡胶硫化剂。实验室利用下图装置探究制取 时气体产物的成分(夹持仪器略去),并测定固体产品的纯度。
时气体产物的成分(夹持仪器略去),并测定固体产品的纯度。
(1)仪器
 的名称为
的名称为(2)一段时间后,
 中品红溶液褪色,
中品红溶液褪色, 中溶液颜色变淡,
中溶液颜色变淡, 、
、 中无明显现象,则实验生成的气体为
中无明显现象,则实验生成的气体为 中发生反应的离子方程式是
中发生反应的离子方程式是(3)该装置的明显缺陷是
(4)测定
 样品纯度的实验步骤如下:
样品纯度的实验步骤如下:Ⅰ.称取
 样品,加水溶解,配制成
样品,加水溶解,配制成 溶液;
溶液;Ⅱ.取一锥形瓶,向其中加入
 醋酸溶液、
醋酸溶液、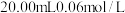 碘溶液、
碘溶液、 Ⅰ中所配制的溶液,待其充分反应(硫元素完全转化为硫单质);
Ⅰ中所配制的溶液,待其充分反应(硫元素完全转化为硫单质);Ⅲ.向充分反应后的溶液中,加入
 滴淀粉溶液,用
滴淀粉溶液,用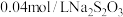 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 (
( )。
)。①滴定终点时的现象为
②样品中
 的纯度为
的纯度为 (保留三位有效数字)。
(保留三位有效数字)。③下列情况会导致测定
 的纯度偏小的是
的纯度偏小的是a.称量样品时,发生了潮解
b.配制
 溶液时,未洗涤烧杯
溶液时,未洗涤烧杯c.达滴定终点时,俯视读数
您最近一年使用:0次



