1 . 次磷酸 是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:
是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:
(1)次磷酸中 的化合价为
的化合价为___________ ,画出 的原子结构示意图:
的原子结构示意图:___________ 。
(2)写出 与足量
与足量 溶液反应的化学方程式:
溶液反应的化学方程式:___________ 。
(3)工业上次磷酸 常用于化学镀银,发生的反应如下:
常用于化学镀银,发生的反应如下: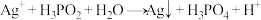 (方程式未配平)
(方程式未配平)
①该反应中___________ (填化学式)被还原。
②配平该反应方程式并标出电子转移的方向和数目:___________ 。
 。
。
③据该反应判断,还原性:___________ >___________ (填化学式)。
④若有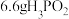 参加该反应,则反应中转移电子的物质的量为
参加该反应,则反应中转移电子的物质的量为___________  。
。
(4)若将氯气通入 溶液中,也发生
溶液中,也发生 的转化,写出该反应的化学方程式:
的转化,写出该反应的化学方程式:___________ 。
 是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:
是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:(1)次磷酸中
 的化合价为
的化合价为 的原子结构示意图:
的原子结构示意图:(2)写出
 与足量
与足量 溶液反应的化学方程式:
溶液反应的化学方程式:(3)工业上次磷酸
 常用于化学镀银,发生的反应如下:
常用于化学镀银,发生的反应如下: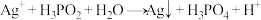 (方程式未配平)
(方程式未配平)①该反应中
②配平该反应方程式并标出电子转移的方向和数目:
 。
。③据该反应判断,还原性:
④若有
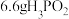 参加该反应,则反应中转移电子的物质的量为
参加该反应,则反应中转移电子的物质的量为 。
。(4)若将氯气通入
 溶液中,也发生
溶液中,也发生 的转化,写出该反应的化学方程式:
的转化,写出该反应的化学方程式:
您最近一年使用:0次
解题方法
2 . 铬酰氯( )常作有机合成的氯化剂。它的部分性质如下表所示:
)常作有机合成的氯化剂。它的部分性质如下表所示:
某小组设计如图装置利用 和HCl迅速反应制备铬酰氯。
和HCl迅速反应制备铬酰氯。
(1)装浓盐酸的仪器名称是___________ ,B装置作用是___________ 。
(2)A中可能看到的现象是___________ ,利用浓硫酸的性质是___________ 。
(3)C中反应的化学方程式是___________ 。
(4)有人认为,E装置可以用盛装NaOH溶液的洗气瓶替代,是否合理:___________ (填“是”或“否”),请解释原因:___________ 。
(5)利用如图装置测定铬酰氯中氯元素含量(杂质不参与反应)。 溶液,过滤,用稀硝酸酸化滤液,再加入
溶液,过滤,用稀硝酸酸化滤液,再加入 溶液,最后用
溶液,最后用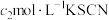 溶液滴定过量的
溶液滴定过量的 ,消耗溶液
,消耗溶液 。
。
该样品中氯元素质量分数为___________ 。如果滴定管没有润洗,测得结果会___________ (填“偏高”“偏低”或“无影响”)。
已知:常温下, ,
,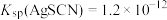 ,
,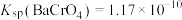 。
。
 )常作有机合成的氯化剂。它的部分性质如下表所示:
)常作有机合成的氯化剂。它的部分性质如下表所示:| 物理性质 | 化学性质 |
| 熔点:-96.5℃,沸点:117℃ | 放置在空气中会迅速挥发并水解 |
 和HCl迅速反应制备铬酰氯。
和HCl迅速反应制备铬酰氯。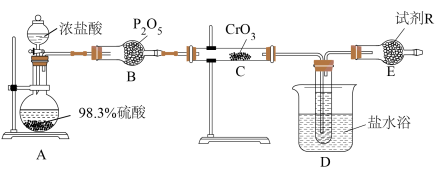
(1)装浓盐酸的仪器名称是
(2)A中可能看到的现象是
(3)C中反应的化学方程式是
(4)有人认为,E装置可以用盛装NaOH溶液的洗气瓶替代,是否合理:
(5)利用如图装置测定铬酰氯中氯元素含量(杂质不参与反应)。
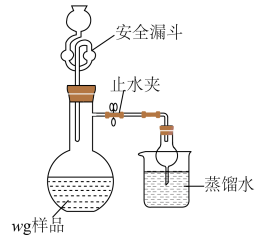
 溶液,过滤,用稀硝酸酸化滤液,再加入
溶液,过滤,用稀硝酸酸化滤液,再加入 溶液,最后用
溶液,最后用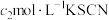 溶液滴定过量的
溶液滴定过量的 ,消耗溶液
,消耗溶液 。
。该样品中氯元素质量分数为
已知:常温下,
 ,
,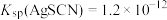 ,
,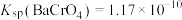 。
。
您最近一年使用:0次
3 . 近日,中科院上海硅酸盐研究所施剑林团队报道了MnOOH催化谷胱甘肽自氧化产生活性氧。某小组以菱锰矿(主要成分为 ,含少量
,含少量 、FeO、CoO、
、FeO、CoO、 、
、 等)为原料制备高纯度MnOOH,流程如下:
等)为原料制备高纯度MnOOH,流程如下:
②几种金属离子沉淀的pH如表所示:
下列叙述正确的是
 ,含少量
,含少量 、FeO、CoO、
、FeO、CoO、 、
、 等)为原料制备高纯度MnOOH,流程如下:
等)为原料制备高纯度MnOOH,流程如下: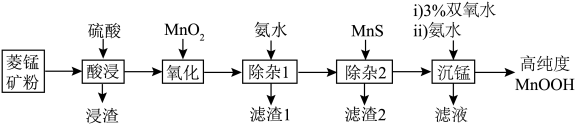
②几种金属离子沉淀的pH如表所示:
| 金属氢氧化物 |  |  |  |  |  |
| 开始沉淀的pH | 2.7 | 7.6 | 4.0 | 7.6 | 8.1 |
| 完全沉淀的pH | 3.7 | 9.6 | 5.2 | 9.2 | 10.1 |
A.滤渣1的成分是 和 和 |
B.“氧化”反应的离子方程式为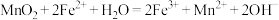 |
C.“除杂2”的原理是 |
D.双氧水氧化 ,滤液一定显酸性 ,滤液一定显酸性 |
您最近一年使用:0次
4 . 为探究 能否氧化
能否氧化 ,某兴趣小组用0.1
,某兴趣小组用0.1 的
的 溶液(pH≈7)和0.1
溶液(pH≈7)和0.1 的
的 溶液(pH≈1)进行如下操作并记录现象。
溶液(pH≈1)进行如下操作并记录现象。
已知:
① (紫色)
(紫色)
② 遇
遇 无明显现象
无明显现象
③ 能显著减慢
能显著减慢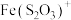 的紫色褪去
的紫色褪去
④在水溶液中 能自发的发生反应
能自发的发生反应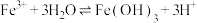
(1)分析实验Ⅰ:若向紫色溶液中加入酸,会使体系Ⅰ中___________ (填离子符号)浓度增大,导致 平衡
平衡___________ (填“正向”或“逆向”)移动;出现淡黄色浑浊是因为 与
与 发生了反应,该反应的离子方程式为
发生了反应,该反应的离子方程式为___________ 。
(2)分析实验Ⅱ:溶液紫色褪去,是因为 被
被___________ (填“氧化”或“还原”)生成 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(3)实验Ⅰ中出现淡黄色浑浊,而实验Ⅱ中未出现淡黄色浑浊的原因是___________ 。
 能否氧化
能否氧化 ,某兴趣小组用0.1
,某兴趣小组用0.1 的
的 溶液(pH≈7)和0.1
溶液(pH≈7)和0.1 的
的 溶液(pH≈1)进行如下操作并记录现象。
溶液(pH≈1)进行如下操作并记录现象。已知:
①
 (紫色)
(紫色)②
 遇
遇 无明显现象
无明显现象③
 能显著减慢
能显著减慢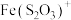 的紫色褪去
的紫色褪去④在水溶液中
 能自发的发生反应
能自发的发生反应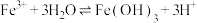
| 实验编号 | Ⅰ | Ⅱ |
| 实验操作 |
|
|
| 实验现象 | 溶液呈紫色,静置后紫色迅速褪去,久置后出现淡黄色浑浊 | 溶液呈紫色,静置后紫色较快褪去,久置后未出现淡黄色浑浊 |
(1)分析实验Ⅰ:若向紫色溶液中加入酸,会使体系Ⅰ中
 平衡
平衡 与
与 发生了反应,该反应的离子方程式为
发生了反应,该反应的离子方程式为(2)分析实验Ⅱ:溶液紫色褪去,是因为
 被
被 ,该反应的离子方程式为
,该反应的离子方程式为(3)实验Ⅰ中出现淡黄色浑浊,而实验Ⅱ中未出现淡黄色浑浊的原因是
您最近一年使用:0次
名校
5 . 铬及其化合物在催化、金属防腐等方面具有重要应用。催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。
(1)完成化学方程式:_____ 。
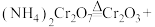 _____+_____。
_____+_____。
(2)Cr2O3催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为_____ (列式表示)。_____ (用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为_____ 。
(1)完成化学方程式:
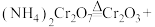 _____+_____。
_____+_____。(2)Cr2O3催化丙烷脱氢过程中,部分反应历程如图,
 过程的焓变为
过程的焓变为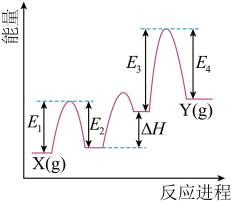
您最近一年使用:0次
名校
解题方法
6 . FeO(OH)在高档涂料、油墨等领域有着广泛的应用。以铁泥(主要含Fe2O3,以及少量的 、
、 、SiO2)为原料制备FeO(OH)的流程如图所示。
、SiO2)为原料制备FeO(OH)的流程如图所示。 溶于水,不溶于乙醇。回答下列问题:
溶于水,不溶于乙醇。回答下列问题:
(1)滤液①的溶质为H2SO4和_______ 、_______ (填化学式)。
(2)“提纯”步骤中所有可能的反应的离子方程式为_______ 、__________ 。
(3)加入乙醇的目的是_______ 。
(4)“氧化”步骤中主要反应的化学方程式为_______ 。
(5)按照以上流程回收处理1 kg铁泥(含Fe元素的质量分数为56%),得到890 g纯度为95%的产品,Fe元素的回收率为_______ 。
(6)镍铁电池放电时也可产生FeO(OH),其工作原理如图所示。 放电生成Fe(OH)2后,继续放电时,电极上的Fe(OH)2可转化为FeO(OH),写出该过程的电极反应式
放电生成Fe(OH)2后,继续放电时,电极上的Fe(OH)2可转化为FeO(OH),写出该过程的电极反应式_______ 。
 、
、 、SiO2)为原料制备FeO(OH)的流程如图所示。
、SiO2)为原料制备FeO(OH)的流程如图所示。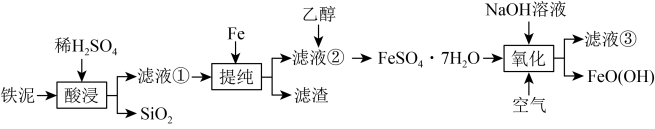
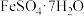 溶于水,不溶于乙醇。回答下列问题:
溶于水,不溶于乙醇。回答下列问题:(1)滤液①的溶质为H2SO4和
(2)“提纯”步骤中所有可能的反应的离子方程式为
(3)加入乙醇的目的是
(4)“氧化”步骤中主要反应的化学方程式为
(5)按照以上流程回收处理1 kg铁泥(含Fe元素的质量分数为56%),得到890 g纯度为95%的产品,Fe元素的回收率为
(6)镍铁电池放电时也可产生FeO(OH),其工作原理如图所示。
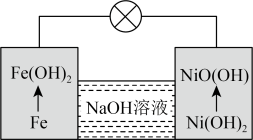
 放电生成Fe(OH)2后,继续放电时,电极上的Fe(OH)2可转化为FeO(OH),写出该过程的电极反应式
放电生成Fe(OH)2后,继续放电时,电极上的Fe(OH)2可转化为FeO(OH),写出该过程的电极反应式
您最近一年使用:0次
7 . 合成氨的发展体现了化学科学与技术的不断进步。
(1)1898年,化学家用氮气、碳化钙(CaC2)与水蒸气反应制备氨:
ⅰ.碳化钙和氮气在1000℃的高温下产生氰氨化钙(CaCN2);
ⅱ.氰氨化钙与水蒸气反应生成氨气。
写出反应ⅱ的化学方程式:_____________ 。
(2)20世纪初,以N2和H2为原料的工业合成氨方法研制成功。其反应为:N2(g)+3H2(g)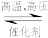 2NH3(g) △H=-92.4kJ/mol,压强对合成氨有较大影响。如图为不同压强下,以物质的量分数x(H2)=0.75、x(N2)=0.25进料(组成1),反应达平衡时x(NH3)与温度的计算结果。
2NH3(g) △H=-92.4kJ/mol,压强对合成氨有较大影响。如图为不同压强下,以物质的量分数x(H2)=0.75、x(N2)=0.25进料(组成1),反应达平衡时x(NH3)与温度的计算结果。___ p2(填“>”或“<”),简述理由:__________________ 。
ⅱ.在p1、x(NH3)=0.20时,氮气的转化率为_________ 。
ⅲ.合成氨原料气中存在不参与反应的Ar时会影响NH3的平衡含量。在p1时,以物质的量分数x(H2)=0.675、x(N2)=0.225、x(Ar)=0.10进料(组成2)。反应达平衡时:x(NH3)与温度的计算结果与组成1相比有一定变化,在图中用虚线画出相应曲线______ 。
(3)我国科学家研制出Fe-TiO2-xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,纳米Fe的温度为547℃,而TiO2-xHy的温度为415℃),解决了温度对合成氨工业反应速率和平衡转化率影响矛盾的问题,其催化合成氨机理如图所示。__________ 。
(1)1898年,化学家用氮气、碳化钙(CaC2)与水蒸气反应制备氨:
ⅰ.碳化钙和氮气在1000℃的高温下产生氰氨化钙(CaCN2);
ⅱ.氰氨化钙与水蒸气反应生成氨气。
写出反应ⅱ的化学方程式:
(2)20世纪初,以N2和H2为原料的工业合成氨方法研制成功。其反应为:N2(g)+3H2(g)
 2NH3(g) △H=-92.4kJ/mol,压强对合成氨有较大影响。如图为不同压强下,以物质的量分数x(H2)=0.75、x(N2)=0.25进料(组成1),反应达平衡时x(NH3)与温度的计算结果。
2NH3(g) △H=-92.4kJ/mol,压强对合成氨有较大影响。如图为不同压强下,以物质的量分数x(H2)=0.75、x(N2)=0.25进料(组成1),反应达平衡时x(NH3)与温度的计算结果。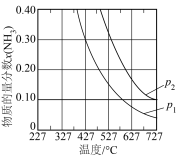
ⅱ.在p1、x(NH3)=0.20时,氮气的转化率为
ⅲ.合成氨原料气中存在不参与反应的Ar时会影响NH3的平衡含量。在p1时,以物质的量分数x(H2)=0.675、x(N2)=0.225、x(Ar)=0.10进料(组成2)。反应达平衡时:x(NH3)与温度的计算结果与组成1相比有一定变化,在图中用虚线画出相应曲线
(3)我国科学家研制出Fe-TiO2-xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,纳米Fe的温度为547℃,而TiO2-xHy的温度为415℃),解决了温度对合成氨工业反应速率和平衡转化率影响矛盾的问题,其催化合成氨机理如图所示。
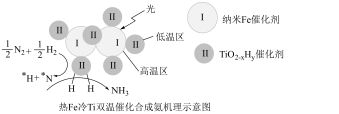
您最近一年使用:0次
解题方法
8 . 某废水中主要含有Mn2+、Fe3+、Fe2+、Co2+、Ni2+以及 。某同学在实验室以该废水为原料制备金属M的工艺流程如下:
。某同学在实验室以该废水为原料制备金属M的工艺流程如下:
②Ksp[Fe(OH)3]=4.0×10-38,Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21。
回答下列问题:
(1)常温下,该废水的pH_____ (填“>”“=”或“<”)7。
(2)“氧化”时反应的离子方程式为_____ ,若用H2O2代替MnO2,则参加反应的n(H2O2)∶n(Fe2+)=_____ 。
(3)“调pH”时,若所得滤渣1为少量MnO2和另一种氢氧化物,应控制溶液pH的调节范围是_____ 。
(4)“除钴镍”时,发生的反应为 等。反应完全后的滤液中Mn2+与Ni2+的物质的量浓度之比是
等。反应完全后的滤液中Mn2+与Ni2+的物质的量浓度之比是_____ 。
(5)“电解”时,阳极电极反应式为_____ ;电解液可以返回“_____ ”(填工序名称)循环应用。
(6)25℃时pH=3的溶液中,Fe3+浓度的最大值为c(Fe3+)=_____ mol·L-1。
 。某同学在实验室以该废水为原料制备金属M的工艺流程如下:
。某同学在实验室以该废水为原料制备金属M的工艺流程如下:
| 氢氧化物 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 7.5 | 2.7 | 7.7 | 7.6 | 8.3 |
| 完全沉淀的pH | 7.5 | 3.7 | 8.4 | 8.2 | 9.8 |
回答下列问题:
(1)常温下,该废水的pH
(2)“氧化”时反应的离子方程式为
(3)“调pH”时,若所得滤渣1为少量MnO2和另一种氢氧化物,应控制溶液pH的调节范围是
(4)“除钴镍”时,发生的反应为
 等。反应完全后的滤液中Mn2+与Ni2+的物质的量浓度之比是
等。反应完全后的滤液中Mn2+与Ni2+的物质的量浓度之比是(5)“电解”时,阳极电极反应式为
(6)25℃时pH=3的溶液中,Fe3+浓度的最大值为c(Fe3+)=
您最近一年使用:0次
名校
解题方法
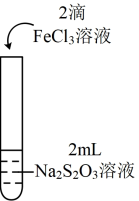
9 . 某小组为探究含硫化合物(NH4)2S2O8的性质,设计如下实验探究(NH4)2S2O8的氧化性。实验操作:向小试管中加入2mL0.2mol/LKI溶液,并滴入两滴淀粉溶液,无明显变化,再加入少量0.2mol/L(NH4)2S2O8溶液,试管中溶液立即变蓝。取上层清液检验,证明溶液中存在 。
。
(1)(NH4)2S2O8与KI反应的离子方程式为___________ 。
已知:I2可与S2O 发生反应:2S2O
发生反应:2S2O +I2=S4O
+I2=S4O +2I-。为了进一步探究S2O
+2I-。为了进一步探究S2O 与KI的反应速率,小组同学设计下表实验:
与KI的反应速率,小组同学设计下表实验:
(2)上述实验Ⅱ中的V1=___________ ;V2=___________ 。
加入Na2S2O3溶液后溶液变蓝的时间明显增长,小组同学对此提出两种猜想:
猜想1:(NH4)2S2O8与KI反应的速率远低于I2与Na2S2O3反应的速率;
猜想2:(NH4)2S2O8先与Na2S2O3反应,Na2S2O3消耗完后才与I-反应。
为验证上述猜想,小组同学补充下表实验:
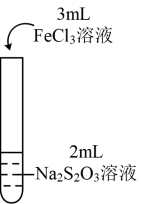
(3)验证猜想1的实验设计为___________ (填“实验Ⅲ”或“实验Ⅳ”下同)。
(4)实验Ⅲ中下层溶液显浅紫色的原因为___________ 。
(5)由上述实验可知___________ (填“猜想1”或“猜想2”)成立。
 。
。(1)(NH4)2S2O8与KI反应的离子方程式为
已知:I2可与S2O
 发生反应:2S2O
发生反应:2S2O +I2=S4O
+I2=S4O +2I-。为了进一步探究S2O
+2I-。为了进一步探究S2O 与KI的反应速率,小组同学设计下表实验:
与KI的反应速率,小组同学设计下表实验:| 试验编号 | 0.2mol/LKI溶液/mL | 0.01mol/LNa2S2O3溶液/mL | 蒸馏水/mL | 0.4%的淀粉溶液/滴 | 0.2mol/L(NH4)2S2O8溶液/mL | 变色时间/s |
| Ⅰ | 4.0 | 0 | 4.0 | 2 | 2.0 | 立即 |
| Ⅱ | 4.0 | 1.0 | V1 | 2 | V2 | 30 |
加入Na2S2O3溶液后溶液变蓝的时间明显增长,小组同学对此提出两种猜想:
猜想1:(NH4)2S2O8与KI反应的速率远低于I2与Na2S2O3反应的速率;
猜想2:(NH4)2S2O8先与Na2S2O3反应,Na2S2O3消耗完后才与I-反应。
为验证上述猜想,小组同学补充下表实验:
| 试验编号 | 0.2mol/LKI溶液/mL | 0.001mol/L碘水/mL | 0.01mol/LNa2S2O3溶液/mL | CCl4/mL | 0.4%的淀粉溶液/滴 | 0.2mol/L(NH4)2S2O8溶液/mL | 实验现象 |
| Ⅲ | 2 | 0 | 20 | 10 | 0 | 0.2 | 下层溶液显浅紫色 |
| Ⅳ | 0 | 5 | 20 | 0 | 2 | 20 | 溶液先变蓝,后迅速褪色,一段时间后又变蓝 |
(4)实验Ⅲ中下层溶液显浅紫色的原因为
(5)由上述实验可知
您最近一年使用:0次
解题方法
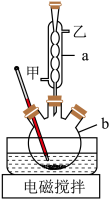
10 . 苯甲酸可用于合成纤维、树脂涂料等,也可作为药物或防腐制,有抑制真菌、细菌生长的作用。实验室利用高锰酸钾溶液氧化甲苯制备苯甲酸,实验装置如图所示:
对反应混合物进行分离提纯的流程如下:

已知:甲苯的沸点是110.6℃,苯的沸点约为80℃;苯甲酸微溶于冷水,易溶于热水。
请回答下列问题:
(1)仪器a的名称为_______ ,冷凝水从_______ 口流出(填“甲”或“乙”)。
(2)在三颈烧瓶中加入一定量的甲苯、水和稍过量高锰酸钾固体,通入冷凝水,维持反应温度90℃,开启电磁搅拌器,加热回流至回流液不再出现油珠。
①“回流液不再出现油珠”说明_______ 。
②已知反应过程中甲苯被氧化为苯甲酸钾,该反应的化学方程式为_______ 。
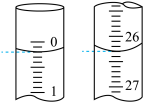
(3)为测定所得产品的纯度,称取1.220g粗产品,配成100mL溶液,取其中25.00mL溶液用0.080mol·L-1KOH溶液进行滴定。
第一次滴定开始和结束时,碱式滴定管中的液面如图所示。重复实验2次,测得所用KOH溶液的体积分别为26.08mL、26.12mL,则该粗产品中苯甲酸的质量分数为_______ %。

对反应混合物进行分离提纯的流程如下:

已知:甲苯的沸点是110.6℃,苯的沸点约为80℃;苯甲酸微溶于冷水,易溶于热水。
请回答下列问题:
(1)仪器a的名称为
(2)在三颈烧瓶中加入一定量的甲苯、水和稍过量高锰酸钾固体,通入冷凝水,维持反应温度90℃,开启电磁搅拌器,加热回流至回流液不再出现油珠。
①“回流液不再出现油珠”说明
②已知反应过程中甲苯被氧化为苯甲酸钾,该反应的化学方程式为
(3)为测定所得产品的纯度,称取1.220g粗产品,配成100mL溶液,取其中25.00mL溶液用0.080mol·L-1KOH溶液进行滴定。
第一次滴定开始和结束时,碱式滴定管中的液面如图所示。重复实验2次,测得所用KOH溶液的体积分别为26.08mL、26.12mL,则该粗产品中苯甲酸的质量分数为

您最近一年使用:0次