名校
解题方法
1 . 如图是硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁的生产流程示意图:

请回答下列问题:
(1)酸浸时,将硫铁矿烧渣粉碎的原因是___________ 。
(2)酸浸、过滤后滤液A中的金属阳离子是___________ 。
(3)煅烧FeCO3生成产品I的化学方程式为___________ 。
(4)产品Ⅱ的化学式为___________ 。
(5)写出步骤Ⅳ反应的离子方程式___________ 。

请回答下列问题:
(1)酸浸时,将硫铁矿烧渣粉碎的原因是
(2)酸浸、过滤后滤液A中的金属阳离子是
(3)煅烧FeCO3生成产品I的化学方程式为
(4)产品Ⅱ的化学式为
(5)写出步骤Ⅳ反应的离子方程式
您最近一年使用:0次
11-12高三·宁夏银川·阶段练习
解题方法
2 . HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+.AgNO2是一种难溶于水、易溶于酸的化合物.试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+.若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为 Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是____________ (填序号)。
A.亚硝酸盐被还原
B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+
D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是____________ (填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI-淀粉溶液来区别
D. 用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:____________________ 。
(4)Fe与过量稀硫酸反应可以制取FeSO4.若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是___________ (填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2:1,试配平下列方程式:
FeSO4+ K2O2→ K2FeO4+ K2O+ K2SO4+ O2↑
__________________________________
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体.高铁酸钾作为水处理剂发挥的作用是______________________ 。
(1)人体正常的血红蛋白含有Fe2+.若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为 Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是
A.亚硝酸盐被还原
B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+
D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI-淀粉溶液来区别
D. 用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:
(4)Fe与过量稀硫酸反应可以制取FeSO4.若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2:1,试配平下列方程式:
FeSO4+ K2O2→ K2FeO4+ K2O+ K2SO4+ O2↑
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体.高铁酸钾作为水处理剂发挥的作用是
您最近一年使用:0次
2016-12-09更新
|
287次组卷
|
6卷引用:2013届宁夏银川一中高三第一次月考理综化学试卷
(已下线)2013届宁夏银川一中高三第一次月考理综化学试卷(已下线)2013届吉林省榆树市第一高级中学高三第一次月考化学试卷2016届四川省宜宾三中高三上学期第一次月考化学试卷12016届福建省福州市第一中学高三上学期期中测试化学试卷2016届四川省宜宾三中高三上学期第一次月考化学试卷2黑龙江省佳木斯学校(佳木斯市实验中学)2021-2022学年高三上学期第二次月考化学试题
名校
3 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及氧化物 、
、 ,还有少量其他不溶于酸溶液和碱溶液的物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体
,还有少量其他不溶于酸溶液和碱溶液的物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体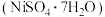 :
:
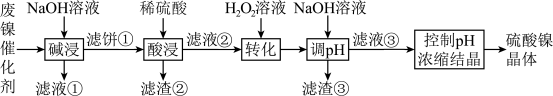
室温下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“碱浸”时需要充分搅拌,其目的是________ 。
(2)“碱浸”中NaOH的作用除去除催化剂表面的油脂外,还与催化剂中Al和 反应生成
反应生成________ (填物质的化学式),使Al元素进入“滤液①”。
(3)“滤液②”中主要含有金属离子“ ”和“
”和“ ”,则“转化”中加入
”,则“转化”中加入 的主要作用是
的主要作用是________ (用离子方程式表示)。
(4)写出 的溶度积常数的表达式
的溶度积常数的表达式
________ ,利用上述表格数据,计算 的溶度积常数
的溶度积常数
________ (列出计算式即可,不用化简)。如果“转化”后的溶液中 浓度为
浓度为 ,则“调pH”应控制pH不超过
,则“调pH”应控制pH不超过________ (填数值)。
 、
、 ,还有少量其他不溶于酸溶液和碱溶液的物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体
,还有少量其他不溶于酸溶液和碱溶液的物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体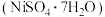 :
:
室温下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 |
|
|
|
|
开始沉淀时 | 7 | 4 | 2 | 8 |
沉淀完全时 | 9 | 5 | 3 | 9 |
(1)“碱浸”时需要充分搅拌,其目的是
(2)“碱浸”中NaOH的作用除去除催化剂表面的油脂外,还与催化剂中Al和
 反应生成
反应生成(3)“滤液②”中主要含有金属离子“
 ”和“
”和“ ”,则“转化”中加入
”,则“转化”中加入 的主要作用是
的主要作用是(4)写出
 的溶度积常数的表达式
的溶度积常数的表达式
 的溶度积常数
的溶度积常数
 浓度为
浓度为 ,则“调pH”应控制pH不超过
,则“调pH”应控制pH不超过
您最近一年使用:0次
名校
4 . 氧化还原反应在工农业生产、日常生活中具有广泛用途,下图物质转化中实现了循环,减少了有害物质向环境的排放,回答下列问题。
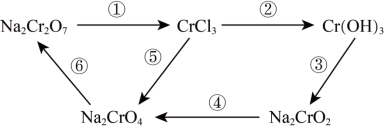
(1)Na2Cr2O7中Cr元素的化合价是______ 。
(2)浓HCl能实现反应①的转化,在浓HCl和Na2Cr2O7的反应中,Na2Cr2O7发生______ 反应(填“氧化”或“还原”),该反应有黄绿色气体生成,写出反应的化学方程式:______ 。
(3)反应④在碱性条件下发生,反应的离子方程式为: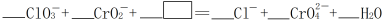 ,请将
,请将 所缺的物质补充完整并配平方程式
所缺的物质补充完整并配平方程式______ 。

(1)Na2Cr2O7中Cr元素的化合价是
(2)浓HCl能实现反应①的转化,在浓HCl和Na2Cr2O7的反应中,Na2Cr2O7发生
(3)反应④在碱性条件下发生,反应的离子方程式为:
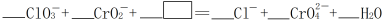 ,请将
,请将 所缺的物质补充完整并配平方程式
所缺的物质补充完整并配平方程式
您最近一年使用:0次
名校
5 . 钯(Pd)是一种贵金属,性质类似铂(Pt)。活性炭载钯催化剂广泛应用于石油化工、制药等工业,但使用过程中因生成难溶于酸的PdO而失活。一种从废钯催化剂(杂质主要含有机物、活性炭、及少量Fe、Cu、Al等元素)中回收海绵钯的工艺流程如图:

已知:
Ⅰ.阴、阳离子交换树脂的基本工作原理分别为 、
、 (
( 表示树脂的有机成分)。
表示树脂的有机成分)。
Ⅱ.“沉钯”时得到氯钯酸铵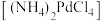 固体,不溶于冷水,可溶于稀盐酸。
固体,不溶于冷水,可溶于稀盐酸。
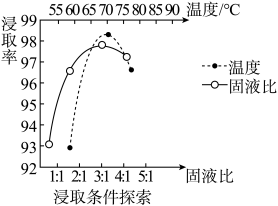
(1)温度、固液比对浸取率的影响如图,则“浸取”的最佳条件为___________ 。
(2)“浸取”时,加入试剂A的目的为___________ 。
(3)“浸取”时,加入 有利于Pd的溶解,生成的四氯合钯(Ⅱ)酸(
有利于Pd的溶解,生成的四氯合钯(Ⅱ)酸( )为二元强酸。加入浓盐酸和
)为二元强酸。加入浓盐酸和 后主要反应的离子方程式:
后主要反应的离子方程式:___________ 。
(4)“离子交换除杂”应使用___________ (填“阳离子”或“阴离子”)树脂,“洗脱”时应使用的洗脱液为___________ (填标号)。
A.硫酸 B.盐酸 C.无水乙醇
(5)“还原”过程 转化为
转化为 ,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为
,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为___________ ,且该产物可循环利用至___________ 环节(填环节名称)。

已知:
Ⅰ.阴、阳离子交换树脂的基本工作原理分别为
 、
、 (
( 表示树脂的有机成分)。
表示树脂的有机成分)。Ⅱ.“沉钯”时得到氯钯酸铵
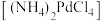 固体,不溶于冷水,可溶于稀盐酸。
固体,不溶于冷水,可溶于稀盐酸。(1)温度、固液比对浸取率的影响如图,则“浸取”的最佳条件为

(2)“浸取”时,加入试剂A的目的为
(3)“浸取”时,加入
 有利于Pd的溶解,生成的四氯合钯(Ⅱ)酸(
有利于Pd的溶解,生成的四氯合钯(Ⅱ)酸( )为二元强酸。加入浓盐酸和
)为二元强酸。加入浓盐酸和 后主要反应的离子方程式:
后主要反应的离子方程式:(4)“离子交换除杂”应使用
A.硫酸 B.盐酸 C.无水乙醇
(5)“还原”过程
 转化为
转化为 ,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为
,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为
您最近一年使用:0次
名校
6 . Ⅰ、(1)在Fe(OH)3胶体中逐渐滴入HI稀溶液,会出现一系列变化。
①先出现红褐色沉淀,原因是_________________________________________ 。
②随后沉淀溶解,溶液呈黄色,此反应的离子方程式是________________________ 。
③最后溶液颜色加深,此反应的离子方程式是________________________________ 。
(2)若用稀盐酸代替HI稀溶液,能出现(1)中所述变化现象中的____ (填写上面各题序号)。
Ⅱ、某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2―→O2。
(1)该反应中,发生还原反应的过程是____________ ―→______________ 。
(2)写出该反应的化学方程式,并标出电子转移的方向和数目。
__________________________________________________________ 。
(3)如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为______ 。
①先出现红褐色沉淀,原因是
②随后沉淀溶解,溶液呈黄色,此反应的离子方程式是
③最后溶液颜色加深,此反应的离子方程式是
(2)若用稀盐酸代替HI稀溶液,能出现(1)中所述变化现象中的
Ⅱ、某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2―→O2。
(1)该反应中,发生还原反应的过程是
(2)写出该反应的化学方程式,并标出电子转移的方向和数目。
(3)如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为
您最近一年使用:0次
19-20高三上·宁夏吴忠·阶段练习
名校
7 . 以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用 硫酸渣制备铁红(Fe2O3)的过程如下:
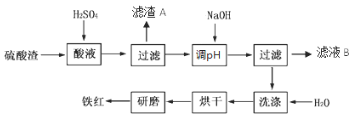
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为_________________ ;“滤渣A”主要成分的化学式为______________ 。
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2 +,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+ 14Fe3++____ H2O== 15Fe2++2 SO42-+____ _____
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为____________________ 。
(4)氧化过程中能否用硝酸代替空气________________ (用能或否填空)为什么?__________
(5)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是_____________ (几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式)_______________ 。
(6)如何验证已经洗涤干净____________________________________________________ 。

(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2 +,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+ 14Fe3++
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为
(4)氧化过程中能否用硝酸代替空气
(5)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是
| 沉淀物 | Fe(OH)3 | A1(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
(6)如何验证已经洗涤干净
您最近一年使用:0次
8 . “低碳循环”引起各国的高度重视,而如何降低大气中 的含量及有效地开发利用
的含量及有效地开发利用 ,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ 
___ 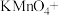
_____ 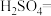
_____ 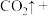
____  +
+___  +
+___ 
(2)将不同量的 (g)和
(g)和 (g)分别通入到体积为 2L的恒容密闭容器中,进行反应
(g)分别通入到体积为 2L的恒容密闭容器中,进行反应
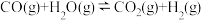 ,得到如下二组数据:
,得到如下二组数据:
①实验1中以 表示的反应速率为
表示的反应速率为________ (保留二位小数,下同)。
②实验2条件下平衡常数K=__________ ,该反应为_________ (填“吸”或“放”)热反应。
(3)已知在常温常压下:
①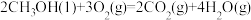
 kJ/mol
kJ/mol
②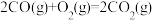
 kJ/mol
kJ/mol
③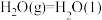
 kJ/mol
kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式______________
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
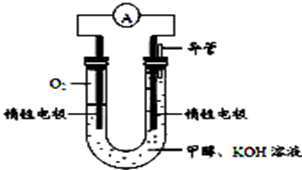
①该电池正极的电极反应为_____________ 。
②该电池工作时,溶液中的 向
向____________ 极移动。
 的含量及有效地开发利用
的含量及有效地开发利用 ,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:

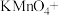
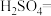
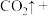
 +
+ +
+
(2)将不同量的
 (g)和
(g)和 (g)分别通入到体积为 2L的恒容密闭容器中,进行反应
(g)分别通入到体积为 2L的恒容密闭容器中,进行反应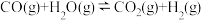 ,得到如下二组数据:
,得到如下二组数据:| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
 |  |  |  | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1中以
 表示的反应速率为
表示的反应速率为②实验2条件下平衡常数K=
(3)已知在常温常压下:
①
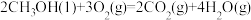
 kJ/mol
kJ/mol②
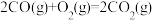
 kJ/mol
kJ/mol③
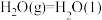
 kJ/mol
kJ/mol写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。

①该电池正极的电极反应为
②该电池工作时,溶液中的
 向
向
您最近一年使用:0次
解题方法
9 . 如图所示:丁可能是强酸也可能是强碱。

(1)若丙是潜艇的供氧剂,请写出甲与水反应的离子方程式_________________ ;若等物质的量的甲,乙,丙,丁的固体投入到足量且等量的水中完全反应所得溶液的质量分数由大到小的顺序是_______ (用化学式表示)。
(2)若乙是能使品红溶液褪色的气体,请写出乙→丙的化学反应方程式______________ ;请写出乙可使氯水褪色的离子方程式__________________________ .
(3)若甲可作为制冷剂,请写出甲→乙的化学反应方程式__________________________ ;将等量的铜粉分别与过量浓的丁溶液、稀的丁溶液反应,消耗丁的物质的量:前者______ 后者,反应中转移的电子总数:前者______ 后者(填“>”、“=”或“<”)

(1)若丙是潜艇的供氧剂,请写出甲与水反应的离子方程式
(2)若乙是能使品红溶液褪色的气体,请写出乙→丙的化学反应方程式
(3)若甲可作为制冷剂,请写出甲→乙的化学反应方程式
您最近一年使用:0次



 的pH
的pH 的pH
的pH

