名校
解题方法
1 . 砷化镓是一种半导体化合物,可用于太阳能电池。一种砷化镓废料(主要成分为GaAs,含 、
、 、
、 等杂质)中回收单质镓和砷的化合物的工艺流程如图所示。
等杂质)中回收单质镓和砷的化合物的工艺流程如图所示。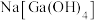 的形式进入溶液。
的形式进入溶液。
②离子完全沉淀时的pH: 为8,
为8, 为5.6。
为5.6。
(1)第一电离能比较:As________ Ga(填“<”“>”或“=”,下同),原子半径比较:As________ Ga。
(2)下图为砷化镓晶胞,白球所代表原子的配位数是________ 。已知:晶胞参数为apm,密度为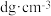 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为________ (用含a、d的式子表示)。________ 。
(4)“调pH①”时,pH=________ 最合适;滤液②的溶质成分为________ (写化学式)。
(5)写出用惰性电极电解制备镓单质的电极反应方程式:________ 。
 、
、 、
、 等杂质)中回收单质镓和砷的化合物的工艺流程如图所示。
等杂质)中回收单质镓和砷的化合物的工艺流程如图所示。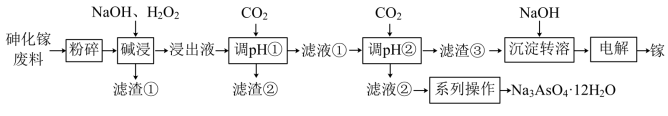
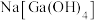 的形式进入溶液。
的形式进入溶液。②离子完全沉淀时的pH:
 为8,
为8, 为5.6。
为5.6。(1)第一电离能比较:As
(2)下图为砷化镓晶胞,白球所代表原子的配位数是
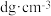 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为
(4)“调pH①”时,pH=
(5)写出用惰性电极电解制备镓单质的电极反应方程式:
您最近一年使用:0次
2024-03-25更新
|
123次组卷
|
2卷引用:重庆市渝西中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
2 . 某化学实验小组在实验室中模拟制取 的实验装置如图所示(略去夹持仪器):
的实验装置如图所示(略去夹持仪器):

实验原理如下:
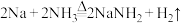


已知: 易潮解和易氧化。
易潮解和易氧化。
请回答下列问题:
(1)仪器D的名称是______ ,F中盛放浓硫酸的作用是______ 。
(2)制备 时,打开
时,打开 、
、 ,首先加热的是
,首先加热的是______ (填“C”或“E”),按图示方法制备 的化学方程式为
的化学方程式为______ 。
(3)实验时G中生成沉淀 ,反应的化学方程式为
,反应的化学方程式为______ 。
(4)将制取的 冷却,先加
冷却,先加 溶解,再加入乙醇,经过滤,洗涤,干燥得产品。用乙醇洗涤的原因是
溶解,再加入乙醇,经过滤,洗涤,干燥得产品。用乙醇洗涤的原因是______ 。
(5)称取2.0g产品,配制成100mL溶液,取10.00mL溶液于锥形瓶中,加入0.1mol/L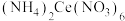 溶液40.00mL,充分反应后,再用0.1mol/L
溶液40.00mL,充分反应后,再用0.1mol/L 标准溶液滴定过量的
标准溶液滴定过量的 ,终点时消耗标准溶液10.00mL。相关反应如下(假设杂质不参与反应):
,终点时消耗标准溶液10.00mL。相关反应如下(假设杂质不参与反应):
第一步: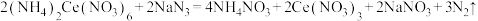
第二步:
①若滴加 标准溶液至终点时,滴定管玻璃尖嘴部分有气泡,则产品纯度
标准溶液至终点时,滴定管玻璃尖嘴部分有气泡,则产品纯度______ (填“偏大”或“偏小”)
②若2.0g该产品完全发生第一步反应时,转移的电子的物质的量为______ 。
 的实验装置如图所示(略去夹持仪器):
的实验装置如图所示(略去夹持仪器):
实验原理如下:
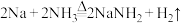


已知:
 易潮解和易氧化。
易潮解和易氧化。请回答下列问题:
(1)仪器D的名称是
(2)制备
 时,打开
时,打开 、
、 ,首先加热的是
,首先加热的是 的化学方程式为
的化学方程式为(3)实验时G中生成沉淀
 ,反应的化学方程式为
,反应的化学方程式为(4)将制取的
 冷却,先加
冷却,先加 溶解,再加入乙醇,经过滤,洗涤,干燥得产品。用乙醇洗涤的原因是
溶解,再加入乙醇,经过滤,洗涤,干燥得产品。用乙醇洗涤的原因是(5)称取2.0g产品,配制成100mL溶液,取10.00mL溶液于锥形瓶中,加入0.1mol/L
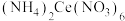 溶液40.00mL,充分反应后,再用0.1mol/L
溶液40.00mL,充分反应后,再用0.1mol/L 标准溶液滴定过量的
标准溶液滴定过量的 ,终点时消耗标准溶液10.00mL。相关反应如下(假设杂质不参与反应):
,终点时消耗标准溶液10.00mL。相关反应如下(假设杂质不参与反应):第一步:
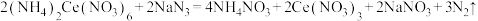
第二步:

①若滴加
 标准溶液至终点时,滴定管玻璃尖嘴部分有气泡,则产品纯度
标准溶液至终点时,滴定管玻璃尖嘴部分有气泡,则产品纯度②若2.0g该产品完全发生第一步反应时,转移的电子的物质的量为
您最近一年使用:0次
名校
解题方法
3 . 在生活中亚硝酸钠 应用十分广泛,它是一种白色固体,外观与
应用十分广泛,它是一种白色固体,外观与 极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知
极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。

已知:① 能被高锰酸钾氧化,但不能被浓硫酸氧化。
能被高锰酸钾氧化,但不能被浓硫酸氧化。
②酸性高锰酸钾溶液可将 氧化成
氧化成 。
。
回答下列问题:
I. 的制备:
的制备:
(1)装置A中的仪器名称分别是___________ ,仪器按气流方向连接顺序为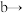
___________
(2)反应开始前打开止水夹a,通入过量氮气的目的是___________ ;反应结束后打开止水夹a,再通入过量氮气的目的是___________ 。
(3)装置D的作用是___________ 。
(4)判断Na2O2已被NO反应完全的现象是___________ 。
(5)写出装置E中发生反应的离子反应方程式______________________ 。
Ⅱ.测定的纯度(假设杂质不与反应):
(6)准确称取反应后的固体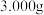 于烧杯中,加入蒸馏水溶解,配成
于烧杯中,加入蒸馏水溶解,配成 的溶液;取出
的溶液;取出 的溶液于锥形瓶中,滴入
的溶液于锥形瓶中,滴入 的酸性
的酸性 溶液至恰好完全反应,用去
溶液至恰好完全反应,用去 的酸性
的酸性 溶液。固体中
溶液。固体中 的纯度为
的纯度为___________  。
。
 应用十分广泛,它是一种白色固体,外观与
应用十分广泛,它是一种白色固体,外观与 极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知
极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
已知:①
 能被高锰酸钾氧化,但不能被浓硫酸氧化。
能被高锰酸钾氧化,但不能被浓硫酸氧化。②酸性高锰酸钾溶液可将
 氧化成
氧化成 。
。回答下列问题:
I.
 的制备:
的制备:(1)装置A中的仪器名称分别是
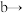
(2)反应开始前打开止水夹a,通入过量氮气的目的是
(3)装置D的作用是
(4)判断Na2O2已被NO反应完全的现象是
(5)写出装置E中发生反应的离子反应方程式
Ⅱ.测定的纯度(假设杂质不与反应):
(6)准确称取反应后的固体
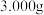 于烧杯中,加入蒸馏水溶解,配成
于烧杯中,加入蒸馏水溶解,配成 的溶液;取出
的溶液;取出 的溶液于锥形瓶中,滴入
的溶液于锥形瓶中,滴入 的酸性
的酸性 溶液至恰好完全反应,用去
溶液至恰好完全反应,用去 的酸性
的酸性 溶液。固体中
溶液。固体中 的纯度为
的纯度为 。
。
您最近一年使用:0次
名校
4 . 人类农业生产离不开氮肥,科学合理使用氰肥,不仅能提高化肥的使用率,而且能够更好地保护环境,请回答下列问题:
(1)某小组在实验室模拟以 为原料,制备少量硝态氮肥
为原料,制备少量硝态氮肥 ,转化途径如下(转化所需试剂及条件已略去)。
,转化途径如下(转化所需试剂及条件已略去)。
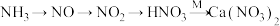
①工业合成氨是制取氮肥的基础。写出工业合成氨的化学反应方程式___________ 。
②写出实验室用NH4Cl和消石灰共热制备氨气的化学反应方程式_________________ 。
③写出NH3发生催化氧化反应生成NO的化学方程式____________________________ 。
向装置中通入4molNH3和2molO2,转移的电子数___________ (大于/小于/等于)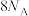 。
。
④工业上为了提高NO的转化率,可以适当增加O2的量,理论上在一定的温度和压强下将2LNO完全转化成HNO3,至少应该通入空气的体积为___________ 。
⑤将HNO3转化为Ca(NO3)2,列举两种不同类别的化合物M___________ (写化学式)。
(2)下列关于氮肥的使用说法正确的是___________。
(1)某小组在实验室模拟以
 为原料,制备少量硝态氮肥
为原料,制备少量硝态氮肥 ,转化途径如下(转化所需试剂及条件已略去)。
,转化途径如下(转化所需试剂及条件已略去)。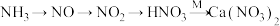
①工业合成氨是制取氮肥的基础。写出工业合成氨的化学反应方程式
②写出实验室用NH4Cl和消石灰共热制备氨气的化学反应方程式
③写出NH3发生催化氧化反应生成NO的化学方程式
向装置中通入4molNH3和2molO2,转移的电子数
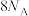 。
。④工业上为了提高NO的转化率,可以适当增加O2的量,理论上在一定的温度和压强下将2LNO完全转化成HNO3,至少应该通入空气的体积为
⑤将HNO3转化为Ca(NO3)2,列举两种不同类别的化合物M
(2)下列关于氮肥的使用说法正确的是___________。
| A.硝酸铵是一种常用的氮肥,在贮存和使用该化肥时不能剧烈撞击 |
| B.过度使用氮肥不会引起土壤和水体污染 |
| C.铵态氮肥和草木灰混合使用可以增强肥效 |
| D.铵态氮肥易与空气反应,因此需要深埋土壤中施用 |
您最近一年使用:0次
名校
解题方法
5 . 工业上用赤铁矿(主要含Fe2O3、FeO,还含有少量的Al2O3、CuO等杂质)制备绿矾(FeSO4•7H2O)的流程如图:

(1)赤铁矿中加入NaOH溶液发生反应的离子方程式为______ 。
(2)试剂a为_____ (填化学式),试剂b为_____ (填化学式),“溶液I”中氧化性最强的阳离子为______ (填化学式)。
(3)操作②需要使用到的玻璃仪器有_______ 。
(4)另取2mL“滤液II”加入试管中,并向该溶液中滴入稀H2SO4酸化的H2O2溶液,观察到溶液由浅绿色变成棕黄色,请写出该反应的离子方程式______ 。
(5)操作③需要隔绝空气的主要原因是______ 。
(6)8.34gFeSO4•7H2O(M=278g•mol-1)样品受热分解过程中样品质量随温度变化的曲线如图所示:

请回答下列问题
①温度为78℃时,固体物质M的化学式为______ 。
②取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种常见硫的氧化物生成,写出由P生成Q的化学方程式_______ 。

(1)赤铁矿中加入NaOH溶液发生反应的离子方程式为
(2)试剂a为
(3)操作②需要使用到的玻璃仪器有
(4)另取2mL“滤液II”加入试管中,并向该溶液中滴入稀H2SO4酸化的H2O2溶液,观察到溶液由浅绿色变成棕黄色,请写出该反应的离子方程式
(5)操作③需要隔绝空气的主要原因是
(6)8.34gFeSO4•7H2O(M=278g•mol-1)样品受热分解过程中样品质量随温度变化的曲线如图所示:

请回答下列问题
①温度为78℃时,固体物质M的化学式为
②取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种常见硫的氧化物生成,写出由P生成Q的化学方程式
您最近一年使用:0次
名校
解题方法
6 . 亚氯酸钠(NaClO2)是一种高效漂白剂,在酸性条件下生成NaCl并放出ClO2气体,ClO2有类似Cl2的性质。某化学兴趣小组探究NaClO2的制备与性质,装置如图所示。

请回答下列问题:
I.制备亚氯酸钠。
关闭止水夹②,打开止水夹①,从进气口通入足量ClO2,充分反应(该反应放出大量的热)。
(1)仪器a的名称为______ ,仪器b的作用是______ 。
(2)装置A中生成NaClO2,反应的离子方程式为______ 。
(3)实际反应中发现消耗的NaOH比理论值偏少,原因可能是______ 。
Ⅱ.探究亚氯酸钠的性质。
停止通入ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
(4)已知:催化剂会加快反应的进行。A中反应开始时很缓慢,稍后产生气体的速率急剧加快。反应急剧加快的可能原因是______ 。
(5)实验过程中,B中酸化的KI淀粉溶液变蓝色,产生该现象的离子方程式为______ 。
(6)NaClO2和Cl2消毒时,还原产物均为Cl-。消毒剂的消毒效率可用单位质量消毒剂被还原时得电子数表示,计算NaClO2的消毒效率是Cl2的______ 倍(计算结果保留一位小数)。

请回答下列问题:
I.制备亚氯酸钠。
关闭止水夹②,打开止水夹①,从进气口通入足量ClO2,充分反应(该反应放出大量的热)。
(1)仪器a的名称为
(2)装置A中生成NaClO2,反应的离子方程式为
(3)实际反应中发现消耗的NaOH比理论值偏少,原因可能是
Ⅱ.探究亚氯酸钠的性质。
停止通入ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
(4)已知:催化剂会加快反应的进行。A中反应开始时很缓慢,稍后产生气体的速率急剧加快。反应急剧加快的可能原因是
(5)实验过程中,B中酸化的KI淀粉溶液变蓝色,产生该现象的离子方程式为
(6)NaClO2和Cl2消毒时,还原产物均为Cl-。消毒剂的消毒效率可用单位质量消毒剂被还原时得电子数表示,计算NaClO2的消毒效率是Cl2的
您最近一年使用:0次
名校
解题方法
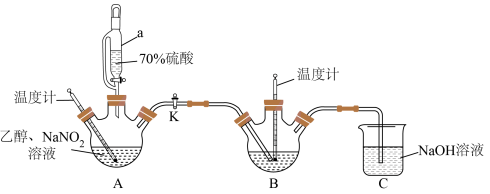
7 . 叠氮化钠( )为无色六角结晶性粉末,主要用于制造炸药、安全气囊。某化学探究小组拟在实验室中利用如图装置制取叠氮化钠。
)为无色六角结晶性粉末,主要用于制造炸药、安全气囊。某化学探究小组拟在实验室中利用如图装置制取叠氮化钠。
I.实验操作:
①向装置A的三颈烧瓶中加入乙醇20g、亚硝酸钠40g、水60g后,混合均匀;
②将装置A的三颈烧瓶中的混合液体加热到35℃左右,控制滴入70%硫酸的速率;
③在装置B的三颈烧瓶中预装由水合肼( )、NaOH溶液、乙醇和催化剂组成的混合液,打开活塞K,使装置A中产生的亚硝酸乙酯(
)、NaOH溶液、乙醇和催化剂组成的混合液,打开活塞K,使装置A中产生的亚硝酸乙酯(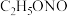 )进入装置B中,控制温度在80℃左右,持续加热40min。
)进入装置B中,控制温度在80℃左右,持续加热40min。
Ⅱ.部分药品的性质如下表:
已知: 。
。
回答下列问题:
(1)仪器a的名称为_______ 。
(2)对装置B中液体进行加热,合适的加热方式为_______ 。
(3)装置A保持温度35℃左右的原因是_______ 。
(4)装置B中水合肼、亚硝酸乙酯和氢氧化钠在80℃左右反应生成叠氮化钠、乙醇等物质,该反应的化学方程式为_______ 。
(5)产品的分离:将装置B中反应后的混合液倒入蒸馏烧瓶中,加热到80~90℃,除去混合物中的乙醇。将蒸馏后所得母液通过_______ (一系列的实验操作)得到叠氮化钠产品。叠氮化钠在不同温度及溶剂中的溶解度如图所示。

(6)叠氮化钠有毒,可以使用次氯酸钠溶液销毁容器中残留的叠氮化钠,反应后碱性明显增强,产生无色无味的无毒气体,写出离子方程式:_______ 。
(7)产品纯度测定:取6.0g产品,加入足量蒸馏水溶解,向溶液中加入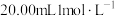 酸化的
酸化的 溶液(
溶液( ),反应后溶液呈紫红色。再用
),反应后溶液呈紫红色。再用 的
的 标准液滴定过量的
标准液滴定过量的 溶液,到达滴定终点时消耗标准液25.00mL
溶液,到达滴定终点时消耗标准液25.00mL
①叠氮化钠的纯度为_______ 。(保留小数点后1位)
②若用 标准液滴定时,开始时尖嘴处充满溶液,结束时出现气泡,其他操作及读数均正确,则测得样品中叠氮化钠的纯度
标准液滴定时,开始时尖嘴处充满溶液,结束时出现气泡,其他操作及读数均正确,则测得样品中叠氮化钠的纯度_______ (填“偏大”“偏小”或“无影响)。
 )为无色六角结晶性粉末,主要用于制造炸药、安全气囊。某化学探究小组拟在实验室中利用如图装置制取叠氮化钠。
)为无色六角结晶性粉末,主要用于制造炸药、安全气囊。某化学探究小组拟在实验室中利用如图装置制取叠氮化钠。
I.实验操作:
①向装置A的三颈烧瓶中加入乙醇20g、亚硝酸钠40g、水60g后,混合均匀;
②将装置A的三颈烧瓶中的混合液体加热到35℃左右,控制滴入70%硫酸的速率;
③在装置B的三颈烧瓶中预装由水合肼(
 )、NaOH溶液、乙醇和催化剂组成的混合液,打开活塞K,使装置A中产生的亚硝酸乙酯(
)、NaOH溶液、乙醇和催化剂组成的混合液,打开活塞K,使装置A中产生的亚硝酸乙酯(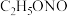 )进入装置B中,控制温度在80℃左右,持续加热40min。
)进入装置B中,控制温度在80℃左右,持续加热40min。Ⅱ.部分药品的性质如下表:
| 物质 | 密度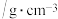 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 乙醇 | 0.816 | 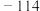 | 78.3 | 与水以任意比例互溶,可与醚、氯仿、丙酮混溶 |
| 亚硝酸乙酯 | 0.90 | 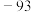 | 17.2 | 不溶于水,可溶于乙醇、乙醚 |
| 叠氮化钠 | 1.85 | 275 | 300 | 易溶于水和液氨,微溶于乙醇,不溶于乙醚 |
 。
。回答下列问题:
(1)仪器a的名称为
(2)对装置B中液体进行加热,合适的加热方式为
(3)装置A保持温度35℃左右的原因是
(4)装置B中水合肼、亚硝酸乙酯和氢氧化钠在80℃左右反应生成叠氮化钠、乙醇等物质,该反应的化学方程式为
(5)产品的分离:将装置B中反应后的混合液倒入蒸馏烧瓶中,加热到80~90℃,除去混合物中的乙醇。将蒸馏后所得母液通过

(6)叠氮化钠有毒,可以使用次氯酸钠溶液销毁容器中残留的叠氮化钠,反应后碱性明显增强,产生无色无味的无毒气体,写出离子方程式:
(7)产品纯度测定:取6.0g产品,加入足量蒸馏水溶解,向溶液中加入
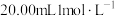 酸化的
酸化的 溶液(
溶液( ),反应后溶液呈紫红色。再用
),反应后溶液呈紫红色。再用 的
的 标准液滴定过量的
标准液滴定过量的 溶液,到达滴定终点时消耗标准液25.00mL
溶液,到达滴定终点时消耗标准液25.00mL①叠氮化钠的纯度为
②若用
 标准液滴定时,开始时尖嘴处充满溶液,结束时出现气泡,其他操作及读数均正确,则测得样品中叠氮化钠的纯度
标准液滴定时,开始时尖嘴处充满溶液,结束时出现气泡,其他操作及读数均正确,则测得样品中叠氮化钠的纯度
您最近一年使用:0次
名校
解题方法
8 .  和
和 锂离子电池的电极材料,可利用钛铁矿(主要成分为
锂离子电池的电极材料,可利用钛铁矿(主要成分为 ,还含有少量MgO、
,还含有少量MgO、 等杂质)来制备,工艺流程如图:
等杂质)来制备,工艺流程如图:
(1)化学上某些盐可写成氧化物的形式,如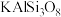 可写成
可写成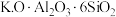 ,则
,则 可写成
可写成_______ 。
(2)“酸浸”后,钛主要以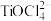 存在,写出相应反应的离子方程式:
存在,写出相应反应的离子方程式:_______ 。
(3) 中Ti的化合价为+4,
中Ti的化合价为+4,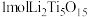 中含有过氧键的数目为
中含有过氧键的数目为_______ 。
(4) 与双氧水、氨水反应40min,控制温度在40℃左右,温度不能高于40℃的原因是
与双氧水、氨水反应40min,控制温度在40℃左右,温度不能高于40℃的原因是_______ 。
(5)向“滤液②”中加入双氧水和磷酸得到 ,写出离子方程式:
,写出离子方程式:_______ 。
(6)在“高温煅烧②”过程中,草酸的作用是_______ ,适当多加草酸的原因为_______ 。
(7)锂离子电池放电时, 由
由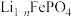 结合
结合 得到,在
得到,在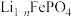 中,若
中,若 ,材料中
,材料中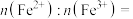
_______ 。
 和
和 锂离子电池的电极材料,可利用钛铁矿(主要成分为
锂离子电池的电极材料,可利用钛铁矿(主要成分为 ,还含有少量MgO、
,还含有少量MgO、 等杂质)来制备,工艺流程如图:
等杂质)来制备,工艺流程如图:
(1)化学上某些盐可写成氧化物的形式,如
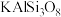 可写成
可写成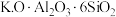 ,则
,则 可写成
可写成(2)“酸浸”后,钛主要以
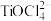 存在,写出相应反应的离子方程式:
存在,写出相应反应的离子方程式:(3)
 中Ti的化合价为+4,
中Ti的化合价为+4,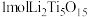 中含有过氧键的数目为
中含有过氧键的数目为(4)
 与双氧水、氨水反应40min,控制温度在40℃左右,温度不能高于40℃的原因是
与双氧水、氨水反应40min,控制温度在40℃左右,温度不能高于40℃的原因是(5)向“滤液②”中加入双氧水和磷酸得到
 ,写出离子方程式:
,写出离子方程式:(6)在“高温煅烧②”过程中,草酸的作用是
(7)锂离子电池放电时,
 由
由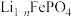 结合
结合 得到,在
得到,在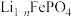 中,若
中,若 ,材料中
,材料中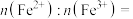
您最近一年使用:0次
名校
9 . 能正确表示下列反应的离子方程式是
A.将Na2O2固体投入H218O中: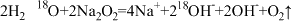 |
B.NaClO溶液中通入少量SO2: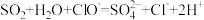 |
C.饱和Na2CO3溶液中通入过量CO2: |
D.四氧化三铁溶于稀硝酸中: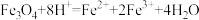 |
您最近一年使用:0次
2024-03-09更新
|
447次组卷
|
4卷引用:重庆市大足中学2023-2024学年高三下学期3月适应性考试化学试题
名校
解题方法
10 . 下列对应离子方程式的书写正确的是
A.将 (少量)通入 (少量)通入 溶液中: 溶液中: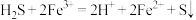 |
B.向 溶液中滴加稀氨水: 溶液中滴加稀氨水: |
C.向 溶液中滴加少量稀盐酸: 溶液中滴加少量稀盐酸: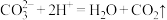 |
D.向 溶液中滴加少量澄清石灰水: 溶液中滴加少量澄清石灰水: |
您最近一年使用:0次
2024-03-08更新
|
188次组卷
|
5卷引用:重庆市璧山来凤中学等多校联考2023-2024学年高三下学期3月月考化学试题



