解答题-工业流程题
|
较难(0.4)
|
名校
1 . 草酸钴可用于指示剂和催化剂。一种利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO)制取CoC2O4·2H2O的工艺流程如图所示。
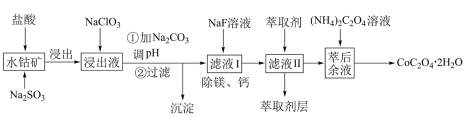
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+;
②常温下,Ksp(MgF2)=6.25×10-9,Ksp(CaF2)=2.25×10-11;
③部分阳离子的氢氧化物形式沉淀时溶液的pH见下表。
回答下列问题:
(1)CoC2O4·2H2O中C的价态为___________ ,Co2O3中Co的价层电子排布式为___________ 。
(2)浸出液中Fe2+与加入NaClO3发生反应的离子方程式为___________ 。
(3)加Na2CO3调节pH时,需要控制pH的范围是___________ ,沉淀1的主要成分有___________ (填化学式)。
(4)常温下,向滤液Ⅰ中加入NaF溶液除去Ca2+、Mg2+,当Ca2+沉淀完全时(离子浓度小于1.0×10-5mol/L即为该离子沉淀完全),Mg2+的浓度为___________ mol/L(保留到小数点后一位)。
(5)测定产品中草酸钴晶体的质量分数:称取草酸钴样品3.050g,用稀硫酸酸化,加入100.0mL0.1000mol/LKMnO4溶液,加热(该条件下Co2+不被氧化),充分反应后将溶液冷却至室温,将溶液完全转移到250mL容量瓶中定容。然后取25mL用0.2000mol/LFeSO4溶液进行滴定,到达滴定终点后,消耗18.00mLFeSO4溶液。
①若用盐酸酸化,则测得的草酸钴晶体的质量分数会___________ (填“偏大”“偏小”或“不变”)。
②计算样品中草酸钴晶体CoC2O4·2H2O的质量分数为___________ 。

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+;
②常温下,Ksp(MgF2)=6.25×10-9,Ksp(CaF2)=2.25×10-11;
③部分阳离子的氢氧化物形式沉淀时溶液的pH见下表。
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | A1(OH)3 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 4.0 | 7.6 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 5.2 | 9.2 | 9.8 |
(1)CoC2O4·2H2O中C的价态为
(2)浸出液中Fe2+与加入NaClO3发生反应的离子方程式为
(3)加Na2CO3调节pH时,需要控制pH的范围是
(4)常温下,向滤液Ⅰ中加入NaF溶液除去Ca2+、Mg2+,当Ca2+沉淀完全时(离子浓度小于1.0×10-5mol/L即为该离子沉淀完全),Mg2+的浓度为
(5)测定产品中草酸钴晶体的质量分数:称取草酸钴样品3.050g,用稀硫酸酸化,加入100.0mL0.1000mol/LKMnO4溶液,加热(该条件下Co2+不被氧化),充分反应后将溶液冷却至室温,将溶液完全转移到250mL容量瓶中定容。然后取25mL用0.2000mol/LFeSO4溶液进行滴定,到达滴定终点后,消耗18.00mLFeSO4溶液。
①若用盐酸酸化,则测得的草酸钴晶体的质量分数会
②计算样品中草酸钴晶体CoC2O4·2H2O的质量分数为
您最近一年使用:0次
2023-12-28更新
|
262次组卷
|
3卷引用:重庆市巴蜀中学2024届高三上学期高考适应性月考卷(四)化学试题
名校
2 . 工业上,处理低晶位黄铜矿[二硫化亚铁铜(CuFeS2)含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(FeSO4·7H2O)和胆矾(CuSO4·5H2O),相关流程如图。
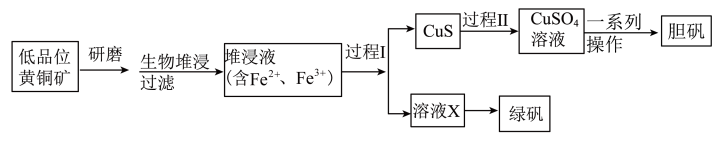
(1)基态Cu2+核外电子的空间运动状态有_______ 种。
(2)生物堆浸过程的反应在T·f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为CuFeS2+4H++O2 Cu2++Fe2++2S+2H2O。第二阶段反应为Fe2+继续被氧化转变成Fe3+,反应的离子方程式为
Cu2++Fe2++2S+2H2O。第二阶段反应为Fe2+继续被氧化转变成Fe3+,反应的离子方程式为_______ 。
(3)过程Ⅰ需将Fe3+还原为Fe2+,请回答下列问题:
①若过程Ⅰ中只加入了一种试剂,在下列常见试剂中可选择_______ (填序号)。
a.Na2S b.Na2SO3 c.Na2S2O3 d.Cu
②若过程Ⅰ加入了过量的Na2S2O3作为还原剂,在该酸性环境中发生反应的离子方程式有_______ (已知: 作还原剂时,通常被氧化为
作还原剂时,通常被氧化为 ,忽略该过程中所有涉及配合物的反应)。
,忽略该过程中所有涉及配合物的反应)。
(4)向过程Ⅰ所得的CuS固体中加H2O2和稀硫酸,使CuS完全溶解,其中H2O2的作用是_______ (填“氧化剂”或“还原剂”)。
(5)制备胆矾的“一系列操作”包含_______ 、过滤、洗涤、干燥。
(6)绿矾的纯度可通过“KMnO4滴定法”测定。取mg绿矾晶体,加适量稀硫酸溶解,然后加入适量MnSO4固体作催化剂。用物质的量浓度为cmol/L的KMnO4溶液滴定。滴定终点的现象为_______ ,此时,消耗KMnO4溶液的体积为VmL,则绿矾晶体质量分数的计算式为_______ 。(FeSO4·7H2O摩尔质量为278g/mol)

(1)基态Cu2+核外电子的空间运动状态有
(2)生物堆浸过程的反应在T·f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为CuFeS2+4H++O2
 Cu2++Fe2++2S+2H2O。第二阶段反应为Fe2+继续被氧化转变成Fe3+,反应的离子方程式为
Cu2++Fe2++2S+2H2O。第二阶段反应为Fe2+继续被氧化转变成Fe3+,反应的离子方程式为(3)过程Ⅰ需将Fe3+还原为Fe2+,请回答下列问题:
①若过程Ⅰ中只加入了一种试剂,在下列常见试剂中可选择
a.Na2S b.Na2SO3 c.Na2S2O3 d.Cu
②若过程Ⅰ加入了过量的Na2S2O3作为还原剂,在该酸性环境中发生反应的离子方程式有
 作还原剂时,通常被氧化为
作还原剂时,通常被氧化为 ,忽略该过程中所有涉及配合物的反应)。
,忽略该过程中所有涉及配合物的反应)。(4)向过程Ⅰ所得的CuS固体中加H2O2和稀硫酸,使CuS完全溶解,其中H2O2的作用是
(5)制备胆矾的“一系列操作”包含
(6)绿矾的纯度可通过“KMnO4滴定法”测定。取mg绿矾晶体,加适量稀硫酸溶解,然后加入适量MnSO4固体作催化剂。用物质的量浓度为cmol/L的KMnO4溶液滴定。滴定终点的现象为
您最近一年使用:0次
名校
解题方法
3 . 某学习小组实验室模拟工业制备硫氰化钾(KSCN)。实验装置如图所示:

已知:①CS2不溶于水,密度比水大;NH3不溶于CS2;
②热稳定性;NH4HS低于NH4SCN。
实验步骤如下:
(1)制备NH4SCN溶液:
制备NH4SCN原理为CS2+3NH3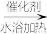 NH4SCN+NH4HS(该反应比较缓慢)。
NH4SCN+NH4HS(该反应比较缓慢)。
①实验前,经检验装置的气密性后装入试剂。其中,盛放碱石灰的玻璃仪器为_______ 仪器名称)。向三颈烧瓶内装入固体催化剂、CS2和水,三颈烧瓶左侧的进气管口必须浸没到CS2液体中,目的是_______ 。
②实验开始时打开K1,加热装置A、D,使装置A中产生的气体缓缓通入装置D中,当看到三颈烧瓶中_______ 现象时说明该反应接近完全,装置C的作用是_______ 。
(2)制备KSCN晶体:熄灭装置A中的酒精灯,关闭K1,移开水浴,将装置D继续加热至105℃一段时间,其目的是_______ ;然后打开K2,再趁热滴加适量的KOH溶液,制得较纯净的KSCN溶液,该反应的化学方程式为_______ ;最后提纯得到硫氰化钾晶体。
(3)装置E用来吸收尾气,防止污染环境,吸收NH3生成无色无味气体的离子方程式为_______ (铬元素被还原为Cr3+)
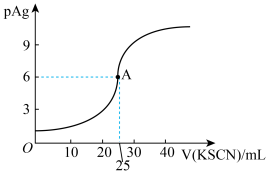
(4)使用制得的晶体配制成0.100mol/L的KSCN标准溶液来滴定25.00mL未知浓度的AgNO3溶液,以Fe(NO3)3溶液作指示剂,测得溶液中pAg=-lgc(Ag+)随加入KSCN溶液的体积变化如图所示。已知:SCN-+Ag+=AgSCN↓(白色),A点为滴定终点(滴定过程不考虑 氧化SCN-)。当加入15.00mLKSCN溶液时,溶液中c(SCN-)=
氧化SCN-)。当加入15.00mLKSCN溶液时,溶液中c(SCN-)=_______ 。

已知:①CS2不溶于水,密度比水大;NH3不溶于CS2;
②热稳定性;NH4HS低于NH4SCN。
实验步骤如下:
(1)制备NH4SCN溶液:
制备NH4SCN原理为CS2+3NH3
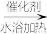 NH4SCN+NH4HS(该反应比较缓慢)。
NH4SCN+NH4HS(该反应比较缓慢)。①实验前,经检验装置的气密性后装入试剂。其中,盛放碱石灰的玻璃仪器为
②实验开始时打开K1,加热装置A、D,使装置A中产生的气体缓缓通入装置D中,当看到三颈烧瓶中
(2)制备KSCN晶体:熄灭装置A中的酒精灯,关闭K1,移开水浴,将装置D继续加热至105℃一段时间,其目的是
(3)装置E用来吸收尾气,防止污染环境,吸收NH3生成无色无味气体的离子方程式为
(4)使用制得的晶体配制成0.100mol/L的KSCN标准溶液来滴定25.00mL未知浓度的AgNO3溶液,以Fe(NO3)3溶液作指示剂,测得溶液中pAg=-lgc(Ag+)随加入KSCN溶液的体积变化如图所示。已知:SCN-+Ag+=AgSCN↓(白色),A点为滴定终点(滴定过程不考虑
 氧化SCN-)。当加入15.00mLKSCN溶液时,溶液中c(SCN-)=
氧化SCN-)。当加入15.00mLKSCN溶液时,溶液中c(SCN-)=
您最近一年使用:0次
2023-12-24更新
|
171次组卷
|
2卷引用: 重庆市第八中学校2023-2024学年高三上学期高考适应性月考卷4化学试题
名校
解题方法
4 . 完成下列填空
(1)磷能形成多种具有独特性质的物质。
①磷能形成红磷、白磷、黑磷等多种单质,它们互为_______ (填“同位素”或“同素异形体”)。
②磷的一种组成为Ba(H2PO2)2的盐,能与盐酸反应但不能与NaOH溶液反应,下列有关Ba(H2PO2)2、H3PO2的分析中正确的是_______ (填字母)。
A. Ba(H2PO2)2是酸式盐 B. Ba(H2PO2)2是正盐
C.均具有较强的还原性 D. H3PO2是三元弱酸
(2)某透明溶液仅含Na+、Fe2+、Ba2+、Al3+、 、Cl—、
、Cl—、 中的4种离子,且均为1mol,向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解),则溶液中存在的阳离子是
中的4种离子,且均为1mol,向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解),则溶液中存在的阳离子是_______ 、阴离子是_______
(3)碳能形成多种氧化物,如CO、CO2、C2O3、C3O2已知C3O2+2H2O=CH2(COOH)2,写出将0.1molC3O2缓慢通入到100mL1.0mol·L-1NaOH溶液中反应的化学方程式为_______ ,该氧化物也可与热的CuO反应,则1molC3O2最多还原_______ mol CuO。
(4)自然界中Cr主要以 价和
价和 价形式存在。Cr2O
价形式存在。Cr2O 中的Cr能引起细胞的突变,在酸性条件下可用亚硫酸钠将Cr2O
中的Cr能引起细胞的突变,在酸性条件下可用亚硫酸钠将Cr2O 还原,其离子方程式为
还原,其离子方程式为_______ 。
(1)磷能形成多种具有独特性质的物质。
①磷能形成红磷、白磷、黑磷等多种单质,它们互为
②磷的一种组成为Ba(H2PO2)2的盐,能与盐酸反应但不能与NaOH溶液反应,下列有关Ba(H2PO2)2、H3PO2的分析中正确的是
A. Ba(H2PO2)2是酸式盐 B. Ba(H2PO2)2是正盐
C.均具有较强的还原性 D. H3PO2是三元弱酸
(2)某透明溶液仅含Na+、Fe2+、Ba2+、Al3+、
 、Cl—、
、Cl—、 中的4种离子,且均为1mol,向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解),则溶液中存在的阳离子是
中的4种离子,且均为1mol,向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解),则溶液中存在的阳离子是(3)碳能形成多种氧化物,如CO、CO2、C2O3、C3O2已知C3O2+2H2O=CH2(COOH)2,写出将0.1molC3O2缓慢通入到100mL1.0mol·L-1NaOH溶液中反应的化学方程式为
(4)自然界中Cr主要以
 价和
价和 价形式存在。Cr2O
价形式存在。Cr2O 中的Cr能引起细胞的突变,在酸性条件下可用亚硫酸钠将Cr2O
中的Cr能引起细胞的突变,在酸性条件下可用亚硫酸钠将Cr2O 还原,其离子方程式为
还原,其离子方程式为
您最近一年使用:0次
5 . 一种以铬铁矿【主要含有Fe(CrO2)2,同时含有Al2O3、SiO2】为主要原料制备K2Cr2O7的工艺流程如图所示:

(1)基态铬原子的单电子数为________ ,铬铁矿中元素第一电离能Al________ Si(填“大于”、“小于”或“等于”)。
(2)焙烧时Fe(CrO2)2转化为Na2CrO4,同时杂质A12O3、SiO2转化为可溶性钠盐,焙烧时Fe(CrO2)2发生反应的的化学方程式为________ 。
(3)滤渣a中除A1(OH)3外还有________ 。(填化学式)
(4)已知,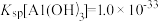 ,酸化时发生
,酸化时发生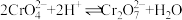 ,
,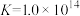 ,测得滤液2中pH=5,含铬微粒只有
,测得滤液2中pH=5,含铬微粒只有 和
和 ,其中c(
,其中c( )=1.0mol/L,则滤液2中c(Al3+)=
)=1.0mol/L,则滤液2中c(Al3+)=________ mol/L, 的转化率为
的转化率为_______ 。(结果保留3位有效数字)
(5)已知相同温度下Na2Cr2O7的溶解度显著高于K2Cr2O7,可利用两者溶解度的不同实现转化,操作X的具体过程为:加热浓缩、_______ 、冷却结晶、过滤、洗涤干燥,得到较纯净的K2Cr2O7晶体。
(6)将15kg铬铁矿按上述流程制得K2Cr2O7产品,假设各步损失铬元素总计9.0%,干燥称量得14kg该产品,滴定分析产品中K2Cr2O7的纯度为99.2%,则铬铁矿中铬元素的质量分数为_______ 。

(1)基态铬原子的单电子数为
(2)焙烧时Fe(CrO2)2转化为Na2CrO4,同时杂质A12O3、SiO2转化为可溶性钠盐,焙烧时Fe(CrO2)2发生反应的的化学方程式为
(3)滤渣a中除A1(OH)3外还有
(4)已知,
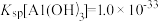 ,酸化时发生
,酸化时发生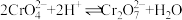 ,
,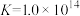 ,测得滤液2中pH=5,含铬微粒只有
,测得滤液2中pH=5,含铬微粒只有 和
和 ,其中c(
,其中c( )=1.0mol/L,则滤液2中c(Al3+)=
)=1.0mol/L,则滤液2中c(Al3+)= 的转化率为
的转化率为(5)已知相同温度下Na2Cr2O7的溶解度显著高于K2Cr2O7,可利用两者溶解度的不同实现转化,操作X的具体过程为:加热浓缩、
(6)将15kg铬铁矿按上述流程制得K2Cr2O7产品,假设各步损失铬元素总计9.0%,干燥称量得14kg该产品,滴定分析产品中K2Cr2O7的纯度为99.2%,则铬铁矿中铬元素的质量分数为
您最近一年使用:0次
名校
解题方法
6 . 某科研小组设计出利用工业废酸(主要成分为稀硫酸)浸取某废弃的氧化铜锌矿(主要含CuO、ZnO和 )的方案,实现废物综合利用,如图所示。
)的方案,实现废物综合利用,如图所示。
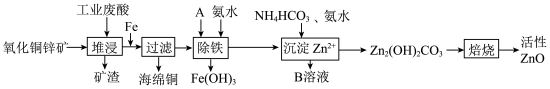
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。
请回答下列问题:
(1)堆浸时,为了提高浸出效率可采取的措施有(任写1种):______ 。
(2)堆浸时产生的矿渣主要成分是______ 。
(3)物质A的作用是______ ,可使用下列物质中的______ 。
A. B.
B. C.
C. D.
D.
(4)除铁过程中加入氨水的目的是调节溶液的PH,PH应控制在______ 范围。
(5)物质B可直接用作氮肥,则B的化学式是______ 。
(6)除铁后得到的 可用KClO溶液在碱性环境下将其氧化得到一种高效的多功能水处理剂―
可用KClO溶液在碱性环境下将其氧化得到一种高效的多功能水处理剂― ,写出该反应的离子方程式
,写出该反应的离子方程式______ 。
 )的方案,实现废物综合利用,如图所示。
)的方案,实现废物综合利用,如图所示。
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。
离子 |
|
|
|
开始沉淀时的PH | 6.34 | 1.48 | 6.2 |
完全沉淀时的PH | 9.7 | 3.2 | 8.0 |
(1)堆浸时,为了提高浸出效率可采取的措施有(任写1种):
(2)堆浸时产生的矿渣主要成分是
(3)物质A的作用是
A.
 B.
B. C.
C. D.
D.
(4)除铁过程中加入氨水的目的是调节溶液的PH,PH应控制在
(5)物质B可直接用作氮肥,则B的化学式是
(6)除铁后得到的
 可用KClO溶液在碱性环境下将其氧化得到一种高效的多功能水处理剂―
可用KClO溶液在碱性环境下将其氧化得到一种高效的多功能水处理剂― ,写出该反应的离子方程式
,写出该反应的离子方程式
您最近一年使用:0次
7 . 某厂利用废旧铅蓄电池中的铅膏(主要成分为 、
、 、PbO和Pb,还有少量铁、铝的氧化物)回收PbO,工艺流程如下:
、PbO和Pb,还有少量铁、铝的氧化物)回收PbO,工艺流程如下:

已知: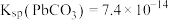 ,
,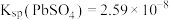 ,
,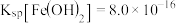 ,
,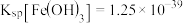 ,
,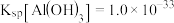 。
。
(1)PbO中O元素的价电子的轨道表示式为_______________________ 。
(2)“脱硫”过程中涉及含Pb沉淀转化的离子方程式为___________ ,反应的平衡常数K的数值为_____________ 。
(3)“酸浸”时, 能使
能使 转化为
转化为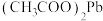 ,写出该反应的化学方程式
,写出该反应的化学方程式_________________ 此外, 还能氧化溶液中的
还能氧化溶液中的_____________ (填化学式或离子符号)。
(4)PbO的溶解度曲线如图甲所示,结合图像分析,为得到高纯PbO固体,需将粗品PbO溶解在__________ (填“10%”或“35%”)浓度的NaOH溶液中,加热至110℃,充分溶解后趁热过滤,将滤液冷却结晶,过滤、洗涤并干燥得到高纯产品。

(5)常温下,溶液中部分含铅物质的质量分数 与溶液pH变化的关系如图乙所示:
与溶液pH变化的关系如图乙所示:

①若溶液pH由10增大到了11,发生反应的离子方程式为_______________________ 。
②“除杂”时,为了使 、
、 沉淀完全(离子浓度低于
沉淀完全(离子浓度低于 ),结合图乙与已知的信息,需调节溶液pH的理论范围为
),结合图乙与已知的信息,需调节溶液pH的理论范围为____________ 。
 、
、 、PbO和Pb,还有少量铁、铝的氧化物)回收PbO,工艺流程如下:
、PbO和Pb,还有少量铁、铝的氧化物)回收PbO,工艺流程如下:
已知:
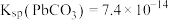 ,
,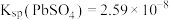 ,
,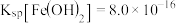 ,
,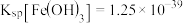 ,
,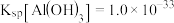 。
。(1)PbO中O元素的价电子的轨道表示式为
(2)“脱硫”过程中涉及含Pb沉淀转化的离子方程式为
(3)“酸浸”时,
 能使
能使 转化为
转化为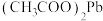 ,写出该反应的化学方程式
,写出该反应的化学方程式 还能氧化溶液中的
还能氧化溶液中的(4)PbO的溶解度曲线如图甲所示,结合图像分析,为得到高纯PbO固体,需将粗品PbO溶解在

(5)常温下,溶液中部分含铅物质的质量分数
 与溶液pH变化的关系如图乙所示:
与溶液pH变化的关系如图乙所示:
①若溶液pH由10增大到了11,发生反应的离子方程式为
②“除杂”时,为了使
 、
、 沉淀完全(离子浓度低于
沉淀完全(离子浓度低于 ),结合图乙与已知的信息,需调节溶液pH的理论范围为
),结合图乙与已知的信息,需调节溶液pH的理论范围为
您最近一年使用:0次
2023-12-12更新
|
307次组卷
|
2卷引用:重庆市育才中学校、西南大学附中、万州中学2023-2024学年高二上学期12月联考化学试题
名校
8 . 回答下列问题:
(1)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为: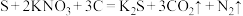 。该反应中,被还原的元素名称是
。该反应中,被还原的元素名称是_______ ,氧化产物是_______ 。
(2)工业废水中含有重铬酸根离子( )有毒,必须处理达标才能排放。工业上常用绿矾(
)有毒,必须处理达标才能排放。工业上常用绿矾(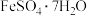 )做处理剂,反应的离子方程式如下:
)做处理剂,反应的离子方程式如下:
_______ _______
_______ _______
_______ _______
_______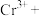 _______
_______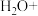 _______
_______
配平上述方程式_______ ,该反应中氧化剂和还原剂的个数比为_______ ,每生成一个 转移的电子数为
转移的电子数为_______ 个。
(3)已知Cu和稀硝酸反应的方程式如下: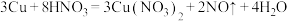 。该反应中
。该反应中 表现的性质有
表现的性质有_______ 和_______ ,每生成3g NO,消耗的氧化剂的质量为_______ g。
(1)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:
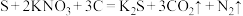 。该反应中,被还原的元素名称是
。该反应中,被还原的元素名称是(2)工业废水中含有重铬酸根离子(
 )有毒,必须处理达标才能排放。工业上常用绿矾(
)有毒,必须处理达标才能排放。工业上常用绿矾(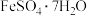 )做处理剂,反应的离子方程式如下:
)做处理剂,反应的离子方程式如下:_______
 _______
_______ _______
_______ _______
_______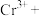 _______
_______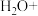 _______
_______
配平上述方程式
 转移的电子数为
转移的电子数为(3)已知Cu和稀硝酸反应的方程式如下:
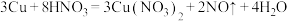 。该反应中
。该反应中 表现的性质有
表现的性质有
您最近一年使用:0次
名校
解题方法
9 . 将CO或 转化为高附加值化学品是颇具前景的合成路线。
转化为高附加值化学品是颇具前景的合成路线。
(1)相比于煤和石油,天然气作为燃料的主要优点有_______ 。
(2)煤的气化可将煤转化为可燃性气体,写出生成水煤气的化学方程式_______ 。
(3)钴系催化剂催化下CO加氢反应的一种路径如下图所示(*表示微粒吸附在催化剂表面的形态): 和
和 反应生成
反应生成 反应的重要中间体有
反应的重要中间体有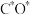 、
、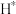 、
、_______ 、 和
和_______ 。
(4) 与二甲醚可发生反应:
与二甲醚可发生反应:
 。反应中二甲醚的平衡转化率与温度和压强的关系见下图:
。反应中二甲醚的平衡转化率与温度和压强的关系见下图:
_______ 0(填“大于”“小于”或“等于”)0,a、b、c的大小关系为_______ 。
②TK下,向恒压密闭容器中充入CO和 ,反应前
,反应前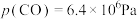 ,
,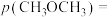
 ;充分反应达到平衡后CO的转化率为25%,则TK下该反应的平衡常数
;充分反应达到平衡后CO的转化率为25%,则TK下该反应的平衡常数
_______ 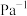 。
。
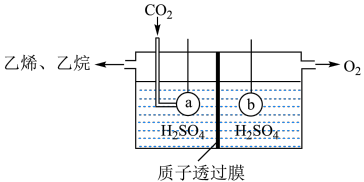
(5)以 为原料,电解法制取乙烯、乙烷的装置如图,生成乙烷的电极反应式为:
为原料,电解法制取乙烯、乙烷的装置如图,生成乙烷的电极反应式为:_______ ,当左侧有8.96L(标准状况) 反应时,a极区产品中乙烯的体积分数为50%,此时左右两侧溶液质量变化差
反应时,a极区产品中乙烯的体积分数为50%,此时左右两侧溶液质量变化差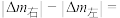
_______ g。
 转化为高附加值化学品是颇具前景的合成路线。
转化为高附加值化学品是颇具前景的合成路线。(1)相比于煤和石油,天然气作为燃料的主要优点有
(2)煤的气化可将煤转化为可燃性气体,写出生成水煤气的化学方程式
(3)钴系催化剂催化下CO加氢反应的一种路径如下图所示(*表示微粒吸附在催化剂表面的形态):
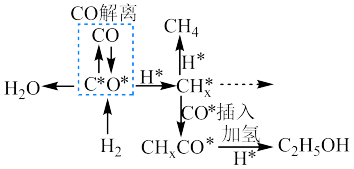
 和
和 反应生成
反应生成 反应的重要中间体有
反应的重要中间体有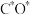 、
、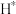 、
、 和
和(4)
 与二甲醚可发生反应:
与二甲醚可发生反应:
 。反应中二甲醚的平衡转化率与温度和压强的关系见下图:
。反应中二甲醚的平衡转化率与温度和压强的关系见下图:

②TK下,向恒压密闭容器中充入CO和
 ,反应前
,反应前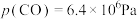 ,
,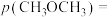
 ;充分反应达到平衡后CO的转化率为25%,则TK下该反应的平衡常数
;充分反应达到平衡后CO的转化率为25%,则TK下该反应的平衡常数
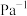 。
。(5)以
 为原料,电解法制取乙烯、乙烷的装置如图,生成乙烷的电极反应式为:
为原料,电解法制取乙烯、乙烷的装置如图,生成乙烷的电极反应式为: 反应时,a极区产品中乙烯的体积分数为50%,此时左右两侧溶液质量变化差
反应时,a极区产品中乙烯的体积分数为50%,此时左右两侧溶液质量变化差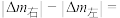
您最近一年使用:0次
名校
解题方法
10 . 利用废镍催化剂(主要成分为Ni和NiO,还含有一定量的ZnO、 、CaO等)制备水合氢氧化氧镍(
、CaO等)制备水合氢氧化氧镍( )的工艺流程如下:
)的工艺流程如下:

已知:①Ni能与 反应生成NiO;②
反应生成NiO;② 。回答以下问题:
。回答以下问题:
(1)“焙烧”前,需将废镍催化剂粉碎的目的是_______ ,滤渣1的成分是_______ 。
(2)“酸浸”时,主要反应的离子方程式为_______ 。
(3)“沉钙”后,欲使 ,应加
,应加 使反应后的溶液中
使反应后的溶液中
_______  。
。
(4)“萃取”时,pH对金属离子萃取率的影响如下图所示:
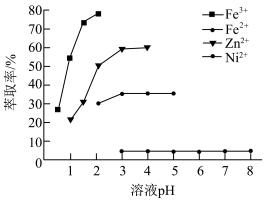
萃取剂萃取金属离子的原理如下:

萃取剂的萃取能力随pH的降低而_______ (填“降低”“不变”或“升高”),其原因是_______ 。
(5)“氧化”时,生成 的离子方程式为
的离子方程式为_______ 。
(6)取10.1g纯净干燥的 ,在空气中加强热,充分反应后生成8.3g
,在空气中加强热,充分反应后生成8.3g ,则
,则
_______ 。
 、CaO等)制备水合氢氧化氧镍(
、CaO等)制备水合氢氧化氧镍( )的工艺流程如下:
)的工艺流程如下:
已知:①Ni能与
 反应生成NiO;②
反应生成NiO;② 。回答以下问题:
。回答以下问题:(1)“焙烧”前,需将废镍催化剂粉碎的目的是
(2)“酸浸”时,主要反应的离子方程式为
(3)“沉钙”后,欲使
 ,应加
,应加 使反应后的溶液中
使反应后的溶液中
 。
。(4)“萃取”时,pH对金属离子萃取率的影响如下图所示:

萃取剂萃取金属离子的原理如下:

萃取剂的萃取能力随pH的降低而
(5)“氧化”时,生成
 的离子方程式为
的离子方程式为(6)取10.1g纯净干燥的
 ,在空气中加强热,充分反应后生成8.3g
,在空气中加强热,充分反应后生成8.3g ,则
,则
您最近一年使用:0次





