名校
1 . 下列离子方程式的书写正确的是
A.向苯酚钠溶液中通入少量 : :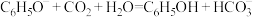 |
B.将铁片插入浓 中: 中: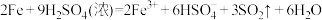 |
C.向 溶液中通入 溶液中通入 气体: 气体: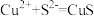 |
D.将少量 通入漂白液中: 通入漂白液中: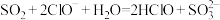 |
您最近一年使用:0次
名校
解题方法
2 . 砷为第四周期ⅤA族元素,金属冶炼过程产生的含砷废弃物需处理与检测。
Ⅰ.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
(1)①亚砷酸中砷元素的化合价为_____ 。
②基态砷原子的最外层电子排布式为______ 。
③砷酸(H3AsO4)的第一步电离方程式为_______ 。
(2)“一级沉砷”后仍然存在H3AsO3,写出“二级沉砷”中H2O2与H3AsO3反应的化学方程式_____ 。
(3)沉淀X主要为一种盐_______ (填化学式)。
(4)根据流程推测:亚砷酸盐的溶解性_____ (填“大于”或“小于”)相应砷酸盐。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10−6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入硫酸共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和难溶物AS2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
(5)步骤2的离子方程式为________ 。
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10−5g·kg−1,请通过计算说明该排放的废渣中砷元素的含量_______ (填“符合”或“不符合”)排放标准。
Ⅰ.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

(1)①亚砷酸中砷元素的化合价为
②基态砷原子的最外层电子排布式为
③砷酸(H3AsO4)的第一步电离方程式为
(2)“一级沉砷”后仍然存在H3AsO3,写出“二级沉砷”中H2O2与H3AsO3反应的化学方程式
(3)沉淀X主要为一种盐
(4)根据流程推测:亚砷酸盐的溶解性
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10−6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入硫酸共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和难溶物AS2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
(5)步骤2的离子方程式为
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10−5g·kg−1,请通过计算说明该排放的废渣中砷元素的含量
您最近一年使用:0次
名校
解题方法
3 . 三硫代碳酸钠(Na2CS3)在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子。某化学兴趣小组对Na2CS3进行了某些性质实验和定量测定。
实验一:探究Na2CS3的性质
(1)取少量Na2CS3样品于试管中,加水溶解,滴加酸性KMnO4溶液,溶液紫色褪去。
①使用的酸性KMnO4溶液,可以选用____ 酸化(选填字母)。
A.硫酸 B.硝酸 C.盐酸
②已知该反应的氧化产物是 ,该反应的氧化剂与还原剂的物质的量之比为
,该反应的氧化剂与还原剂的物质的量之比为____ 。
实验二:测定Na2CS3溶液的浓度
按如图所示装置进行实验:将50.0mLNa2CS3
溶液置于三颈烧瓶中,打开仪器d的活塞,滴入足量2.0mol·L−1的稀硫酸,关闭活塞。

已知: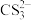 +2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
+2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
(2)仪器d的名称是_______ 。
(3)B中发生反应的化学方程式为_______ 。
(4)反应开始时需要先通入一段时间N2,目的是排除装置中的空气,防止A中生成的H2S被氧化。反应结束后,打开活塞K,再缓慢通入一段时间热N2(高于60℃),其目的是_______ 。
(5)为了计算该Na2CS3溶液的浓度,可测定B中生成沉淀的质量。对B中混合物进行过滤、洗涤、干燥、称重。若B中生成沉淀的质量为7.2g,则该Na2CS3溶液的物质的量浓度是_______ mol/L。
(6)也可以通过测定C中溶液质量的增加值来计算Na2CS3溶液的浓度,装置e中的试剂为_______ ;若缺少装置f,计算值会_____ (填“无影响”“偏高”或“偏低”)。
实验一:探究Na2CS3的性质
(1)取少量Na2CS3样品于试管中,加水溶解,滴加酸性KMnO4溶液,溶液紫色褪去。
①使用的酸性KMnO4溶液,可以选用
A.硫酸 B.硝酸 C.盐酸
②已知该反应的氧化产物是
 ,该反应的氧化剂与还原剂的物质的量之比为
,该反应的氧化剂与还原剂的物质的量之比为实验二:测定Na2CS3溶液的浓度
按如图所示装置进行实验:将50.0mLNa2CS3
溶液置于三颈烧瓶中,打开仪器d的活塞,滴入足量2.0mol·L−1的稀硫酸,关闭活塞。

已知:
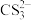 +2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
+2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)(2)仪器d的名称是
(3)B中发生反应的化学方程式为
(4)反应开始时需要先通入一段时间N2,目的是排除装置中的空气,防止A中生成的H2S被氧化。反应结束后,打开活塞K,再缓慢通入一段时间热N2(高于60℃),其目的是
(5)为了计算该Na2CS3溶液的浓度,可测定B中生成沉淀的质量。对B中混合物进行过滤、洗涤、干燥、称重。若B中生成沉淀的质量为7.2g,则该Na2CS3溶液的物质的量浓度是
(6)也可以通过测定C中溶液质量的增加值来计算Na2CS3溶液的浓度,装置e中的试剂为
您最近一年使用:0次
名校
4 . 完成下列问题。
(1)为了证明Ag+能将Fe2+氧化为Fe3+,某同学设计了如下图所示装置:
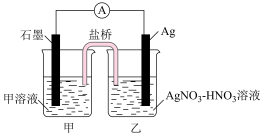
①其中甲溶液是_______ 。
②Ag电极为该电池的______ 极(填“阴或阳”或者“正或负”)
③该电池的总反应方程式为________ 。
(2)铵盐是一种重要的水体污染物。某课题组利用电解法,在含Cl-的水样中,探究将 转化为N2而脱氮的影响因素和反应机理。电解法脱氮的原理可能如下:
转化为N2而脱氮的影响因素和反应机理。电解法脱氮的原理可能如下:
①直接电氧化
在碱性条件下,阳极的电极反应式为______ 。
②间接电氧化
利用电解产生的Cl2,与H2O作用生成HClO进行脱氮。请写出HClO在酸性条件下氧化 的离子方程式
的离子方程式_____ 。25℃时,反应进行10min时,溶液的pH由6变为2时,其NH4+的平均反应速率为____ mol∙L−1∙min−1。
(1)为了证明Ag+能将Fe2+氧化为Fe3+,某同学设计了如下图所示装置:

①其中甲溶液是
②Ag电极为该电池的
③该电池的总反应方程式为
(2)铵盐是一种重要的水体污染物。某课题组利用电解法,在含Cl-的水样中,探究将
 转化为N2而脱氮的影响因素和反应机理。电解法脱氮的原理可能如下:
转化为N2而脱氮的影响因素和反应机理。电解法脱氮的原理可能如下:①直接电氧化
在碱性条件下,阳极的电极反应式为
②间接电氧化
利用电解产生的Cl2,与H2O作用生成HClO进行脱氮。请写出HClO在酸性条件下氧化
 的离子方程式
的离子方程式
您最近一年使用:0次
名校
解题方法
5 . 草酸镍 是一种不溶于水的浅绿色粉末,常用于制镍催化剂和镍粉等。以铜镍合金废料(主要成分为镍和铜,含有一定量的铁和硅)为原料生产草酸镍的工艺流程如图:
是一种不溶于水的浅绿色粉末,常用于制镍催化剂和镍粉等。以铜镍合金废料(主要成分为镍和铜,含有一定量的铁和硅)为原料生产草酸镍的工艺流程如图:
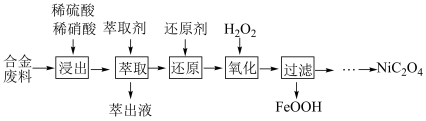
已知:①“浸出”液含有的离子主要有 ;
;
② 增大,
增大, 被氧化的速率加快,同时生成的
被氧化的速率加快,同时生成的 水解形成更多的胶体能吸附
水解形成更多的胶体能吸附 。
。
③草酸的
(1)生产时为提高合金废料浸出率,常采取的措施有______ (填字母)。
a.适当延长浸出时间 b.高温浸出 c.分批加入混酸浸取并搅拌
(2)“萃取”步骤中萃取除去的主要金属阳离子是______ 。
(3)“氧化”过程中,控制 小于3的条件下进行。
小于3的条件下进行。
① 的电子式为
的电子式为______ 。②“氧化”过程的离子方程式为______ 。
③ 为3~4时,镍的回收率降低的原因是
为3~4时,镍的回收率降低的原因是______ 。
(4)已知常温下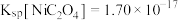 ,当溶液
,当溶液 时,
时, 沉淀完全[
沉淀完全[ 时认为完全沉淀],则此时溶液中草酸的浓度
时认为完全沉淀],则此时溶液中草酸的浓度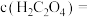
______ 。
(5)在空气中加热二水合草酸镍得到如下TT-DSC热分解曲线如图所示,已知: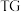 指的是在程序控制温度下测量待测样品的质量与温度变化关系,DSC指通过单独的加热器补偿样品在加热过程中发生的热量变化,以保持样品和参比物的温差为零。这种补偿能量即样品吸收(峰向下)或放出(峰向上)的热量。则
指的是在程序控制温度下测量待测样品的质量与温度变化关系,DSC指通过单独的加热器补偿样品在加热过程中发生的热量变化,以保持样品和参比物的温差为零。这种补偿能量即样品吸收(峰向下)或放出(峰向上)的热量。则 时,反应的化学方程式为
时,反应的化学方程式为______ 。二水合草酸镍分解的整个反应是______ (填“吸热”或“放热”)反应。

 是一种不溶于水的浅绿色粉末,常用于制镍催化剂和镍粉等。以铜镍合金废料(主要成分为镍和铜,含有一定量的铁和硅)为原料生产草酸镍的工艺流程如图:
是一种不溶于水的浅绿色粉末,常用于制镍催化剂和镍粉等。以铜镍合金废料(主要成分为镍和铜,含有一定量的铁和硅)为原料生产草酸镍的工艺流程如图:
已知:①“浸出”液含有的离子主要有
 ;
;②
 增大,
增大, 被氧化的速率加快,同时生成的
被氧化的速率加快,同时生成的 水解形成更多的胶体能吸附
水解形成更多的胶体能吸附 。
。③草酸的

(1)生产时为提高合金废料浸出率,常采取的措施有
a.适当延长浸出时间 b.高温浸出 c.分批加入混酸浸取并搅拌
(2)“萃取”步骤中萃取除去的主要金属阳离子是
(3)“氧化”过程中,控制
 小于3的条件下进行。
小于3的条件下进行。①
 的电子式为
的电子式为③
 为3~4时,镍的回收率降低的原因是
为3~4时,镍的回收率降低的原因是(4)已知常温下
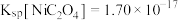 ,当溶液
,当溶液 时,
时, 沉淀完全[
沉淀完全[ 时认为完全沉淀],则此时溶液中草酸的浓度
时认为完全沉淀],则此时溶液中草酸的浓度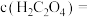
(5)在空气中加热二水合草酸镍得到如下TT-DSC热分解曲线如图所示,已知:
 指的是在程序控制温度下测量待测样品的质量与温度变化关系,DSC指通过单独的加热器补偿样品在加热过程中发生的热量变化,以保持样品和参比物的温差为零。这种补偿能量即样品吸收(峰向下)或放出(峰向上)的热量。则
指的是在程序控制温度下测量待测样品的质量与温度变化关系,DSC指通过单独的加热器补偿样品在加热过程中发生的热量变化,以保持样品和参比物的温差为零。这种补偿能量即样品吸收(峰向下)或放出(峰向上)的热量。则 时,反应的化学方程式为
时,反应的化学方程式为
您最近一年使用:0次
名校
6 . X、Y、Z、W、P、Q是元素周期表前四周期的六种常见元素,原子序数依次增大。X在自然界中有多种同素异形体,其中一种是自然界中最硬的单质;Z是地壳中含量最多的元素;W基态原子核外的9个原子轨道上填充了电子,且有1个未成对电子;P是常见的金属元素,其单质能与盐酸反应,不与碱反应,它的某种氧化物可用作红色颜料;Q基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。回答以下问题:
(1)P、Q中位于周期表的d区的是__________ (填元素符号,下同),基态Q原子的价层电子排布式为__________ ;元素X、Y、Z中,电负性最大的是__________ 。
(2)烃 的1个分子中含有
的1个分子中含有__________ 个σ键;X和Y的简单氢化物中沸点更高的是__________ (填化学式),理由是__________ (答2点)。
(3)化合物 可用作杀菌消毒剂和漂白剂,
可用作杀菌消毒剂和漂白剂, 分子的中心原子杂化类型是
分子的中心原子杂化类型是__________ ;工业上可用W的单质与潮湿的碳酸钠反应制取 ,并生成另外两种含钠的化合物,反应中无其它气体生成,写出该反应的化学方程式
,并生成另外两种含钠的化合物,反应中无其它气体生成,写出该反应的化学方程式__________ 。
(1)P、Q中位于周期表的d区的是
(2)烃
 的1个分子中含有
的1个分子中含有(3)化合物
 可用作杀菌消毒剂和漂白剂,
可用作杀菌消毒剂和漂白剂, 分子的中心原子杂化类型是
分子的中心原子杂化类型是 ,并生成另外两种含钠的化合物,反应中无其它气体生成,写出该反应的化学方程式
,并生成另外两种含钠的化合物,反应中无其它气体生成,写出该反应的化学方程式
您最近一年使用:0次
2024-02-22更新
|
169次组卷
|
4卷引用:重庆市铜梁一中等重点中学2023-2024学年高二下学期3月月考化学试题
7 . KMnO4具有强氧化性,实验室可用其与浓盐酸反应制备氯气。
(1)配平下列有关反应的化学方程式____ ,___KMnO4+___HCl(浓)= __MnCl2 +__ KCl+___Cl2↑+__H2O。
(2)反应中,氧化剂是________ (填化学式,下同),氧化产物是________ 。元素化合价升高的元素是________ ,氧化剂与还原剂的个数之比为_______ 。
(3)盐酸在上述反应中体现出的性质有_______ (填序号)
①氧化性 ②还原性 ③碱性 ④酸性
(4)湿法制备高铁酸钾( K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、 、Cl-、H2O,写出该反应的离子方程式:
、Cl-、H2O,写出该反应的离子方程式:_______ 。
(1)配平下列有关反应的化学方程式
(2)反应中,氧化剂是
(3)盐酸在上述反应中体现出的性质有
①氧化性 ②还原性 ③碱性 ④酸性
(4)湿法制备高铁酸钾( K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O,写出该反应的离子方程式:
、Cl-、H2O,写出该反应的离子方程式:
您最近一年使用:0次
名校
解题方法
8 . 氧化还原反应是一类非常重要的反应。回答下列问题:
(1)将铁丝伸入CuSO4溶液中,发生反应的离子方程式为_______ 。
(2)人体内的铁元素是以Fe2+和Fe3+的形式存在,其中Fe2+易被人体吸收。服用维生素C可使Fe3+转化成Fe2+而有利于人体吸收,说明维生素C具有_______ (填“氧化性”或“还原性”)。
(3)市场上出售的某种麦片中含有微量还原性铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的化学方程式为_______ 。
(4)实验室制取Cl2的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,请根据上述方程式回答下列问题:
MnCl2+Cl2↑+2H2O,请根据上述方程式回答下列问题:
①_______ 元素被氧化,发生氧化反应的物质是_______ 。
②请写出该反应的离子方程式_______ 。
(5)高铁酸钾(K2FeO4)是一种新型、高效的净水剂,具有很强的氧化性,与盐酸混合会生成Cl2,本身被还原为Fe3+,请写出该反应的离子方程式_______ 。
(1)将铁丝伸入CuSO4溶液中,发生反应的离子方程式为
(2)人体内的铁元素是以Fe2+和Fe3+的形式存在,其中Fe2+易被人体吸收。服用维生素C可使Fe3+转化成Fe2+而有利于人体吸收,说明维生素C具有
(3)市场上出售的某种麦片中含有微量还原性铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的化学方程式为
(4)实验室制取Cl2的化学方程式为:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O,请根据上述方程式回答下列问题:
MnCl2+Cl2↑+2H2O,请根据上述方程式回答下列问题:①
②请写出该反应的离子方程式
(5)高铁酸钾(K2FeO4)是一种新型、高效的净水剂,具有很强的氧化性,与盐酸混合会生成Cl2,本身被还原为Fe3+,请写出该反应的离子方程式
您最近一年使用:0次
名校
解题方法
9 . 锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件、医药及化工等领域。以辉锑矿为原料制备金属锑的一种工艺流程如下图所示:
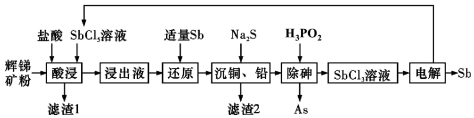
已知部分信息如下所示:
I.辉锑矿(主要成分为Sb2S3,还含有As2S5、PbS、CuO和SiO2等);
II.浸出液主要含HCl和SbCl3,还含SbCl5、CuCl2、AsCl3和PbCl2等杂质;
III.常温下,Ksp(CuS)=1.0×10−36,Ksp(PbS)=9.0×10−29。
请回答下列问题:
(1)基态Sb原子价电子排布式为5s25p3,则Sb在周期表中的位置为___________ 。
(2)滤渣1中除了单质硫之外,还有___________ (填化学式)。
(3)“酸浸”时,SbCl5和Sb2S3发生反应的化学方程式为___________ 。
(4)已知:浸出液中c(Cu2+)=0.01mol/L、c(Pb2+)=0.10mol/L。在“沉铜、铅”过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是_______ (填化学式);当CuS、PbS共沉时,c(Pb2+):c(Cu2+)=_______ 。
(5)“除砷”时有H3PO3生成,该反应的化学方程式为___________ 。
(6)一种突破传统电池设计理念的镁−锑液态金属储能电池工作原理如图所示:
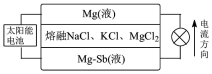
该电池由于密度的不同,在重力作用下分为三层,工作时中间层熔融盐的组成不变。充电时,Cl−向___________ (填“上”或“下”)移动;放电时,正极的电极反应式为___________ 。

已知部分信息如下所示:
I.辉锑矿(主要成分为Sb2S3,还含有As2S5、PbS、CuO和SiO2等);
II.浸出液主要含HCl和SbCl3,还含SbCl5、CuCl2、AsCl3和PbCl2等杂质;
III.常温下,Ksp(CuS)=1.0×10−36,Ksp(PbS)=9.0×10−29。
请回答下列问题:
(1)基态Sb原子价电子排布式为5s25p3,则Sb在周期表中的位置为
(2)滤渣1中除了单质硫之外,还有
(3)“酸浸”时,SbCl5和Sb2S3发生反应的化学方程式为
(4)已知:浸出液中c(Cu2+)=0.01mol/L、c(Pb2+)=0.10mol/L。在“沉铜、铅”过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是
(5)“除砷”时有H3PO3生成,该反应的化学方程式为
(6)一种突破传统电池设计理念的镁−锑液态金属储能电池工作原理如图所示:

该电池由于密度的不同,在重力作用下分为三层,工作时中间层熔融盐的组成不变。充电时,Cl−向
您最近一年使用:0次
名校
解题方法
10 . 按要求填空:
(1)以下为中学化学中常见的几种物质:①二氧化碳 ②熔融 KCl ③NaHSO4固体④铜 ⑤稀硫酸 ⑥澄清石灰水,其中属于电解质的有_______ (填编号,下同),属于非电解质的 有_______ ,能导电的有_______ 。
(2)高铁酸钠(Na2FeO4)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O;该反应中氧化剂是_______ (用化学式表示,下同) ,_______ 元素被氧化,还原产物与氧化产物之比为_______ 。
(3)已知次磷酸(H3PO2)是一元弱酸,其与氢氧化钠溶液反应的离子方程式为_______ 。
(1)以下为中学化学中常见的几种物质:①二氧化碳 ②熔融 KCl ③NaHSO4固体④铜 ⑤稀硫酸 ⑥澄清石灰水,其中属于电解质的有
(2)高铁酸钠(Na2FeO4)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O;该反应中氧化剂是
(3)已知次磷酸(H3PO2)是一元弱酸,其与氢氧化钠溶液反应的离子方程式为
您最近一年使用:0次



