1 . 某离子反应方程式中的微粒有 、
、 、
、 、
、 、
、 、
、 ,反应发生时
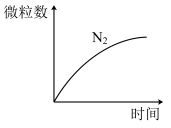
,反应发生时 的数目随时间的变化曲线如图所示,下列说法正确的是
的数目随时间的变化曲线如图所示,下列说法正确的是
 、
、 、
、 、
、 、
、 、
、 ,反应发生时
,反应发生时 的数目随时间的变化曲线如图所示,下列说法正确的是
的数目随时间的变化曲线如图所示,下列说法正确的是
A. 发生还原反应 发生还原反应 |
B.该反应中 为氧化产物 为氧化产物 |
| C.反应后溶液的碱性减弱 |
| D.每消耗1个还原剂微粒,转移6个电子 |
您最近一年使用:0次
2024-01-22更新
|
71次组卷
|
2卷引用:重庆市第十八中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
2 .  (碘酸钾)常用的食盐加碘剂,某研究小组在实验室采用如下种方法进行
(碘酸钾)常用的食盐加碘剂,某研究小组在实验室采用如下种方法进行 的制备。
的制备。
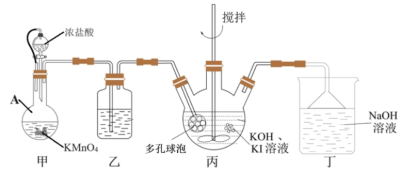
已知:① 是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。
是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。
② 在碱性条件下还原产物为一种不溶于水的沉淀。
在碱性条件下还原产物为一种不溶于水的沉淀。
回答下列问题:
(1)甲装置中仪器A的名称是________ ,丙装置中多孔球泡装置的作用是_________ 。
(2)丁装置中发生反应的离子方程式为___________ 。
(3)实验室还可以直接使用 与KI溶液在强碱环境中制备
与KI溶液在强碱环境中制备 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(4)反应结束后,将装置丙中溶液经如下操作可得到较为纯净的 晶体:
晶体:

在获取碘酸钾产品的操作中,下列说法正确的是___________(填序号)。
(5)产品纯度的测定:准确称取ag产品,配制成250mL溶液作为待测液,取25.00mL该溶液于碘量瓶中,加入稍过量的KI,用适量的盐酸酸化,盖紧塞子,置于避光处3min,用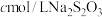 标准溶液滴定,当溶液呈淡黄色时,加入少许淀粉,平行滴定三次,平均消耗标准液
标准溶液滴定,当溶液呈淡黄色时,加入少许淀粉,平行滴定三次,平均消耗标准液 。已知:
。已知: 。
。
①配制待测液过程中所需的玻璃仪器有:烧杯、胶头滴管、量筒、玻璃棒、___________ 。
②滴定达到终点的现象为___________ 。
③产品中 的质量分数为
的质量分数为___________ ( 的摩尔质量为
的摩尔质量为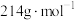 )。
)。
 (碘酸钾)常用的食盐加碘剂,某研究小组在实验室采用如下种方法进行
(碘酸钾)常用的食盐加碘剂,某研究小组在实验室采用如下种方法进行 的制备。
的制备。
已知:①
 是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。
是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。②
 在碱性条件下还原产物为一种不溶于水的沉淀。
在碱性条件下还原产物为一种不溶于水的沉淀。回答下列问题:
(1)甲装置中仪器A的名称是
(2)丁装置中发生反应的离子方程式为
(3)实验室还可以直接使用
 与KI溶液在强碱环境中制备
与KI溶液在强碱环境中制备 ,该反应的化学方程式为
,该反应的化学方程式为(4)反应结束后,将装置丙中溶液经如下操作可得到较为纯净的
 晶体:
晶体:
在获取碘酸钾产品的操作中,下列说法正确的是___________(填序号)。
| A.加热浓缩过程中需要使用三脚架、泥三角和坩埚等仪器 |
| B.在冷却结晶时,温度过低可能会有杂质析出导致产品不纯净 |
| C.采用“抽滤”代替“过滤”可使过滤速率加快 |
| D.为提高洗涤效果,可用热水进行洗涤 |
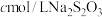 标准溶液滴定,当溶液呈淡黄色时,加入少许淀粉,平行滴定三次,平均消耗标准液
标准溶液滴定,当溶液呈淡黄色时,加入少许淀粉,平行滴定三次,平均消耗标准液 。已知:
。已知: 。
。①配制待测液过程中所需的玻璃仪器有:烧杯、胶头滴管、量筒、玻璃棒、
②滴定达到终点的现象为
③产品中
 的质量分数为
的质量分数为 的摩尔质量为
的摩尔质量为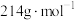 )。
)。
您最近一年使用:0次
3 . 碱式碳酸铜可用作有机催化剂。工业上以辉铜矿(主要成分为 ,含
,含 及少量
及少量 )为原料制备碱式碳酸铜,工业流程如下:
)为原料制备碱式碳酸铜,工业流程如下:
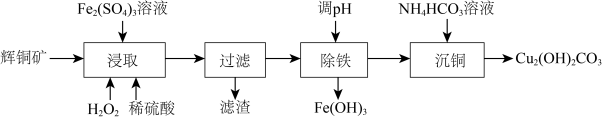
(1)滤渣可能含S、______ (填化学式)。
(2)①“浸取”时能提高辉铜矿Cu浸取率的措施有______ (填2条)。
②某小组测得Cu浸取率随 浓度及温度影响的变化曲线如下:
浓度及温度影响的变化曲线如下:

由图一可知 适宜的浓度范围为
适宜的浓度范围为______ :由图一中的a点分析,浸取时 也起到了氧化辉铜矿的作用,该反应的离子方程式为
也起到了氧化辉铜矿的作用,该反应的离子方程式为______ :图二中高于85℃时Cu浸取率下降的原因是______ 。
(3)“除铁”步骤调pH可加入试剂______ (填选项字母);
a.NaOH b.HCl c.CuO d.
(4)常温下,“过滤”后的滤液中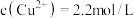 ,则“除铁”步骤调pH应小于
,则“除铁”步骤调pH应小于______ [常温下, ]。
]。
 ,含
,含 及少量
及少量 )为原料制备碱式碳酸铜,工业流程如下:
)为原料制备碱式碳酸铜,工业流程如下:
(1)滤渣可能含S、
(2)①“浸取”时能提高辉铜矿Cu浸取率的措施有
②某小组测得Cu浸取率随
 浓度及温度影响的变化曲线如下:
浓度及温度影响的变化曲线如下:
由图一可知
 适宜的浓度范围为
适宜的浓度范围为 也起到了氧化辉铜矿的作用,该反应的离子方程式为
也起到了氧化辉铜矿的作用,该反应的离子方程式为(3)“除铁”步骤调pH可加入试剂
a.NaOH b.HCl c.CuO d.

(4)常温下,“过滤”后的滤液中
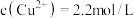 ,则“除铁”步骤调pH应小于
,则“除铁”步骤调pH应小于 ]。
]。
您最近一年使用:0次
名校
4 . 氧化还原滴定实验与中和滴定原理相似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之),也是分析化学中常用的分析手段。
Ⅰ.用 溶液滴定20.00mL浓度约为
溶液滴定20.00mL浓度约为 溶液。
溶液。
(1)该酸碱中和滴定实验最好选用______ (填标号)作指示剂。
A.酚酞 B.石蕊 C.甲基橙
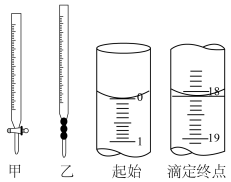
(2)实验所用仪器如图所示仪器甲盛装______ (填“NaOH”或“ ”溶液。若滴定开始和结束时,盛装
”溶液。若滴定开始和结束时,盛装 溶液的滴定管中的液面如图所示,终点读数为
溶液的滴定管中的液面如图所示,终点读数为______ mL
(3)在上述实验过程中,出现下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有______ (填序号)。
a.量取标准液的碱式滴定管未用标准液润洗
b.取醋酸的酸式滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失
c.锥形瓶用蒸馏水洗涤后,水未倒尽,仍残留一定量水
d.当滴定结束时,俯视碱式滴定管读数
Ⅱ.用氧化还原滴定方法测定粗品中 的质量分数。
的质量分数。
实验步骤:称取6g粗品配制250mL的溶液待用.用酸式滴定管取 溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的
溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的 溶液滴定至终点(反应为
溶液滴定至终点(反应为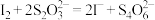 ),消耗
),消耗 溶液25.00mL。
溶液25.00mL。
回答下列问题:
(4)向 溶液中加入过量的KI溶液并酸化,
溶液中加入过量的KI溶液并酸化, 被还原成
被还原成 ,写出该反应的离子方程式:
,写出该反应的离子方程式:____________ 。
(5)用 溶液滴定至终点的现象为
溶液滴定至终点的现象为______ 。
(6)粗品中 的质量分数为
的质量分数为______ 。
(7)若在取 溶液时有部分溶液滴到了锥形瓶外。则测定结果
溶液时有部分溶液滴到了锥形瓶外。则测定结果______ (填“偏高”“偏氐”或“不变”)。
Ⅰ.用
 溶液滴定20.00mL浓度约为
溶液滴定20.00mL浓度约为 溶液。
溶液。(1)该酸碱中和滴定实验最好选用
A.酚酞 B.石蕊 C.甲基橙
(2)实验所用仪器如图所示仪器甲盛装
 ”溶液。若滴定开始和结束时,盛装
”溶液。若滴定开始和结束时,盛装 溶液的滴定管中的液面如图所示,终点读数为
溶液的滴定管中的液面如图所示,终点读数为
(3)在上述实验过程中,出现下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有
a.量取标准液的碱式滴定管未用标准液润洗
b.取醋酸的酸式滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失
c.锥形瓶用蒸馏水洗涤后,水未倒尽,仍残留一定量水
d.当滴定结束时,俯视碱式滴定管读数
Ⅱ.用氧化还原滴定方法测定粗品中
 的质量分数。
的质量分数。实验步骤:称取6g粗品配制250mL的溶液待用.用酸式滴定管取
 溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的
溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的 溶液滴定至终点(反应为
溶液滴定至终点(反应为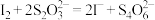 ),消耗
),消耗 溶液25.00mL。
溶液25.00mL。回答下列问题:
(4)向
 溶液中加入过量的KI溶液并酸化,
溶液中加入过量的KI溶液并酸化, 被还原成
被还原成 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(5)用
 溶液滴定至终点的现象为
溶液滴定至终点的现象为(6)粗品中
 的质量分数为
的质量分数为(7)若在取
 溶液时有部分溶液滴到了锥形瓶外。则测定结果
溶液时有部分溶液滴到了锥形瓶外。则测定结果
您最近一年使用:0次
名校
解题方法
5 . 下列有关离子方程式书写正确的是
A.硫酸铜溶液中滴入过量氨水:Cu2++2NH3•H2O=Cu(OH)2↓+2 |
| B.钢铁吸氧腐蚀的正极反应:O2+4e-+4H+=2H2O |
| C.FeSO4溶液中加入H2O2产生沉淀:2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+ |
D.向漂白液中通入少量二氧化碳:2ClO-+CO2+H2O=2HClO+ |
您最近一年使用:0次
名校
解题方法
6 . 高铁酸钾(K2FeO4,极易溶于水)是常见的水处理剂,其原理如图所示。

【资料】向胶体中加入电解质后,胶体因失去稳定性使分散质粒子聚集而产生沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
(1)K2FeO4中铁元素的化合价为___________ 。
(2)过程①中活性菌表现了___________ (填“氧化”或“还原”)性,该过程的还原产物是___________ (填离子符号);过程③属于___________ (填“物理”或“化学”)变化。
(3)根据上述原理,K2FeO4作水处理剂时,其主要作用有___________ (填两个)。
(4)可用次氯酸钾在碱性条件下与氢氧化铁反应得到K2FeO4,写出制备K2FeO4的离子方程式___________ ;由此可知,在碱性条件下 的氧化性
的氧化性___________ (填“>”、“=”或“<”) 。
。

【资料】向胶体中加入电解质后,胶体因失去稳定性使分散质粒子聚集而产生沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
(1)K2FeO4中铁元素的化合价为
(2)过程①中活性菌表现了
(3)根据上述原理,K2FeO4作水处理剂时,其主要作用有
(4)可用次氯酸钾在碱性条件下与氢氧化铁反应得到K2FeO4,写出制备K2FeO4的离子方程式
 的氧化性
的氧化性 。
。
您最近一年使用:0次
名校
7 . 一种从工业电解精炼铜的阳极泥(含有Se、Au、Ag、CuSe、Ag2Se等)中提取硒的过程如图所示。下列说法正确的是


| A.Se的核外电子排式为[Ar]4s24p4 |
| B.“焙烧”时,Ag2Se与O2反应每消耗1 mol O2,转移的电子总数为4 mol |
| C.甲酸还原H2SeO3反应的化学方程式为:H2SeO3+2HCOOH=Se↓+2CO2↑+3H2O |
| D.用得到的银可制得氯化银(晶胞如图所示),氯化银晶胞中Ag+周围最近且等距离的Ag+的数目为8 |
您最近一年使用:0次
2024-01-05更新
|
108次组卷
|
2卷引用:重庆市渝北中学校2023-2024学年高三下学期2月月考化学试题
名校
解题方法
8 . 锡基轴承合金的主要成分是锡(Sn)、铅(Pb)、锑(Sb)、铜(Cu),某工厂采用如下工艺实现成分金属的回收。

已知:“浸出液”中主要溶质为Na2SnO3、Na3SbO4、Na2PbO2均为强电解质。
回答下列问题:
(1)Sn与C同主族,则基态Sn原子的价层电子排布式为___________ 。
(2)“浸出渣”的主要成分为___________ 。
(3)“沉铅”时,该反应只有Na2PbO2与H2S等物质的量发生反应,___________ (填“是”或“不是”) 氧化还原反应; “沉铅”后溶液的 pH 值___________ (填“增大”“减小” 或 “不变” )。
(4)“沉锑”时发生反应的离子方程式为___________ ;(沉锑后主要溶质为Na2SnO3、NaOH)。
(5)“还原”时发生的反应类似于工业制粗硅,写出还原过程发生反应的化学方程式:___________ 。
(6)制得的粗锡中含有少量金属Pb、Sb,常采用电解法精炼。其中SnSO4溶液作为电解液,精锡连接电源的___________ 极。阳极泥中含有 Sb、PbSO4,则阳极的电极反应式为___________ 。

已知:“浸出液”中主要溶质为Na2SnO3、Na3SbO4、Na2PbO2均为强电解质。
回答下列问题:
(1)Sn与C同主族,则基态Sn原子的价层电子排布式为
(2)“浸出渣”的主要成分为
(3)“沉铅”时,该反应只有Na2PbO2与H2S等物质的量发生反应,
(4)“沉锑”时发生反应的离子方程式为
(5)“还原”时发生的反应类似于工业制粗硅,写出还原过程发生反应的化学方程式:
(6)制得的粗锡中含有少量金属Pb、Sb,常采用电解法精炼。其中SnSO4溶液作为电解液,精锡连接电源的
您最近一年使用:0次
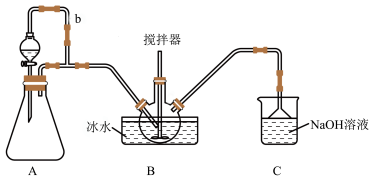
9 . 亚硝酰硫酸(NOSO4H)主要用重氮化反应。实验室将二氧化硫通入到硫酸和硝酸中发生氧化还原反应,硝酸被还原为亚硝酸,二氧化硫被氧化为三氧化硫(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
①B中反应仪器的名称为:___________ 。
②导管b的作用是___________ 。
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快___________ 。
(3)装置C涉及反应的离子方程式为___________ (用离子方程式表示)。
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是___________ 。
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取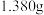 产品放入
产品放入 的碘量瓶中,加入
的碘量瓶中,加入 、
、 的
的 标准溶液和
标准溶液和 25%
25% 溶液,然后摇匀。用
溶液,然后摇匀。用 草酸钠标准溶液滴定,消耗草酸钠溶液的体积为
草酸钠标准溶液滴定,消耗草酸钠溶液的体积为 。
。
已知:
①写出 溶液与酸性
溶液与酸性 溶液反应的离子方程式:
溶液反应的离子方程式:___________ 。
②滴定终点时的现象为___________ 。
③亚硝酰硫酸的纯度=___________ 。(精确到0.01%)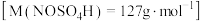
①B中反应仪器的名称为:
②导管b的作用是
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快
(3)装置C涉及反应的离子方程式为
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取
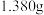 产品放入
产品放入 的碘量瓶中,加入
的碘量瓶中,加入 、
、 的
的 标准溶液和
标准溶液和 25%
25% 溶液,然后摇匀。用
溶液,然后摇匀。用 草酸钠标准溶液滴定,消耗草酸钠溶液的体积为
草酸钠标准溶液滴定,消耗草酸钠溶液的体积为 。
。已知:

①写出
 溶液与酸性
溶液与酸性 溶液反应的离子方程式:
溶液反应的离子方程式:②滴定终点时的现象为
③亚硝酰硫酸的纯度=
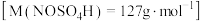
您最近一年使用:0次
2023-12-30更新
|
205次组卷
|
3卷引用:重庆市梁平区2023-2024学年高三上学期第二次调研考试化学试题
名校
10 . Ⅰ.配470 mL 0.10 mol/L  溶液,请回答下列问题:
溶液,请回答下列问题:
(1)计算需要 的质量为
的质量为___________ g。
(2)配制溶液时,现有天平、药匙、烧杯、量筒、玻璃棒,还需要的玻璃仪器有___________ 和___________ (填名称)。
(3)在此配制过程中,下列情况会使所得溶液的浓度偏高的是___________ (填序号)。
A.转移溶液时未洗涤烧杯和玻璃棒
B.定容时俯视刻度线观察液面
C.容量瓶用蒸馏水洗净后未干燥
D.称量固体时,砝码上沾有杂质
E.摇匀后静置,发现液面低于刻度线,再补加蒸馏水至刻度线
Ⅱ. 、
、 、
、 、
、 、
、 、
、 组成的一个氧化还原反应体系中,发生
组成的一个氧化还原反应体系中,发生 的反应过程。
的反应过程。
(4)①将以上物质分别填入下面对应的横线上,并配平化学方程式:________
___________+___________+___________=___________+___________+___________
②氧化剂是___________ 氧化产物是___________
③反应中若产生0.2 mol的还原产物,则有___________ mol电子转移。
 溶液,请回答下列问题:
溶液,请回答下列问题:(1)计算需要
 的质量为
的质量为(2)配制溶液时,现有天平、药匙、烧杯、量筒、玻璃棒,还需要的玻璃仪器有
(3)在此配制过程中,下列情况会使所得溶液的浓度偏高的是
A.转移溶液时未洗涤烧杯和玻璃棒
B.定容时俯视刻度线观察液面
C.容量瓶用蒸馏水洗净后未干燥
D.称量固体时,砝码上沾有杂质
E.摇匀后静置,发现液面低于刻度线,再补加蒸馏水至刻度线
Ⅱ.
 、
、 、
、 、
、 、
、 、
、 组成的一个氧化还原反应体系中,发生
组成的一个氧化还原反应体系中,发生 的反应过程。
的反应过程。(4)①将以上物质分别填入下面对应的横线上,并配平化学方程式:
___________+___________+___________=___________+___________+___________
②氧化剂是
③反应中若产生0.2 mol的还原产物,则有
您最近一年使用:0次
2023-12-30更新
|
60次组卷
|
2卷引用:重庆市第八中学校2022届高三下学期高考适应性月考(七)化学试题



