名校
解题方法
1 . 锰酸锂(LiMn2O4) 可作为某锂离子电池的正极材料,工业上利用软锰矿浆(主要成分为 MnO2,含少量 Fe2O3、FeO、Al2O3、SiO2。等杂质)吸收含硫烟气(主要成分 SO2) 制备锰酸锂,生产流程如图所示:

已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强;
②在此流程中部分金属阳离子生成氢氧化物沉淀的 pH 如下表:
(1)含硫烟气中 SO2的VSEPR模型为___________ 。
(2)含硫烟气在通入软锰矿浆前需要先冷却,冷却的原因是___________ 。
(3)请写出含硫烟气在通入软锰矿浆后与 MnO2发生反应的化学方程式:___________ 。
(4)滤液1中所含金属阳离子除 以外还有
以外还有___________ (填离子符号)。
(5)由“滤液1”得到“滤液2”同时回收 Al(OH)3的实验方案如下:边搅拌边向滤液1中加入___________ ,再加入NaOH溶液调节pH范围为___________ ,过滤得到滤液 2 和滤渣,请设计实验方案由滤渣制得纯净 Al(OH)3[Al(OH)3在 pH≥12时溶解]的实验方案:___________ 。
(6)在实际生产中, Li2CO3与 MnO2按物质的量之比1:4混合均匀在 600℃~750℃制取 LiMn2O4,请写出该反应的化学方程式:___________ 。
(7)为测定锰酸锂的纯度, 取2.00g产品置于锥形瓶中, 向其中加入2.68g Na2C2O4和足量硫酸,充分反应后,用0.100mol/L KMnO4标准溶液滴定未反应完的 H2C2O4,到达滴定终点时消耗标准 KMnO4溶液20.00mL,已知:
 则该产品中锰酸锂的质量分数为
则该产品中锰酸锂的质量分数为___________ 。

已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强;
②在此流程中部分金属阳离子生成氢氧化物沉淀的 pH 如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)含硫烟气中 SO2的VSEPR模型为
(2)含硫烟气在通入软锰矿浆前需要先冷却,冷却的原因是
(3)请写出含硫烟气在通入软锰矿浆后与 MnO2发生反应的化学方程式:
(4)滤液1中所含金属阳离子除
 以外还有
以外还有(5)由“滤液1”得到“滤液2”同时回收 Al(OH)3的实验方案如下:边搅拌边向滤液1中加入
(6)在实际生产中, Li2CO3与 MnO2按物质的量之比1:4混合均匀在 600℃~750℃制取 LiMn2O4,请写出该反应的化学方程式:
(7)为测定锰酸锂的纯度, 取2.00g产品置于锥形瓶中, 向其中加入2.68g Na2C2O4和足量硫酸,充分反应后,用0.100mol/L KMnO4标准溶液滴定未反应完的 H2C2O4,到达滴定终点时消耗标准 KMnO4溶液20.00mL,已知:

 则该产品中锰酸锂的质量分数为
则该产品中锰酸锂的质量分数为
您最近一年使用:0次
名校
解题方法
2 . I、地球上的金属矿物资源是有限的,应合理开发利用。
铜在自然界存在于多种矿石中,如:
(1)若 中Cu为+1价、Fe为+3价,高温焙烧时发生的反应是
中Cu为+1价、Fe为+3价,高温焙烧时发生的反应是 ,焙烧过程中被还原的元素有
,焙烧过程中被还原的元素有___________ 。
(2)工业上以辉铜矿为原料,采用火法熔炼工艺生产铜,火法炼铜的反应为: ,该反应中氧化剂是
,该反应中氧化剂是___________ ;
(3) 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为___________ 。
II. 是一种常用的氧化剂,工业上用途广泛
是一种常用的氧化剂,工业上用途广泛
(4)工业上可以用浓氨水检验输送氯气的管道是否泄漏,原理为
①该反应中氧化剂与还原剂的分子个数比为___________
②请用单线桥标出该反应中电子转移的方向和数目___________
(5) 与浓盐酸在一定温度下反应会生成氯气和黄绿色的易爆物质
与浓盐酸在一定温度下反应会生成氯气和黄绿色的易爆物质 ,化学方程式:
,化学方程式:
① 。
。___________
②浓盐酸在反应中显示出来的性质是___________ (填写编号)。
a.只有还原性 b.还原性和酸性 c.只有氧化性 d.氧化性和酸性
③若产生7.1g ,则生成
,则生成 的质量为
的质量为___________ g。
铜在自然界存在于多种矿石中,如:
| 矿石名称 | 黄铜矿 | 辉铜矿 | 孔雀石 |
| 主要成分 |  |  |  |
 中Cu为+1价、Fe为+3价,高温焙烧时发生的反应是
中Cu为+1价、Fe为+3价,高温焙烧时发生的反应是 ,焙烧过程中被还原的元素有
,焙烧过程中被还原的元素有(2)工业上以辉铜矿为原料,采用火法熔炼工艺生产铜,火法炼铜的反应为:
 ,该反应中氧化剂是
,该反应中氧化剂是(3)
 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为II.
 是一种常用的氧化剂,工业上用途广泛
是一种常用的氧化剂,工业上用途广泛(4)工业上可以用浓氨水检验输送氯气的管道是否泄漏,原理为

①该反应中氧化剂与还原剂的分子个数比为
②请用单线桥标出该反应中电子转移的方向和数目
(5)
 与浓盐酸在一定温度下反应会生成氯气和黄绿色的易爆物质
与浓盐酸在一定温度下反应会生成氯气和黄绿色的易爆物质 ,化学方程式:
,化学方程式:①
 。
。②浓盐酸在反应中显示出来的性质是
a.只有还原性 b.还原性和酸性 c.只有氧化性 d.氧化性和酸性
③若产生7.1g
 ,则生成
,则生成 的质量为
的质量为
您最近一年使用:0次
2023-09-27更新
|
142次组卷
|
2卷引用:重庆市第一中学校2023-2024学年高一上学期定时练习化学试题
名校
3 . 无水三氯化铬(CrCl3)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。通常是用不含水的三氧化二铬与卤化剂(如CCl4)在高温下反应,并使生成的三氯化铬在惰性气氛(如氮气)中升华来制取: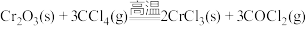 ,生成的COCl2(俗称光气)有毒,遇水发生水解,生成两种酸性气体,实验装置如图所示(夹持装置略)。
,生成的COCl2(俗称光气)有毒,遇水发生水解,生成两种酸性气体,实验装置如图所示(夹持装置略)。
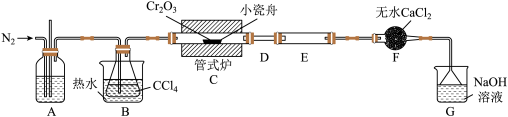
(1)A中的试剂为___________ ,长玻璃管的作用是___________ 。
(2)连接好装置后,先___________ ,再装入药品。在进行实验时,先___________ (填“通入N2”或“加热管式炉”);实验结束后,再持续通一段时间的N2,目的是___________ 。
(3)实验过程中若D处出现堵塞,应该采取的措施是___________ ,F中无水CaCl2的作用是___________ 。
(4)G装置的作用是___________ ,发生反应的离子方程式为___________ 。
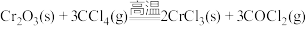 ,生成的COCl2(俗称光气)有毒,遇水发生水解,生成两种酸性气体,实验装置如图所示(夹持装置略)。
,生成的COCl2(俗称光气)有毒,遇水发生水解,生成两种酸性气体,实验装置如图所示(夹持装置略)。
(1)A中的试剂为
(2)连接好装置后,先
(3)实验过程中若D处出现堵塞,应该采取的措施是
(4)G装置的作用是
您最近一年使用:0次
2023-09-23更新
|
252次组卷
|
7卷引用:重庆市部分学校2023-2024学年高三一轮复习联考(一)化学试题
名校
4 . 工业上以软锰矿(含MnO2和少量的Fe2O3、Al2O3、SiO2)为原料制备硫酸锰晶体的流程如图所示,下列有关说法不正确的是

A.酸浸过程发生的主要反应的离子方程式为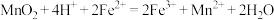 |
B.试剂A的目的是将过量 氧化为 氧化为 |
| C.试剂B可以是MnO或MnCO3 |
| D.滤渣1为H2SiO3,滤渣2为Fe(OH)3、Al(OH)3 |
您最近一年使用:0次
2023-09-23更新
|
466次组卷
|
9卷引用:重庆市部分学校2023-2024学年高三一轮复习联考(一)化学试题
名校
解题方法
5 . 以焙烧黄铁矿(主要成分 FeS2,杂质为 SiO2等)制取 SO2时产生的红渣为原料,制备铵铁蓝 Fe(NH4)[Fe(CN)6]颜料。工艺流程如下:

回答下列问题:
(1)焙烧黄铁矿发生的反应方程式为_____ ,滤渣①的主要成分为_____ (填化学式)。
(2)红渣研细的目的是_____ 。
(3)“还原”时,发生反应的化学方程式为_____ 。
(4)工序①得到绿矾(FeSO4·7H2O)和母液,则工序①的操作名称为_____ 。
(5)用 K3[Fe(CN)6]可检验工序①所得母液中的金属阳离子,检验时发生的离子方程式为_____ ,所得母液循环使用。
(6)沉铁工序产生的白色沉淀 Fe(NH4)2[Fe(CN)6]中Fe 的化合价为_____ ,氧化工序发生反应的离子方程式为_____ 。

回答下列问题:
(1)焙烧黄铁矿发生的反应方程式为
(2)红渣研细的目的是
(3)“还原”时,发生反应的化学方程式为
(4)工序①得到绿矾(FeSO4·7H2O)和母液,则工序①的操作名称为
(5)用 K3[Fe(CN)6]可检验工序①所得母液中的金属阳离子,检验时发生的离子方程式为
(6)沉铁工序产生的白色沉淀 Fe(NH4)2[Fe(CN)6]中Fe 的化合价为
您最近一年使用:0次
6 . 回答下列问题。
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表示为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O
(1)请用“双线桥”表示上述反应电子转移的方向和数目___________ 。
(2)请将上述反应改写成离子方程式___________ 。
(3)浓盐酸在反应中显示出来的性质是___________ (填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)若产生 71g Cl2,则被氧化的 HCl 为___________ g。
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比 Cl2、O2、ClO2、KMnO4 氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH 至饱和,使高铁酸钾析出。
(5)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是___________ 。(填化学式)
(6)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O。
、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:__________ 。
②每生成1个FeO 转移
转移___________ 个电子。
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表示为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O
(1)请用“双线桥”表示上述反应电子转移的方向和数目
(2)请将上述反应改写成离子方程式
(3)浓盐酸在反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)若产生 71g Cl2,则被氧化的 HCl 为
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比 Cl2、O2、ClO2、KMnO4 氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH 至饱和,使高铁酸钾析出。
(5)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是
(6)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、FeO
 、Cl-、H2O。
、Cl-、H2O。①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1个FeO
 转移
转移
您最近一年使用:0次
2023-08-19更新
|
548次组卷
|
2卷引用:重庆市大足中学2022-2023学年高一上学期第一次月考化学试题
名校
解题方法
7 . 下列离子方程式正确的是
| A.醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O |
B.向Ba(OH)2溶液中加入少量 NaHSO4 溶液:2H++ +Ba2++2OH-=BaSO4↓+2H2O +Ba2++2OH-=BaSO4↓+2H2O |
| C.醋酸钠和稀硫酸反应:CH3COO-+H+=CH3COOH |
D.酸性高锰酸钾溶液与稀草酸溶液反应:5C2O +2MnO +2MnO +16H+=2Mn2++10CO2↑+8H2O +16H+=2Mn2++10CO2↑+8H2O |
您最近一年使用:0次
名校
解题方法
8 . 下列反应的离子方程式正确的是
A.水杨酸与过量碳酸钠溶液反应:2 + +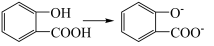 +2 +2 |
B.向碘化亚铁溶液中滴加少量稀硝酸: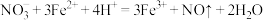 |
C.Mg(HCO3)2溶液中加足量的烧碱溶液: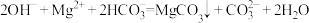 |
D.二元弱酸亚磷酸(H3PO3)溶液中滴加少量的NaOH溶液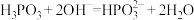 |
您最近一年使用:0次
2023-08-12更新
|
522次组卷
|
4卷引用:重庆市第七中学校2023-2024学年高三上学期月考(12月)化学试题
名校
解题方法
9 . PH3常作为一种熏蒸剂,在贮粮中用于防治害虫,一种制备PH3的流程如图所示:
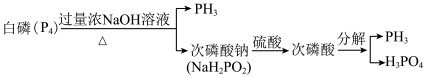
下列说法正确的是

下列说法正确的是
| A.流程中,每一步均属于氧化还原反应 |
| B.次磷酸的分子式为H3PO2,属于三元酸 |
C.白磷与浓NaOH溶液反应的化学方程式为:P4+3NaOH(浓)+3H2O PH3↑+3NaH2PO2 PH3↑+3NaH2PO2 |
| D.理论上,1 mol白磷可生产2.0 mol PH3 |
您最近一年使用:0次
2023-07-21更新
|
1043次组卷
|
9卷引用:重庆市石柱中学校2021-2022学年高三上学期第四次月考化学试题
重庆市石柱中学校2021-2022学年高三上学期第四次月考化学试题重庆育才中学2022届高考适应性考试二化学试题甘肃省天水市一中2021-2022学年高三上学期第二次阶段考试化学试题湖北省黄石市第二中学2023-2024学年高二上学期9月月考化学试题安徽省淮北市树人高级中学2023-2024学年高一上学期11月考试化学试题(已下线)考点01 物质的分类和转化-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点01 物质的分类和转化(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖南省长沙市雅礼中学2023-2024学年高二上学期入学考试化学试题山东省德州市第一中学2023-2024学年高三上学期开学考试化学试题
10 . 某容器中发生一个化学反应,反应过程中存在Fe2+、 、Fe3+、
、Fe3+、 、H+和H2O六种粒子,测得Fe3+、
、H+和H2O六种粒子,测得Fe3+、 的含量随时间变化的曲线如图所示,下列判断错误的是
的含量随时间变化的曲线如图所示,下列判断错误的是
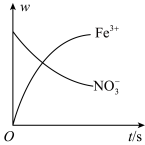
 、Fe3+、
、Fe3+、 、H+和H2O六种粒子,测得Fe3+、
、H+和H2O六种粒子,测得Fe3+、 的含量随时间变化的曲线如图所示,下列判断错误的是
的含量随时间变化的曲线如图所示,下列判断错误的是
| A.还原剂与氧化剂的微粒个数之比为1∶8 |
B.氧化性: >Fe3+ >Fe3+ |
| C.该反应中Fe2+被氧化为Fe3+ |
D. 被还原,发生还原反应 被还原,发生还原反应 |
您最近一年使用:0次
2023-07-10更新
|
312次组卷
|
3卷引用:重庆市巴蜀中学校2023-2024学年高一上学期10月月考化学试题



