23-24高三上·广东广州·阶段练习
名校
解题方法
1 . 碳酸锰MnCO3是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如图所示:

已知:①还原焙烧的主反应为2MnO2+C=2MnO+CO2↑
②氧化能力S2O >MnO
>MnO >
>
可能用到的数据如下:
根据要求回答下列问题:
(1)基态锰原子的价层电子排布式为_____ ,
(2)在实验室进行步骤A操作时,可能用到的主要仪器为_____ 。
A.坩埚 B.蒸发皿 C.烧杯
(3)步骤E中调节3.7<pH<8.3,其目的是_____ 。
(4)步骤G发生的离子方程式为___ ,若Mn2+恰好沉淀完全时测得溶液中CO 的浓度为2.2×10-6mol•L-1,则Ksp(MnCO3)=
的浓度为2.2×10-6mol•L-1,则Ksp(MnCO3)=_____ (mol/L)2。
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,S2O 中存在过氧键(-O-O-),请问S2O
中存在过氧键(-O-O-),请问S2O 中S的化合价为
中S的化合价为_____ 。请写出对应的离子方程式_____ 。

已知:①还原焙烧的主反应为2MnO2+C=2MnO+CO2↑
②氧化能力S2O
 >MnO
>MnO >
>
可能用到的数据如下:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
| 沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
(1)基态锰原子的价层电子排布式为
(2)在实验室进行步骤A操作时,可能用到的主要仪器为
A.坩埚 B.蒸发皿 C.烧杯
(3)步骤E中调节3.7<pH<8.3,其目的是
(4)步骤G发生的离子方程式为
 的浓度为2.2×10-6mol•L-1,则Ksp(MnCO3)=
的浓度为2.2×10-6mol•L-1,则Ksp(MnCO3)=(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,S2O
 中存在过氧键(-O-O-),请问S2O
中存在过氧键(-O-O-),请问S2O 中S的化合价为
中S的化合价为
您最近一年使用:0次
23-24高三上·广东深圳·期末
2 . 以软锰矿与黄铁矿为主要原料制备高品质 的工艺流程:
的工艺流程:
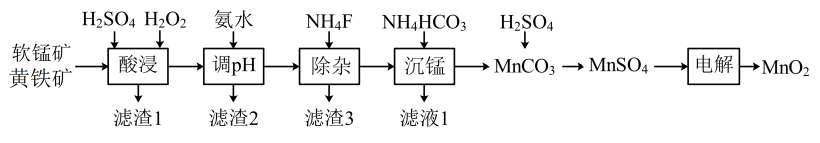
已知:①软锰矿与黄铁矿的主要成分分别为 、
、 ,还均含少量Fe、Ca、Mg、Al、Si等元素的氧化物;
,还均含少量Fe、Ca、Mg、Al、Si等元素的氧化物;
②该工艺条件下,相关金属离子形成氢氧化物沉淀的pH:
回答下列问题:
(1)基态 的价层电子排布图为
的价层电子排布图为___________ 。
(2)“酸浸”过程中,为提高反应速率可以采取的措施有___________ (写一条)。
(3)“酸浸”加入 后,主要反应的离子方程式:
后,主要反应的离子方程式:
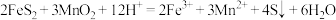

滤渣1的主要成分为S、___________ ,加入 后迅速产生大量气泡,可减少滤渣1在矿粉表面的附着,有利于酸浸。分析迅速产生气泡的原因:
后迅速产生大量气泡,可减少滤渣1在矿粉表面的附着,有利于酸浸。分析迅速产生气泡的原因:___________ 。
(4)“调pH”操作中需调节溶液pH范围为4.7~6.0,此时滤渣2的主要成分为___________ (填化学式)。
(5)“沉锰”步骤发生主要反应的离子方程式为___________ 。
(6)利用惰性电极电解 体系获得
体系获得 的机理如图所示,硫酸浓度与电流效率η的关系如图所示。硫酸浓度超过
的机理如图所示,硫酸浓度与电流效率η的关系如图所示。硫酸浓度超过 时,电流效率η降低的原因是
时,电流效率η降低的原因是___________ 。( )
)
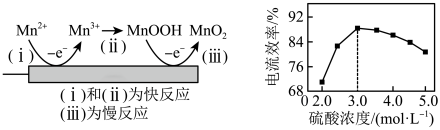
 的工艺流程:
的工艺流程:
已知:①软锰矿与黄铁矿的主要成分分别为
 、
、 ,还均含少量Fe、Ca、Mg、Al、Si等元素的氧化物;
,还均含少量Fe、Ca、Mg、Al、Si等元素的氧化物;②该工艺条件下,相关金属离子形成氢氧化物沉淀的pH:
| 金属离子 |  |  |  |  |  |
| 开始沉淀的pH | 6.9 | 1.9 | 6.6 | 9.1 | 3.4 |
沉淀完全( )的pH )的pH | 8.3 | 3.2 | 10.1 | 10.9 | 4.7 |
(1)基态
 的价层电子排布图为
的价层电子排布图为(2)“酸浸”过程中,为提高反应速率可以采取的措施有
(3)“酸浸”加入
 后,主要反应的离子方程式:
后,主要反应的离子方程式: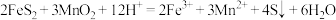

滤渣1的主要成分为S、
 后迅速产生大量气泡,可减少滤渣1在矿粉表面的附着,有利于酸浸。分析迅速产生气泡的原因:
后迅速产生大量气泡,可减少滤渣1在矿粉表面的附着,有利于酸浸。分析迅速产生气泡的原因:(4)“调pH”操作中需调节溶液pH范围为4.7~6.0,此时滤渣2的主要成分为
(5)“沉锰”步骤发生主要反应的离子方程式为
(6)利用惰性电极电解
 体系获得
体系获得 的机理如图所示,硫酸浓度与电流效率η的关系如图所示。硫酸浓度超过
的机理如图所示,硫酸浓度与电流效率η的关系如图所示。硫酸浓度超过 时,电流效率η降低的原因是
时,电流效率η降低的原因是 )
)
您最近一年使用:0次
2023·广东广州·一模
名校
3 . 载人航天器中的物质和能量资源都十分宝贵,我国科学家进行了如图所示的氧循环研究,实现了空间站中氧气的再生。下列说法不正确的是


| A.用于循环的氢原子利用率为100% |
| B.太阳能可作为反应①和②的能量来源 |
C.反应①为 |
D.等物质的量的 和 和 含有的电子数相同 含有的电子数相同 |
您最近一年使用:0次
2023-03-16更新
|
2051次组卷
|
8卷引用:专题08 氧化还原反应
22-23高三上·云南保山·期末
4 . 三氧化二砷(As2O3)可用于治疗急性早幼粒白血病。利用某酸性含砷废水(含 、H+、
、H+、 )可提取三氧化二砷,提取工艺流程如图所示:
)可提取三氧化二砷,提取工艺流程如图所示:

已知:①As2O3+6NaOH=2Na3AsO3+3H2O;
②As2S3易溶于过量的Na2S溶液中,加入FeSO4的目的是除去过量的S2-。
请回答下列问题:
(1)基态As原子的价层电子排布式为___________ 。
(2)操作M的名称是___________ ,滤液N中含有的阳离子有Fe2+、H+、___________ 。
(3)“焙烧”操作中,As2S3参与反应的化学方程式为___________ 。
(4)“碱浸”的目的是___________ 。
(5)“氧化”中发生反应的离子方程式为___________ 。
(6)砷化镓(GaAs)可由(CH3)3Ga和AsH3在700°C制得。已知GaAs的熔点为1238°C,其晶胞结构如图所示,该晶体的类型为___________ 。若阿伏加德罗常数的值为NA,GaAs的密度为ρg·cm-3,摩尔质量为Mg·mol-1,则GaAs的晶胞边长为___________ pm。

 、H+、
、H+、 )可提取三氧化二砷,提取工艺流程如图所示:
)可提取三氧化二砷,提取工艺流程如图所示:
已知:①As2O3+6NaOH=2Na3AsO3+3H2O;
②As2S3易溶于过量的Na2S溶液中,加入FeSO4的目的是除去过量的S2-。
请回答下列问题:
(1)基态As原子的价层电子排布式为
(2)操作M的名称是
(3)“焙烧”操作中,As2S3参与反应的化学方程式为
(4)“碱浸”的目的是
(5)“氧化”中发生反应的离子方程式为
(6)砷化镓(GaAs)可由(CH3)3Ga和AsH3在700°C制得。已知GaAs的熔点为1238°C,其晶胞结构如图所示,该晶体的类型为

您最近一年使用:0次
22-23高三上·广东茂名·期末
5 . 氧化亚铜主要用于制造船底防污漆(用来杀死低级海生动物)、杀虫剂,以及各种铜盐、分析试剂、红色玻璃,还用于镀铜及镀铜合金溶液的配制。用某铜矿(主要含CuS、FeO)制备 的一种工艺流程如下图:
的一种工艺流程如下图:

已知:常温下,相关金属离子生成氢氧化物沉淀的pH见表:
请回答下列问题:
(1)基态Cu原子价层电子的排布图为_______ 。
(2)滤渣的主要成分是_______ (填化学式)。
(3)“酸浸”中加入 的作用是
的作用是_______ ;写出其中生成单质S的化学方程式_______ 。
(4)“调pH”的范围是_______ 。
(5)“还原”前Cu元素以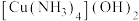 的形式存在,水合肼被氧化的化学方程式为
的形式存在,水合肼被氧化的化学方程式为_______ ;一定体积下,保持其它条件不变,水合肼浓度对 的产率的影响如图所示。当水合肼浓度大于
的产率的影响如图所示。当水合肼浓度大于 时,
时, 的转化率仍增大,但
的转化率仍增大,但 的产率下降,其可能的原因是
的产率下降,其可能的原因是_______ 。

(6)氧化亚铜立方晶胞结构如图所示,若规定A原子坐标是 ,C原子的坐标是
,C原子的坐标是 ,则B原子的坐标是
,则B原子的坐标是_______ ;该氧化物的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶胞中
,则该晶胞中 和
和 之间的最近距离为
之间的最近距离为_______ nm。(用含 、
、 的代数式表示)
的代数式表示)

 的一种工艺流程如下图:
的一种工艺流程如下图:
已知:常温下,相关金属离子生成氢氧化物沉淀的pH见表:
| 氢氧化物 |  |  |  |  |
| 开始沉淀的pH | 4.8 | 1.9 | 7.5 | 8.8 |
| 沉淀完全的pH | 6.4 | 3.2 | 9.7 | 10.4 |
(1)基态Cu原子价层电子的排布图为
(2)滤渣的主要成分是
(3)“酸浸”中加入
 的作用是
的作用是(4)“调pH”的范围是
(5)“还原”前Cu元素以
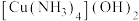 的形式存在,水合肼被氧化的化学方程式为
的形式存在,水合肼被氧化的化学方程式为 的产率的影响如图所示。当水合肼浓度大于
的产率的影响如图所示。当水合肼浓度大于 时,
时, 的转化率仍增大,但
的转化率仍增大,但 的产率下降,其可能的原因是
的产率下降,其可能的原因是
(6)氧化亚铜立方晶胞结构如图所示,若规定A原子坐标是
 ,C原子的坐标是
,C原子的坐标是 ,则B原子的坐标是
,则B原子的坐标是 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶胞中
,则该晶胞中 和
和 之间的最近距离为
之间的最近距离为 、
、 的代数式表示)
的代数式表示)
您最近一年使用:0次
2023-02-03更新
|
668次组卷
|
3卷引用:广东省深圳市2022-2023学年高三第一次调研考试变式题(工业流程题)
(已下线)广东省深圳市2022-2023学年高三第一次调研考试变式题(工业流程题)广东省茂名市第一中学2022-2023学年高三上学期期末化学诊断检测题重庆市2023届高三第一次联合诊断检测(一模)(康德卷)化学试题
2023·福建·一模
解题方法
6 .  法常用于处理汽车尾气中的
法常用于处理汽车尾气中的 。发动机工作时在稀燃(
。发动机工作时在稀燃( 充足、燃油较少)和富燃(
充足、燃油较少)和富燃( 不足、燃油较多)条件下交替进行,通过
不足、燃油较多)条件下交替进行,通过 和
和 的相互转化实现
的相互转化实现 的储存和还原,原理如图所示。下列说法错误的是
的储存和还原,原理如图所示。下列说法错误的是

 法常用于处理汽车尾气中的
法常用于处理汽车尾气中的 。发动机工作时在稀燃(
。发动机工作时在稀燃( 充足、燃油较少)和富燃(
充足、燃油较少)和富燃( 不足、燃油较多)条件下交替进行,通过
不足、燃油较多)条件下交替进行,通过 和
和 的相互转化实现
的相互转化实现 的储存和还原,原理如图所示。下列说法错误的是
的储存和还原,原理如图所示。下列说法错误的是
A.“稀燃”过程中 表面反应: 表面反应: |
B.燃油含硫时,“稀燃”过程生成的 会使 会使 吸收 吸收 能力下降 能力下降 |
C. 吸收 吸收 的反应中,氧化剂与还原剂的物质的量之比为 的反应中,氧化剂与还原剂的物质的量之比为 |
D.“富燃”过程中 表面反应: 表面反应: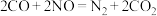 |
您最近一年使用:0次
22-23高三上·山东烟台·期末
7 . 工业上以铬矿渣(主要成分为 ,含有少量的
,含有少量的 )制备重要化工原料重铬酸钾
)制备重要化工原料重铬酸钾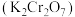 晶体的工艺流程如下:
晶体的工艺流程如下:
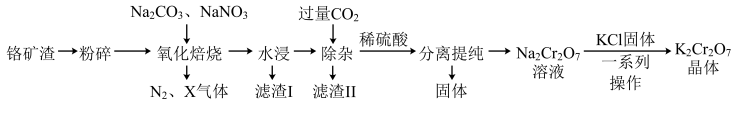
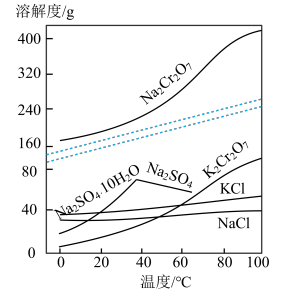
已知:①焙烧可将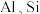 的氧化物转化为可溶性钠盐;②几种物质在水中的溶解度随温度变化的曲线如图。
的氧化物转化为可溶性钠盐;②几种物质在水中的溶解度随温度变化的曲线如图。
回答下列问题:
(1)“氧化焙烧”时, 被氧化生成
被氧化生成 的化学方程式为
的化学方程式为_______ 。
(2)“滤渣I”、“滤渣II”的主要成分分别是_______ 、_______ (填化学式):实验室中进行“除杂”操作用到的玻璃仪器有_______ 。
(3)分离提纯后得到固体的化学式为_______ ;“一系列操作”是_______ 、过滤、洗涤、干燥,最后得到 晶体。
晶体。
(4)生产过程中产生的含铬废水通常采用电解法处理,耐酸电解槽用铁板作阴阳极,槽中盛放含铬废水,原理如图所示。若不考虑气体的溶解,当收集到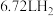 (标准状况下)时有
(标准状况下)时有_______ molCr2O 被还原,一段时间后产生
被还原,一段时间后产生 和
和 沉淀,若电解后溶液中
沉淀,若电解后溶液中 ,则
,则
_______  。(已知
。(已知 )
)

 ,含有少量的
,含有少量的 )制备重要化工原料重铬酸钾
)制备重要化工原料重铬酸钾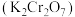 晶体的工艺流程如下:
晶体的工艺流程如下:
已知:①焙烧可将
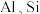 的氧化物转化为可溶性钠盐;②几种物质在水中的溶解度随温度变化的曲线如图。
的氧化物转化为可溶性钠盐;②几种物质在水中的溶解度随温度变化的曲线如图。
回答下列问题:
(1)“氧化焙烧”时,
 被氧化生成
被氧化生成 的化学方程式为
的化学方程式为(2)“滤渣I”、“滤渣II”的主要成分分别是
(3)分离提纯后得到固体的化学式为
 晶体。
晶体。(4)生产过程中产生的含铬废水通常采用电解法处理,耐酸电解槽用铁板作阴阳极,槽中盛放含铬废水,原理如图所示。若不考虑气体的溶解,当收集到
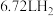 (标准状况下)时有
(标准状况下)时有 被还原,一段时间后产生
被还原,一段时间后产生 和
和 沉淀,若电解后溶液中
沉淀,若电解后溶液中 ,则
,则
 。(已知
。(已知 )
)
您最近一年使用:0次
2023·安徽宣城·模拟预测
名校
8 . 氧缺位体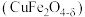 是热化学循环分解水制氢的氧化物体系。一种以黄铜矿(主要成分是
是热化学循环分解水制氢的氧化物体系。一种以黄铜矿(主要成分是 ,含
,含 、
、 等杂质)为原料制备
等杂质)为原料制备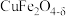 的流程如下:
的流程如下:

已知:①
②已知几种金属离子沉淀的 如表所示:
如表所示:
请回答下列问题:
(1)“焙烧”中生成了 、
、 ,写出“焙烧”中主要化学方程式:
,写出“焙烧”中主要化学方程式:_______ ,“焙烧”产生的 在有氧环境下利用石灰石浆液吸收可转变为
在有氧环境下利用石灰石浆液吸收可转变为_______ (填化学式)。
(2)“调 ”范围为
”范围为_______ ,从滤渣2中提取 的操作包括加入过量
的操作包括加入过量 溶液、过滤、向滤液通入过量的气体R,过滤、灼烧,气体R是
溶液、过滤、向滤液通入过量的气体R,过滤、灼烧,气体R是_______ (填化学式)
(3)“氧化”中 的作用是
的作用是_______ (用离子方程式表示)。
(4)“煅烧”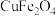 的化学方程式为
的化学方程式为_______ ,氧缺位值( )越大,活性越
)越大,活性越_______ (填“高”或“低”),与水反应制备 越容易。
越容易。
(5)钾、铁、硒形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示。已知:a、b、c的单位为 ,
, 为阿伏加德罗常数的数值,该晶体密度为
为阿伏加德罗常数的数值,该晶体密度为_______  (只列计算式)。
(只列计算式)。

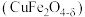 是热化学循环分解水制氢的氧化物体系。一种以黄铜矿(主要成分是
是热化学循环分解水制氢的氧化物体系。一种以黄铜矿(主要成分是 ,含
,含 、
、 等杂质)为原料制备
等杂质)为原料制备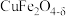 的流程如下:
的流程如下:
已知:①

②已知几种金属离子沉淀的
 如表所示:
如表所示:| 金属氢氧化物 |  |  |  |  |
开始沉淀的 | 2.7 | 7.6 | 4.0 | 6.4 |
完全沉淀的 | 3.7 | 9.6 | 5.2 | 7.6 |
(1)“焙烧”中生成了
 、
、 ,写出“焙烧”中主要化学方程式:
,写出“焙烧”中主要化学方程式: 在有氧环境下利用石灰石浆液吸收可转变为
在有氧环境下利用石灰石浆液吸收可转变为(2)“调
 ”范围为
”范围为 的操作包括加入过量
的操作包括加入过量 溶液、过滤、向滤液通入过量的气体R,过滤、灼烧,气体R是
溶液、过滤、向滤液通入过量的气体R,过滤、灼烧,气体R是(3)“氧化”中
 的作用是
的作用是(4)“煅烧”
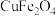 的化学方程式为
的化学方程式为 )越大,活性越
)越大,活性越 越容易。
越容易。(5)钾、铁、硒形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示。已知:a、b、c的单位为
 ,
, 为阿伏加德罗常数的数值,该晶体密度为
为阿伏加德罗常数的数值,该晶体密度为 (只列计算式)。
(只列计算式)。
您最近一年使用:0次
22-23高三上·辽宁·阶段练习
解题方法
9 . 军用设备中的电容材料为金属钽(Ta),其熔点高,抗酸腐蚀性强,但在碱性条件下可形成难溶的钽酸盐。研究人员设计由铌钽精矿[主要含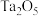 、
、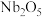 (五氧化二铌)、
(五氧化二铌)、 、
、 等]生产电容用钽粉的流程如下:
等]生产电容用钽粉的流程如下:

请回答下列问题:
(1)为了提高“酸解”速率可采取的措施是_______ (任答一点)。
(2)已知:在氢氟酸作用下,钽形成络离子,其形式与氢氟酸的浓度相关,概括为下表:
写出“酸解”时 发生反应的离子方程式:
发生反应的离子方程式:_______ 。
(3)“酸解”时得到的“浸渣”主要成分为_______ (填化学式),“废气”中除了挥发出的 还可能有
还可能有_______ (填化学式)。
(4)“系列操作”中煅烧操作若在实验室中进行,可选择下列哪个仪器?_______ (填代号)。

(5)“脱氧”步骤, 生成碱性氧化物。
生成碱性氧化物。
①写出该步骤发生反应的化学方程式:_______ 。
②下列金属冶炼方法与该步骤方法相似的是_______ (填代号)。
A.高炉炼铁 B.电解熔融氯化钠制钠 C.铝热反应制钨 D.氧化汞分解制汞
(6)“脱氧”得到的钽粉,经破碎后水洗,一般水洗工艺需加入盐酸并调节 为6以下,这样做的原因是
为6以下,这样做的原因是_______ 。
(7)一种钽酸钠的晶胞结构如图所示。请写出其化学式:_______ 。

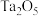 、
、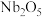 (五氧化二铌)、
(五氧化二铌)、 、
、 等]生产电容用钽粉的流程如下:
等]生产电容用钽粉的流程如下:
请回答下列问题:
(1)为了提高“酸解”速率可采取的措施是
(2)已知:在氢氟酸作用下,钽形成络离子,其形式与氢氟酸的浓度相关,概括为下表:
 溶质的质量分数 溶质的质量分数 |  |  |
| 钽的存在形式 |  |  |
写出“酸解”时
 发生反应的离子方程式:
发生反应的离子方程式:(3)“酸解”时得到的“浸渣”主要成分为
 还可能有
还可能有(4)“系列操作”中煅烧操作若在实验室中进行,可选择下列哪个仪器?

(5)“脱氧”步骤,
 生成碱性氧化物。
生成碱性氧化物。①写出该步骤发生反应的化学方程式:
②下列金属冶炼方法与该步骤方法相似的是
A.高炉炼铁 B.电解熔融氯化钠制钠 C.铝热反应制钨 D.氧化汞分解制汞
(6)“脱氧”得到的钽粉,经破碎后水洗,一般水洗工艺需加入盐酸并调节
 为6以下,这样做的原因是
为6以下,这样做的原因是(7)一种钽酸钠的晶胞结构如图所示。请写出其化学式:

您最近一年使用:0次
22-23高三上·广东茂名·阶段练习
解题方法
10 . 研究小组用氯气氧化K2MnO4制备KMnO4 (加热装置已省略),并利用产品进行实验探究。

(1)实验过程中装置连接顺序为_______ ,装置C的作用为_______ 。
(2)加热反应一段时间,观察到装置B中溶液由墨绿色变成紫红色后关闭分液漏斗活塞,停止加热,将KMnO4溶液减压过滤后,倒入蒸发皿中水浴蒸发浓缩、抽滤即得紫红色KMnO4固体。
①装置A中最合适的反应温度为80℃,需要采取的实验方法是_______ 。
②停止加热后,拆卸装置前应采取的实验操作为_______ 。
(3)小组用提纯后的KMnO4配成溶液与H2C2O4反应,探究H2C2O4浓度对反应速率的影响。利用下列试剂完成实验设计。提供试剂:蒸馏水,0.01 mol∙L-1 KMnO4溶液、0.2 mol∙L-1 H2C2O4溶液、0.5 mol∙L-1 H2SO4溶液
①实验中t1<t2,则a=_______ ,b=_______ 。
②在实验中Ⅰ、Ⅱ中观察到KMnO4溶液褪色速率开始时较慢,反应一段时间后逐渐加快。某同学查阅得知,存在如下反应历程

反应一段时间后褪色速度突然加快的原因为_______ ,历程中生成CO2的离子反应方程式为_______ 。
(4)取a g实验制得的KMnO4固体溶于水,加入过量的饱和Ba(OH)2溶液(KMnO4不参与反应)沉降 ,离心分离,将上层清液及沉淀的洗涤液均移至容量瓶,并配成100mL溶液。取20.00mL上述溶液于碘量瓶中,加入稀硫酸、过量10% KI溶液,放置一段时间后加入几滴1%淀粉指示剂,用0.0100 mol∙L-1 Na2S2O3标准溶液滴定,重复实验3次,平均消耗标准溶液b mL,该KMnO4的纯度为
,离心分离,将上层清液及沉淀的洗涤液均移至容量瓶,并配成100mL溶液。取20.00mL上述溶液于碘量瓶中,加入稀硫酸、过量10% KI溶液,放置一段时间后加入几滴1%淀粉指示剂,用0.0100 mol∙L-1 Na2S2O3标准溶液滴定,重复实验3次,平均消耗标准溶液b mL,该KMnO4的纯度为_______ (用含a、b的代数式表示)。[已知: ,
, ]
]

(1)实验过程中装置连接顺序为
(2)加热反应一段时间,观察到装置B中溶液由墨绿色变成紫红色后关闭分液漏斗活塞,停止加热,将KMnO4溶液减压过滤后,倒入蒸发皿中水浴蒸发浓缩、抽滤即得紫红色KMnO4固体。
①装置A中最合适的反应温度为80℃,需要采取的实验方法是
②停止加热后,拆卸装置前应采取的实验操作为
(3)小组用提纯后的KMnO4配成溶液与H2C2O4反应,探究H2C2O4浓度对反应速率的影响。利用下列试剂完成实验设计。提供试剂:蒸馏水,0.01 mol∙L-1 KMnO4溶液、0.2 mol∙L-1 H2C2O4溶液、0.5 mol∙L-1 H2SO4溶液
| 编号 | 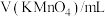 |  | 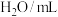 | 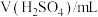 | 褪色时间/s |
| Ⅰ | 5.0 | 5.0 | 3 | 2 |  |
| Ⅱ | 5.0 | a | b | 2 |  |
②在实验中Ⅰ、Ⅱ中观察到KMnO4溶液褪色速率开始时较慢,反应一段时间后逐渐加快。某同学查阅得知,存在如下反应历程

反应一段时间后褪色速度突然加快的原因为
(4)取a g实验制得的KMnO4固体溶于水,加入过量的饱和Ba(OH)2溶液(KMnO4不参与反应)沉降
 ,离心分离,将上层清液及沉淀的洗涤液均移至容量瓶,并配成100mL溶液。取20.00mL上述溶液于碘量瓶中,加入稀硫酸、过量10% KI溶液,放置一段时间后加入几滴1%淀粉指示剂,用0.0100 mol∙L-1 Na2S2O3标准溶液滴定,重复实验3次,平均消耗标准溶液b mL,该KMnO4的纯度为
,离心分离,将上层清液及沉淀的洗涤液均移至容量瓶,并配成100mL溶液。取20.00mL上述溶液于碘量瓶中,加入稀硫酸、过量10% KI溶液,放置一段时间后加入几滴1%淀粉指示剂,用0.0100 mol∙L-1 Na2S2O3标准溶液滴定,重复实验3次,平均消耗标准溶液b mL,该KMnO4的纯度为 ,
, ]
]
您最近一年使用:0次



