名校
1 . 利用如图的装置制备NaBiO3(铋酸钠):
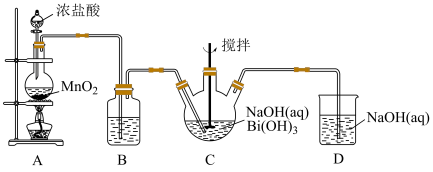
(1)A装置中反应的离子方程式:_________________ 。
(2)B装置中试剂是____________ 。
(3)C装置中白色固体完全反应后立即停止通入氯气,其原因是________________________ 。
(4)实验完毕后,为了提高产品纯度,需要的操作有_________ 、过滤、洗涤、干燥。
(5)写出装置C中发生反应的化学方程式:_________________________ 。
(6)探究NaBiO3的性质:
①在酸性条件下, 、NaBiO3、Cl2中氧化性最强的是
、NaBiO3、Cl2中氧化性最强的是___________ 。
②结合第(3)小题C装置中的反应,分析NaBiO3和Cl2氧化性强弱不一致的主要原因是_______________ 。

| 物质 | NaBiO3 | Bi(OH)3 |
| 性质 | 不溶于冷水、在酸性溶液中迅速分解;浅黄色 | 难溶于水、白色 |
(1)A装置中反应的离子方程式:
(2)B装置中试剂是
(3)C装置中白色固体完全反应后立即停止通入氯气,其原因是
(4)实验完毕后,为了提高产品纯度,需要的操作有
(5)写出装置C中发生反应的化学方程式:
(6)探究NaBiO3的性质:
| 实验 | 操作 | 现象 |
| Ⅰ | 取少量NaBiO3于试管中,加入浓盐酸,振荡;用镊子夹一块湿润的淀粉KI试纸放置在试管口上方 | 浅黄色固体溶解,产生黄绿色气体,试纸变蓝色 |
| Ⅱ | 在稀硫酸酸化的MnSO4溶液中加入NaBiO3粉末,振荡 | 无色溶液变紫红色溶液 |
 、NaBiO3、Cl2中氧化性最强的是
、NaBiO3、Cl2中氧化性最强的是②结合第(3)小题C装置中的反应,分析NaBiO3和Cl2氧化性强弱不一致的主要原因是
您最近一年使用:0次
名校
解题方法
2 . 用氧化焙烧-软锰矿浆吸收工艺处理砷华废渣,吸收液经净化除杂、浓缩结晶等工序可制备工业产品硫酸锰。

已知:a.砷华废渣中硫主要以FeS、FeS2、FeAsS、单质硫、硫酸盐等形态存在;铁主要以Fe2O3、FeAsS、FeS形态存在;砷主要以FeAsS、Fe3(AsO4)2等形态存在。
b.软锰矿吸收的过程中,除锰浸出外,还伴随着杂质Fe、Al、Ca、Pb和Si等的同时浸出。
c.SDD为二乙胺硫代甲酸钠。
d.溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)砷华废渣预先粉碎的目的是___ ;写出焙烧时FeAsS被氧气氧化成+3价金属氧化物和SO2的方程式:___ 。
(2)砷华废渣焙烧温度与Mn的浸出率的关系图如图:
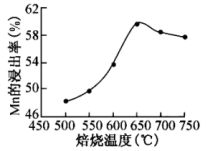
①焙烧的适宜温度为___ 。
②Mn的浸出率随着焙烧的温度升高而升高,温度高于650℃后,Mn的浸出率降低的可能原因是___ 。
(3)软锰矿浆(MnO2)吸收焙烧放出的SO2的化学方程式为___ 。
(4)加入MnO2粉末的目的是氧化Fe2+,其发生反应的离子方程式为___ 。
(5)根据实验目的调节pH的范围是___ 。
(6)称量产品MnSO4·H2O17.21g,溶于水,滴加足量的BaCl2溶液,生成的沉淀,经过过滤、洗涤、干燥后得固体,称量固体的质量为23.30g,则产品中MnSO4·H2O的质量分数为___ %(保留1位小数)。

已知:a.砷华废渣中硫主要以FeS、FeS2、FeAsS、单质硫、硫酸盐等形态存在;铁主要以Fe2O3、FeAsS、FeS形态存在;砷主要以FeAsS、Fe3(AsO4)2等形态存在。
b.软锰矿吸收的过程中,除锰浸出外,还伴随着杂质Fe、Al、Ca、Pb和Si等的同时浸出。
c.SDD为二乙胺硫代甲酸钠。
d.溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Pb2+ | Mn2+ |
| 开始沉淀时pH | 7.0 | 1.9 | 3.7 | 7.1 | 8.1 |
| 完全沉淀时pH | 9.0 | 3.2 | 4.7 | 9.1 | 10.1 |
(1)砷华废渣预先粉碎的目的是
(2)砷华废渣焙烧温度与Mn的浸出率的关系图如图:

①焙烧的适宜温度为
②Mn的浸出率随着焙烧的温度升高而升高,温度高于650℃后,Mn的浸出率降低的可能原因是
(3)软锰矿浆(MnO2)吸收焙烧放出的SO2的化学方程式为
(4)加入MnO2粉末的目的是氧化Fe2+,其发生反应的离子方程式为
(5)根据实验目的调节pH的范围是
(6)称量产品MnSO4·H2O17.21g,溶于水,滴加足量的BaCl2溶液,生成的沉淀,经过过滤、洗涤、干燥后得固体,称量固体的质量为23.30g,则产品中MnSO4·H2O的质量分数为
您最近一年使用:0次
2021-09-10更新
|
252次组卷
|
3卷引用:湖南省天壹名校联盟 2022届高三入学摸底考试化学试题
名校
3 . 某实验小组探究浅黄色草酸亚铁晶体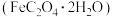 分解产物的装置如图所示。
分解产物的装置如图所示。
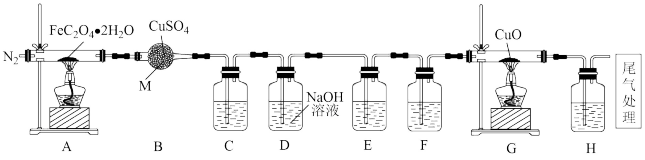
回答下列问题:
(1)仪器M的名称是_______ 。
(2)点燃酒精灯之前,先通入 ,其目的是
,其目的是_______ 。
(3)装置C的作用是_______ 。
(4)如果实验中观察到C、H变浑浊,E不变浑浊,可以得出实验结论:A装置中分解的气体产物一定有_______ (填化学式)。
(5)在 、
、 下进行上述实验,A装置中分别得到甲、乙两种黑色粉末,进行实验并观察到现象如下:
下进行上述实验,A装置中分别得到甲、乙两种黑色粉末,进行实验并观察到现象如下:
根据上述实验,实验①产生蓝色沉淀的离子方程式为_______ 。乙中的成分可能为_______ (填化学式)。
(6)A中固体完全反应后,持续通入 ,熄灭G处酒精灯之前,先
,熄灭G处酒精灯之前,先_______ (填“断开”或“不断开”)G和H之间的导管。
(7)测定草酸亚铁晶体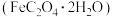 纯度。准确称取
纯度。准确称取 样品于锥形瓶,加入适量的稀硫酸,用
样品于锥形瓶,加入适量的稀硫酸,用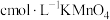 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。滴定反应:
。滴定反应: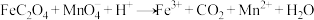 (未配平)。该样品纯度为
(未配平)。该样品纯度为_______ %。若滴定管没有用待装液润洗,测得结果_______ (填“偏高”、“偏低”或“无影响”)。
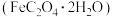 分解产物的装置如图所示。
分解产物的装置如图所示。
回答下列问题:
(1)仪器M的名称是
(2)点燃酒精灯之前,先通入
 ,其目的是
,其目的是(3)装置C的作用是
(4)如果实验中观察到C、H变浑浊,E不变浑浊,可以得出实验结论:A装置中分解的气体产物一定有
(5)在
 、
、 下进行上述实验,A装置中分别得到甲、乙两种黑色粉末,进行实验并观察到现象如下:
下进行上述实验,A装置中分别得到甲、乙两种黑色粉末,进行实验并观察到现象如下:| 实验 | 操作及现象 |
| ① | 用强磁铁接近甲,无明显现象;将黑色粉末溶于稀硫酸,滴加 溶液,产生蓝色沉淀 溶液,产生蓝色沉淀 |
| ② | 用强磁铁接近乙,吸起部分粉末,将吸起来的粉末投入盐酸中,产生气泡;将剩余黑色粉末溶于稀硫酸,滴加 溶液,产生蓝色沉淀 溶液,产生蓝色沉淀 |
(6)A中固体完全反应后,持续通入
 ,熄灭G处酒精灯之前,先
,熄灭G处酒精灯之前,先(7)测定草酸亚铁晶体
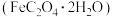 纯度。准确称取
纯度。准确称取 样品于锥形瓶,加入适量的稀硫酸,用
样品于锥形瓶,加入适量的稀硫酸,用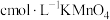 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。滴定反应:
。滴定反应: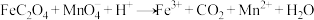 (未配平)。该样品纯度为
(未配平)。该样品纯度为
您最近一年使用:0次
4 . 如图是一套制取并验证氯气部分化学性质的实验装置。

回答下列问题:
(1)装置A中,仪器a的名称是_______ ,写出装置A中发生反应的离子方程式:_______ 。
(2)当有少量 通过后,观察到装置C中现象为
通过后,观察到装置C中现象为_______ 。
(3)当 持续通过时,装置D中现象为
持续通过时,装置D中现象为_______ 。
(4)若要证明 无漂白性,则必须在装置
无漂白性,则必须在装置_______ (填字母)之前增加装有浓硫酸的洗气装置。
(5)装置E的作用是_______ ,该反应的离子方程式为_______ 。
(6)ClO2是高效水处理剂,用NaClO2与NCl3反应可以制得ClO2.完成下列化学方程式并配平:_______ 。
_______NaClO2+_______NCl3+_______H2O→ _______ClO2↑+_______NH3↑+_______NaCl+_______

回答下列问题:
(1)装置A中,仪器a的名称是
(2)当有少量
 通过后,观察到装置C中现象为
通过后,观察到装置C中现象为(3)当
 持续通过时,装置D中现象为
持续通过时,装置D中现象为(4)若要证明
 无漂白性,则必须在装置
无漂白性,则必须在装置(5)装置E的作用是
(6)ClO2是高效水处理剂,用NaClO2与NCl3反应可以制得ClO2.完成下列化学方程式并配平:
_______NaClO2+_______NCl3+_______H2O→ _______ClO2↑+_______NH3↑+_______NaCl+_______
您最近一年使用:0次
名校
解题方法
5 . 高铁酸钾( )是一种高效多功能的新型非氯消毒剂,易溶于水、微溶于浓碱溶液,不溶于乙醇,在
)是一种高效多功能的新型非氯消毒剂,易溶于水、微溶于浓碱溶液,不溶于乙醇,在 的强碱性溶液中较稳定,在酸性至弱碱性条件下,能与水反应生成
的强碱性溶液中较稳定,在酸性至弱碱性条件下,能与水反应生成 和
和 。
。
Ⅰ.湿法制备高铁酸钾。主要的生产流程如图所示:
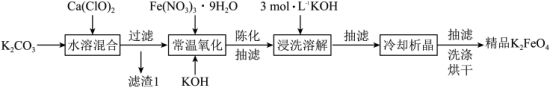
回答以下问题:
(1)滤渣1的主要成分为
(2)写出常温氧化过程的离子方程式
(3)氧化时需控温
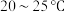 ,温度不能高于
,温度不能高于 原因是
原因是Ⅱ.某兴趣小组在实验室模拟湿法制备 ,装置如图所示:
,装置如图所示:
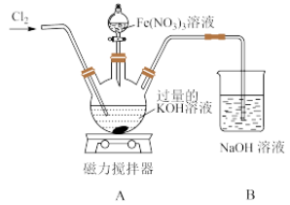
(4)通入的氯气不能过量的原因是
(5)制备的高铁酸钾粗产品中含有
 、
、 、
、 等杂质,请将以下提纯步骤补充完整,(实验药品:高铁酸钾粗产品、蒸馏水、乙醇、饱和
等杂质,请将以下提纯步骤补充完整,(实验药品:高铁酸钾粗产品、蒸馏水、乙醇、饱和 溶液、饱和
溶液、饱和 溶液、冷的稀
溶液、冷的稀 溶液、冰水)。
溶液、冰水)。①取一定量的高铁酸钾粗产品溶于
②过滤,将滤液置于冰水浴中,向滤液中加入饱和 溶液;
溶液;
③搅拌、静置、过滤,用 次,在真空干燥箱中干燥。
次,在真空干燥箱中干燥。
④实验结束时通入氮气的目的是
您最近一年使用:0次
解题方法
6 . 高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2.某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度。回答下列问题:
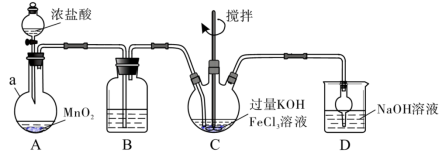
Ⅰ.制备K2FeO4
装置如下图所示,夹持、加热等装置略。___________ ,装置B中除杂质所用试剂是___________ ,装置D的作用是___________ 。
(2)A中发生反应的离子方程式为___________ 。
(3)C中反应为放热反应,而反应温度须控制在0~5℃,反应中KOH必须过量的原因是___________ 。
(4)写出C中总反应的离子方程式:___________ 。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
Ⅱ.K2FeO4产品纯度的测定
准确称取1.00 g制得的晶体,配成250 mL溶液,准确量取25.00 mL K2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00 mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00 mL。
(5)根据以上数据,样品中K2FeO4的质量分数为___________ 。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果___________ (填“偏高”“偏低”或“无影响”)。
Ⅰ.制备K2FeO4
装置如下图所示,夹持、加热等装置略。
(2)A中发生反应的离子方程式为
(3)C中反应为放热反应,而反应温度须控制在0~5℃,反应中KOH必须过量的原因是
(4)写出C中总反应的离子方程式:
Ⅱ.K2FeO4产品纯度的测定
准确称取1.00 g制得的晶体,配成250 mL溶液,准确量取25.00 mL K2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O
 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00 mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00 mL。(5)根据以上数据,样品中K2FeO4的质量分数为
您最近一年使用:0次
名校
解题方法
7 . 实验小组制备高铁酸钾( )并探究其性质。
)并探究其性质。
资料: 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)制备 。(夹持装置略)
。(夹持装置略)
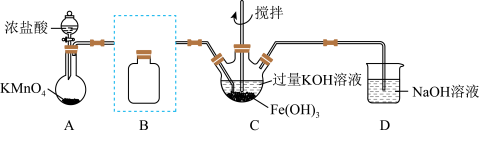
①A为氯气发生装置,A中反应的离子方程式是_______ 。
②将除杂装置B补充完整并标明所用试剂_______ 。
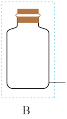
③C中得到紫色固体和溶液,C中 发生的反应有
发生的反应有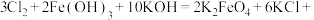
 ,另外还有
,另外还有_______ 。
(2)探究 的性质
的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
ⅰ.向沸水中逐滴滴加1mol/L  溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是
溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是_______ nm。
ⅱ.由方案上可知a中含有 离子,但该离子的产生不能判断一定是
离子,但该离子的产生不能判断一定是 将
将 氧化,还可能由
氧化,还可能由_______ 产生(用离子方程式表示)。
ⅲ.方案Ⅱ可证明 氧化了
氧化了 用KOH溶液洗涤的目的是
用KOH溶液洗涤的目的是_______ 。
②根据 的制备实验得出:氧化性
的制备实验得出:氧化性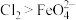 ,而方案Ⅱ实验表明,
,而方案Ⅱ实验表明, 和
和 的氧化性强弱关系相反,原因可能是
的氧化性强弱关系相反,原因可能是_______ 。
 )并探究其性质。
)并探究其性质。资料:
 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(1)制备
 。(夹持装置略)
。(夹持装置略)
①A为氯气发生装置,A中反应的离子方程式是
②将除杂装置B补充完整并标明所用试剂

③C中得到紫色固体和溶液,C中
 发生的反应有
发生的反应有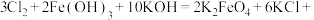
 ,另外还有
,另外还有(2)探究
 的性质
的性质①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案Ⅰ | 取少量a,经过检验溶液中含有 。 。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将 溶出,得到紫色溶液b,取少量b,滴加盐酸,有 溶出,得到紫色溶液b,取少量b,滴加盐酸,有 产生。 产生。 |
 溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是
溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是ⅱ.由方案上可知a中含有
 离子,但该离子的产生不能判断一定是
离子,但该离子的产生不能判断一定是 将
将 氧化,还可能由
氧化,还可能由ⅲ.方案Ⅱ可证明
 氧化了
氧化了 用KOH溶液洗涤的目的是
用KOH溶液洗涤的目的是②根据
 的制备实验得出:氧化性
的制备实验得出:氧化性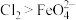 ,而方案Ⅱ实验表明,
,而方案Ⅱ实验表明, 和
和 的氧化性强弱关系相反,原因可能是
的氧化性强弱关系相反,原因可能是
您最近一年使用:0次
名校
解题方法
8 . 以软锰矿粉(含MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备电池级MnO2。
(1)浸取。将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入到三颈瓶中(如图)。70℃下通过满液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是_______ ;MnO2转化为Mn2+的离子方程式为_______ 。

(2)除杂。向已经除去Fe、Al、Si的MnSO4溶液(pH约为5)中加入NH4F溶液,溶液中Ca2+、Mg2+形成氟化物沉淀。若沉淀后上层清夜中c(F-)=0.05mol/L,则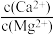 =
=_____ [Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9]
(3)制备MnCO3.在搅拌下向100mL1mol/LMnSO4溶液中缓慢滴加1mol/LNH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为_______ 。
(4)制备MnO2,MnCO3经热解、酸浸等步骤可制备MnO2。MnCO3在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(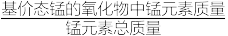 ×100%)随热解温度变化的曲线如图所示。
×100%)随热解温度变化的曲线如图所示。
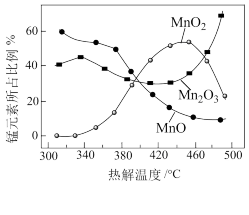
已知:MnO2与酸反应生成Mn2+;Mn2O3氧化性强于Cl2,加热条件下Mn2O3在酸性溶液中转化为MnO2和Mn2+。
为获得较高产率的MnO2,请补充实验方案:取一定量MnCO3置于热解装置中,通空气气流,加热到_______ 。将固体冷却后研成粉末,边搅摔边加入一定量_______ ,_______ ,充分反应后过滤,洗涤,_______ 。固体干燥,得到MnO2(可选用的试剂:1mol/LH2SO4溶液、2mol/LHCl溶液、0.1mo/LBaCl2溶液、0.1mol/LAgNO3溶液)。
(1)浸取。将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入到三颈瓶中(如图)。70℃下通过满液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是

(2)除杂。向已经除去Fe、Al、Si的MnSO4溶液(pH约为5)中加入NH4F溶液,溶液中Ca2+、Mg2+形成氟化物沉淀。若沉淀后上层清夜中c(F-)=0.05mol/L,则
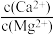 =
=(3)制备MnCO3.在搅拌下向100mL1mol/LMnSO4溶液中缓慢滴加1mol/LNH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为
(4)制备MnO2,MnCO3经热解、酸浸等步骤可制备MnO2。MnCO3在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(
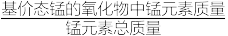 ×100%)随热解温度变化的曲线如图所示。
×100%)随热解温度变化的曲线如图所示。
已知:MnO2与酸反应生成Mn2+;Mn2O3氧化性强于Cl2,加热条件下Mn2O3在酸性溶液中转化为MnO2和Mn2+。
为获得较高产率的MnO2,请补充实验方案:取一定量MnCO3置于热解装置中,通空气气流,加热到
您最近一年使用:0次
2022-10-11更新
|
233次组卷
|
2卷引用:湖南省邵阳市第二中学2023-2024学年高二下学期入学考试化学试题
名校
解题方法
9 . 实验室用N2H4(肼,又名联氨,常温下为无色油状液体,沸点为113.5 ℃,具有与氨相似的气味,有弱碱性和较强的还原性)还原Cu(OH)2制备纳米Cu2O的装置(部分加热装置已省略)如图所示:已知:NaNO2溶液与NH4Cl溶液反应能得到N2。

下列说法不正确的是

下列说法不正确的是
| A.装置②⑥中分别盛装浓硫酸和稀硫酸 |
| B.无水硫酸铜由白色变为蓝色说明从装置④中出来的气体中含有水蒸气 |
C.装置④中发生反应的化学方程式为N2H4+4Cu(OH)2 2Cu2O+N2↑+6H2O 2Cu2O+N2↑+6H2O |
| D.加入反应试剂后,先打开K2,待装置④中反应完且冷却至室温,再打开K1排尽装置中的N2H4 |
您最近一年使用:0次
2022-03-31更新
|
981次组卷
|
9卷引用:湖南省常德市第二中学2021届高三上学期开学考试化学试题
湖南省常德市第二中学2021届高三上学期开学考试化学试题湖南省邵阳邵东市第一中学2021-2022学年高一下学期第一次月考化学试题湖南省娄底市双峰县第一中学2023届高三下学期第五次月考化学试题(已下线)专题14 无机综合运用(选择题)-2022年高考化学二轮复习重点专题常考点突破练重庆南开中学2021-2022学年高一下学期4月第一次月考化学试题福建省龙岩第一中学2022届高三下学期第一次模拟考试化学试题江苏省前黄高级中学2021-2022学年高一下学期4月调研考试化学试题河南省平顶山第一中学2022-2023学年高一下学期校内质量检测(一)化学试题福建省福州延安中学2023-2024学年高三上学期期中考试化学试题
解题方法
10 . 锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231 ℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为________ 。
(2)用于微电子器件生产的锡粉纯度测定:
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是__________________ ;此锡粉样品中锡的质量分数:____________ 。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
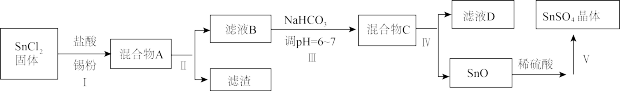
①步骤Ⅰ加入Sn粉的作用:____________________ 及调节溶液pH。
②步骤Ⅱ用到的玻璃仪器有烧杯、________________________ 。
③步骤Ⅲ生成SnO的离子方程式:__________________________ 。
④步骤Ⅳ中检验SnO是否洗涤干净的操作是___________________ ,证明已洗净。
⑤步骤Ⅴ操作依次为___________________ 、过滤、洗涤、低温干燥。
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:_____________ 。实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是_______________
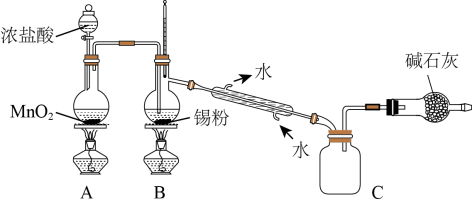
(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是______________________ 。
(1)元素锡比同主族碳的周期数大3,锡的原子序数为
(2)用于微电子器件生产的锡粉纯度测定:
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
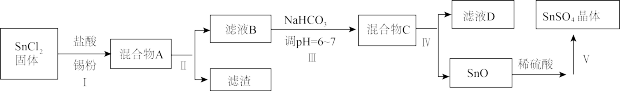
①步骤Ⅰ加入Sn粉的作用:
②步骤Ⅱ用到的玻璃仪器有烧杯、
③步骤Ⅲ生成SnO的离子方程式:
④步骤Ⅳ中检验SnO是否洗涤干净的操作是
⑤步骤Ⅴ操作依次为
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:

(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是
您最近一年使用:0次
2016-12-09更新
|
255次组卷
|
4卷引用:2017届湖南师大附中高三上学期入学摸底考试化学试卷



