名校
解题方法
1 . 下列化学实验操作过程中的离子方程式书写正确的是
A.用酸性高锰酸钾溶液滴定草酸溶液: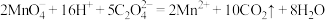 |
B.向 溶液中滴加过量氨水: 溶液中滴加过量氨水: |
C.用惰性电极电解 溶液: 溶液: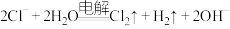 |
D.向 溶液中滴加过量溴水: 溶液中滴加过量溴水: |
您最近半年使用:0次
2024-03-08更新
|
144次组卷
|
3卷引用:陕西省延安市黄龙县中学2023-2024学年高三下学期开学考试理综试卷-高中化学
解题方法
2 . 从砷盐净化渣(主要成分为Cu、As、Zn、ZnO、Co和SiO2)中回收有利用价值的金属,解决了长期以来影响砷盐净化工艺推广的技术难题,具有较强的实践指导意义,其工艺流程如图所示。
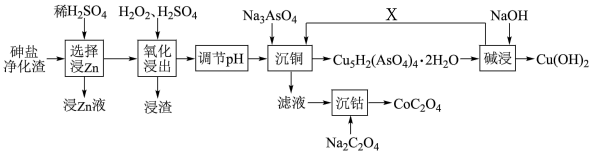
回答下列问题:
(1)在“选择浸Zn”之前,将砷盐净化渣进行粉碎的目的是_______ 。
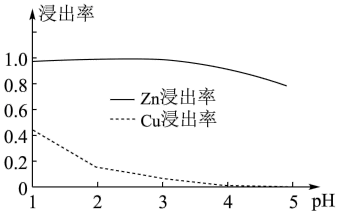
(2)其他条件不变时,Zn和Co的浸出率随pH变化如图所示,则“选择浸Zn”过程中,最好控制溶液的pH=_______ 。
(3)“氧化浸出”时,As被氧化为H3AsO4的化学方程式为_______ 。“浸渣”的主要成分为_______ (填化学式)。
(4)用NaOH溶液调节氧化浸出液至弱酸性,再加入Na3AsO4进行“沉铜”,得到难溶性的Cu5H2(AsO4)4·2H2O,则“沉铜”的离子方程式为_______ 。
(5)为测定草酸钴(CoC2O4)产品的纯度,现称取m g样品,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用c mol·L-1高锰酸钾标准液滴定,达到滴定终点时共消耗V mL高锰酸钾标准液,则该草酸钴产品的纯度为_______ (用含c、V、m的代数式表示)。若酸化时用盐酸代替硫酸,则测得的纯度将_______ (填“偏大”、“偏小”或“无影响”)。

回答下列问题:
(1)在“选择浸Zn”之前,将砷盐净化渣进行粉碎的目的是
(2)其他条件不变时,Zn和Co的浸出率随pH变化如图所示,则“选择浸Zn”过程中,最好控制溶液的pH=

(3)“氧化浸出”时,As被氧化为H3AsO4的化学方程式为
(4)用NaOH溶液调节氧化浸出液至弱酸性,再加入Na3AsO4进行“沉铜”,得到难溶性的Cu5H2(AsO4)4·2H2O,则“沉铜”的离子方程式为
(5)为测定草酸钴(CoC2O4)产品的纯度,现称取m g样品,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用c mol·L-1高锰酸钾标准液滴定,达到滴定终点时共消耗V mL高锰酸钾标准液,则该草酸钴产品的纯度为
您最近半年使用:0次
名校
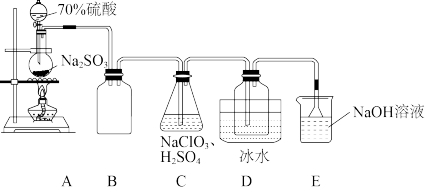
3 . 二氧化氯(ClO2)是一种高效消毒灭菌剂。某化学兴趣小组设计如图装置制备二氧化氯。
②ClO2+NaOH→NaCl+NaClO3+H2O(未配平)。
(1)装置A中盛装Na2S2O3的仪器名称为____ ;装置E中ClO2与NaOH的反应中还原剂与氧化剂的质量之比为____ ,装置E中倒置漏斗的作用是____ 。
(2)装置C中制得ClO2的同时还有硫酸的酸式盐生成,该反应的化学方程式为____ 。
(3)ClO2溶液现配现用,用水吸收ClO2得到ClO2溶液。为测定所得溶液中ClO2的含量,进行下列实验:
步骤1:准确量取20.00mLClO2溶液于锥形瓶中;
步骤2:调节锥形瓶中溶液pH≤2.0,再加入足量的KI晶体,静置片刻;
步骤3:加入2~3滴淀粉溶液作指示剂,用0.050mol·L-1的Na2S2O3溶液滴定至终点,进行平行实验3次,消耗Na2S2O3溶液的平均体积为16.00mL。[Na2S2O3+I2→Na2S2O6+NaI(未配平),Na2S2O3溶液不稳定易被氧化]
①Na2S2O3溶液应放在____ (填“酸式”或“碱式”)滴定管中;步骤2中反应的离子方程式为____ 。
②步骤3中,判断滴定达到终点的标志是____ 。
③根据实验数据,可算出原ClO2溶液中ClO2的浓度为____ mg·L-1。
④你认为下列可能造成测得的ClO2溶液中ClO2的物质的量浓度偏小的原因有____ (填标号)。
a.滴定管尖嘴处,滴定前有气泡,滴定后无气泡
b.滴定过程中由于振荡过于剧烈,使少量液体洒出锥形瓶
c.滴定前仰视Na2S2O3液面,滴定后俯视Na2S2O3液面
d.滴定中使用的Na2S2O3溶液敞口放置较长时间
②ClO2+NaOH→NaCl+NaClO3+H2O(未配平)。
(1)装置A中盛装Na2S2O3的仪器名称为
(2)装置C中制得ClO2的同时还有硫酸的酸式盐生成,该反应的化学方程式为
(3)ClO2溶液现配现用,用水吸收ClO2得到ClO2溶液。为测定所得溶液中ClO2的含量,进行下列实验:
步骤1:准确量取20.00mLClO2溶液于锥形瓶中;
步骤2:调节锥形瓶中溶液pH≤2.0,再加入足量的KI晶体,静置片刻;
步骤3:加入2~3滴淀粉溶液作指示剂,用0.050mol·L-1的Na2S2O3溶液滴定至终点,进行平行实验3次,消耗Na2S2O3溶液的平均体积为16.00mL。[Na2S2O3+I2→Na2S2O6+NaI(未配平),Na2S2O3溶液不稳定易被氧化]
①Na2S2O3溶液应放在
②步骤3中,判断滴定达到终点的标志是
③根据实验数据,可算出原ClO2溶液中ClO2的浓度为
④你认为下列可能造成测得的ClO2溶液中ClO2的物质的量浓度偏小的原因有
a.滴定管尖嘴处,滴定前有气泡,滴定后无气泡
b.滴定过程中由于振荡过于剧烈,使少量液体洒出锥形瓶
c.滴定前仰视Na2S2O3液面,滴定后俯视Na2S2O3液面
d.滴定中使用的Na2S2O3溶液敞口放置较长时间
您最近半年使用:0次
2022-08-23更新
|
371次组卷
|
4卷引用:陕西省西安市2023届高三上学期8月联考化学试题
名校
解题方法
4 . 碱式硫酸铁[Fe(OH)SO4]是一种絮疑剂,常用于污水处理。工业上利用废铁屑(含少量Al2O3、Fe2O3等)生产碱式硫酸铁的工艺流程如图所示。
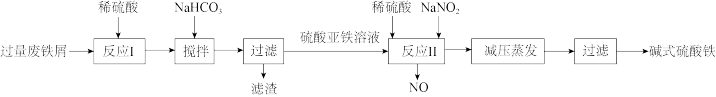
下列说法错误的是

下列说法错误的是
| A.“反应I”后的溶液中主要存在的阳离子有H+、Fe2+、Al3+ |
| B.“反应II”中加入稀硫酸可抑制Fe3+的水解 |
C.“反应II”对应的离子方程式为Fe2++NO +2H+=Fe3++NO↑+H2O +2H+=Fe3++NO↑+H2O |
| D.若用O2代替NaNO2,则每消耗112mL(标准状况)O2相当于节约了2.76gNaNO2 |
您最近半年使用:0次
2022-08-23更新
|
827次组卷
|
3卷引用:陕西省西安市2023届高三上学期8月联考化学试题
5 . 如图是某化学反应的微观示意图。下列有关说法正确的是


| A.该反应是复分解反应 |
B.反应方程式为NH3+O2 H2O+N2 H2O+N2 |
| C.生成物丙、丁的质量比为9:14 |
| D.反应前后只有一种元素的化合价不变 |
您最近半年使用:0次
2021-08-31更新
|
197次组卷
|
6卷引用:陕西省宝鸡市千阳县中学2022-2023学年新高一开学考试化学试题
6 . 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是
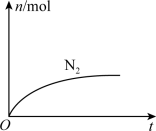

| A.该反应的还原剂是Cl- |
| B.消耗1 mol还原剂,转移6 mol电子 |
| C.氧化剂与还原剂的物质的量之比为2:3 |
| D.反应后溶液的酸性明显增强 |
您最近半年使用:0次
2020-06-16更新
|
645次组卷
|
36卷引用:陕西省榆林市绥德县绥德中学2019-2020学年高二下学期第二次阶段性测试化学试题
陕西省榆林市绥德县绥德中学2019-2020学年高二下学期第二次阶段性测试化学试题2016届陕西西安第一中学高三上学期期中考试化学试卷陕西省西安市长安区第五中学2019届高三上学期期中考试化学试题【市级联考】陕西省咸阳市2019届高三下学期第一次模拟考试化学试题陕西省榆林市绥德中学2022-2023学年高二上学期第二次阶段性考试化学试题(已下线)2014届北京市朝阳区高三上学期期末考试化学试卷(已下线)2015届黑龙江省双鸭山市第一中学高三9月月考化学试卷(已下线)2015届黑龙江省双鸭山一中高三9月月考化学试卷2016届湖北省天门中学高三普通班8月月考化学试卷2016届浙江省嘉兴、杭州、宁波五校高三上第一次联考化学试卷2016届河南省三门峡市灵宝三中高三上第四次质检化学试卷2017届河北武邑中学高三上学期周考(8.14)化学试题2017届河北省石家庄市辛集中学高三上第一次阶段考试化学卷2017届甘肃省兰州一中高三上12月月考化学试卷福建省永安一中、德化一中、漳平一中2017-2018学年高一上学期第二次联考化学试题湖北省来风县实验中学2018届高三上学期11月月考试化学试题(已下线)二轮复习 专题3 氧化还原反应 押题专练【全国百强校】甘肃省会宁县第一中学2019届高三上学期第一次月考理科综合化学试题甘肃省武威市第十八中学2019届高三第一次月考化学试题四川省德阳市第五中学2018-2019学年高二上学期10月月考化学试题河北省衡水市衡水中学2019届高三上学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(押题专练)福建省三明第一中学2020届高三上学期第二次月考化学试题2020届高三化学大二轮增分强化练——氧化还原反应夯基提能2020届高三化学选择题对题专练——氧化还原反应(强化练习)2020届高三化学总复习考点强化练习:物质及其变化(已下线)考点03 氧化还原反应-2020年高考化学命题预测与模拟试题分类精编高一必修第一册(鲁科2019)第2章第3节 氧化还原反应(已下线)湖南省湘潭县一中、双峰一中、邵东一中、永州四中2018-2019学年高一下学期优生联考化学试题江苏省宜兴第一中学2020-2021学年高一上学期期中考化学试题黑龙江省七台河市勃利县高级中学2021届高三上学期期中考试化学试题黑龙江省佳木斯市第一中学2021-2022学年高一上学期期中考试化学试题宁夏固原市第一中学2023届高三上学期第一次月考化学试题新疆实验中学2023-2024学年高一上学期10月月考化学试题浙江省瑞安中学2023-2024学年高一上学期12月月考化学试卷浙江省杭州学军中学2023-2024学年高一上学期期末模拟考试化学试卷
名校
7 . 下列离子方程式正确的是( )
| A.向FeO固体中加入少量稀硝酸:FeO+2H+=Fe2++H2O |
| B.向Na2S2O3溶液中加入过量稀硫酸:S2O32-+2H+=S↓+SO2↑+H2O |
| C.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
| D.向FeCl2溶液中加入氯水:Fe2++Cl2=Fe3++2Cl- |
您最近半年使用:0次
2019-09-17更新
|
328次组卷
|
5卷引用:陕西省咸阳市永寿县中学2021届高三上学期开学考试(摸底)化学试题
8 . 铁有许多重要的化合物,除中学化学常见的三种氧化物和两种氢氧化物外,还有许多盐。FeSO4·7H2O是一种浅绿色晶体,俗称绿矾,常用于处理含有氧化性离子的废水。现用绿矾对某工厂废水(含有强氧化性离子Cr2O72-)进行处理。
(1)绿矾除用铁粉与硫酸反应生成外,工业上还可用空气、水、黄铁矿(主要成分为FeS2)来制取。已知该反应除生成硫酸亚铁,还生成一种中学化学常见的强酸,试写出该反应的化学方程式:_______________________________________ 。
(2)试配平:____ Fe2++_____ Cr2O72- +__ ______ =______ Fe3++______ Cr3++______ H2O
(3)若该废水中Cr3+的含量为1×10-2mol·m-3,理论上83.4 kg绿矾可以处理该废水________ 吨(已知废水的密度为1 g·cm-3)。
(1)绿矾除用铁粉与硫酸反应生成外,工业上还可用空气、水、黄铁矿(主要成分为FeS2)来制取。已知该反应除生成硫酸亚铁,还生成一种中学化学常见的强酸,试写出该反应的化学方程式:
(2)试配平:
(3)若该废水中Cr3+的含量为1×10-2mol·m-3,理论上83.4 kg绿矾可以处理该废水
您最近半年使用:0次
2017-09-07更新
|
263次组卷
|
4卷引用:陕西省黄陵中学2018届高三(普通班)上学期开学考试化学试题
陕西省黄陵中学2018届高三(普通班)上学期开学考试化学试题2018年高一化学(人教版)必修1综合题型练习卷:氧化还原反应(已下线)【走进新高考】(人教版必修一)第二章 化学计量在实验中的应用 单元练习02(已下线)【走进新高考】(人教版必修一)第二章 化学物质及其变化 单元练习01
9 . 水泥的添加剂。以含钴废料(含少量 Fe、 Al 等杂质)制取CoCl26H2O的一种工艺如下:
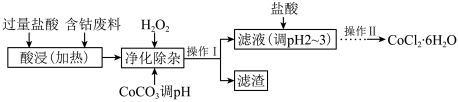
已知:
(1)净化除杂时,加入 H2O2发生反应的离子方程式为____________________________ 。
(2)加入CoCO3调 pH 为 5.2~7.6,则操作1获得的滤渣成分为_____________________ 。
(3)加盐酸调整pH为2~3的目的为__________________________________________ 。
(4)操作Ⅱ过程为蒸发浓缩、______________ (填操作名称)、过滤。

已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
(2)加入CoCO3调 pH 为 5.2~7.6,则操作1获得的滤渣成分为
(3)加盐酸调整pH为2~3的目的为
(4)操作Ⅱ过程为蒸发浓缩、
您最近半年使用:0次
10-11高三·陕西西安·开学考试
10 . 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂。以下是过氧化氢法生产亚氯酸钠的工艺流程图
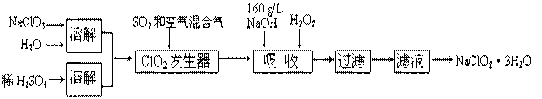
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②ClO2的沸点为283 K,纯ClO2易分解爆炸,常用稀有气体或空气稀释防止爆炸性分解
③HClO2在25 ℃时的电离常数与硫酸的第二步电离常数相当,可视为强酸。
(1)160g/L NaOH溶液的物质的量浓度为____________________ 。若要计算该溶液的质量分数,还需要的一个数据是__________________ 。
(2)ClO2发生器中所发生反应的离子方程式为__________________________
(3)吸收塔中为防止产生NaClO2被继续还原成NaCl,所用还原剂的还原性应适中。除H2O2处,还可以选择的还原剂是( ) (填序号)
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(4)写出吸收塔中发生反应的化学方程式____________________________
(5)从滤液中得到NaClO2·3H2O晶体还必须进行的操作是_____________ (填操作步骤)

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②ClO2的沸点为283 K,纯ClO2易分解爆炸,常用稀有气体或空气稀释防止爆炸性分解
③HClO2在25 ℃时的电离常数与硫酸的第二步电离常数相当,可视为强酸。
(1)160g/L NaOH溶液的物质的量浓度为
(2)ClO2发生器中所发生反应的离子方程式为
(3)吸收塔中为防止产生NaClO2被继续还原成NaCl,所用还原剂的还原性应适中。除H2O2处,还可以选择的还原剂是
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(4)写出吸收塔中发生反应的化学方程式
(5)从滤液中得到NaClO2·3H2O晶体还必须进行的操作是
您最近半年使用:0次



