名校
1 . 工业制备硝酸的过程中,会产生氮的氧化物等空气污染物。为减少环境污染,需要用氢氧化钠溶液吸收尾气,反应的化学方程式为 ,则
,则 的化学式为
的化学式为
 ,则
,则 的化学式为
的化学式为A. | B. | C. | D.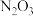 |
您最近半年使用:0次
名校
解题方法
2 . 取一定量的酸性 溶液依次进行下列实验,有关现象记录如下:
溶液依次进行下列实验,有关现象记录如下:
(1)能不能用盐酸酸化 溶液,为什么?
溶液,为什么?_______ 。
(2)酸性 溶液滴加适量
溶液滴加适量 ,紫红色褪去,并有无色气泡产生;反应的离子方程式为
,紫红色褪去,并有无色气泡产生;反应的离子方程式为_______ 。
再加入适量的固体 ,固体溶解,溶液又变为紫红色。
,固体溶解,溶液又变为紫红色。
(3) 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为_______ 。
 溶液依次进行下列实验,有关现象记录如下:
溶液依次进行下列实验,有关现象记录如下:(1)能不能用盐酸酸化
 溶液,为什么?
溶液,为什么?(2)酸性
 溶液滴加适量
溶液滴加适量 ,紫红色褪去,并有无色气泡产生;反应的离子方程式为
,紫红色褪去,并有无色气泡产生;反应的离子方程式为再加入适量的固体
 ,固体溶解,溶液又变为紫红色。
,固体溶解,溶液又变为紫红色。(3)
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为
您最近半年使用:0次
名校
3 . 高铁酸钾( )是一种新型、高效、多功能绿色水处理剂。
)是一种新型、高效、多功能绿色水处理剂。

资料:① 为紫色固体,干燥品在室温下稳定,在碱性溶液中较稳定。随着碱性的减弱,稳定性下降,与水反应放出氧气。
为紫色固体,干燥品在室温下稳定,在碱性溶液中较稳定。随着碱性的减弱,稳定性下降,与水反应放出氧气。
② 通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。
通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。
③ 与水反应还能产生具有强吸附性的
与水反应还能产生具有强吸附性的 胶体,可除去水中细微的悬浮物,有净水作用。
胶体,可除去水中细微的悬浮物,有净水作用。
(1)A为氯气发生装置,发生反应的化学方程式为_______ 。
(2)用“双线桥”表示上述化学方程式中电子转移的情况_______ 。
(3)装置C中制备 时,发生反应的离子方程式为
时,发生反应的离子方程式为_______ 。
(4)B中盛放的是_______ 溶液。D中发生反应的离子方程式为_______ 。
(5) 与水反应的化学方程式为
与水反应的化学方程式为_______ 。
 )是一种新型、高效、多功能绿色水处理剂。
)是一种新型、高效、多功能绿色水处理剂。
资料:①
 为紫色固体,干燥品在室温下稳定,在碱性溶液中较稳定。随着碱性的减弱,稳定性下降,与水反应放出氧气。
为紫色固体,干燥品在室温下稳定,在碱性溶液中较稳定。随着碱性的减弱,稳定性下降,与水反应放出氧气。②
 通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。
通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。③
 与水反应还能产生具有强吸附性的
与水反应还能产生具有强吸附性的 胶体,可除去水中细微的悬浮物,有净水作用。
胶体,可除去水中细微的悬浮物,有净水作用。(1)A为氯气发生装置,发生反应的化学方程式为
(2)用“双线桥”表示上述化学方程式中电子转移的情况
(3)装置C中制备
 时,发生反应的离子方程式为
时,发生反应的离子方程式为(4)B中盛放的是
(5)
 与水反应的化学方程式为
与水反应的化学方程式为
您最近半年使用:0次
名校
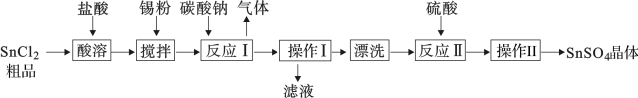
4 . SnCl2粗品中往往含有少量的SnCl4。SnSO4是一种重要的可溶性硫酸盐,广泛应用于镀锡工业,其制备路线如下:
回答下列问题:
(1)SnSO4中Sn的化合价为___________ 。
(2)加入锡粉搅拌时可能发生的化学反应为___________ 。
(3)操作I的名称是___________ ,在实验室进行操作II的步骤有___________ 、___________ 过滤、洗涤、干燥。
(4)滤液中溶质主要成分是___________ 。证明其中所含金属阳离子的方法是___________ 。

回答下列问题:
(1)SnSO4中Sn的化合价为
(2)加入锡粉搅拌时可能发生的化学反应为
(3)操作I的名称是
(4)滤液中溶质主要成分是
您最近半年使用:0次
名校
解题方法
5 . 海带中含有碘元素,从海带中提取碘的实验过程如下图所示。

(1)步骤①会用到下列仪器中的_______(填字母)。
(2)海带灰悬浊液含有I-。步骤④的试剂选用 、稀硫酸,离子方程式是
、稀硫酸,离子方程式是_______ 。
(3)步骤⑤“提取”包含以下四个过程。

①过程I使用的 体积明显小于含I2溶液,即可使I2几乎完全地转移至
体积明显小于含I2溶液,即可使I2几乎完全地转移至 中,推测I2在
中,推测I2在_______ (填“ ”或“
”或“ ”)中的溶解度更大。
”)中的溶解度更大。
②I2与 浓溶液反应的离子方程式是
浓溶液反应的离子方程式是_______ 。
③过程I→过程III的目的是_______ 。

(1)步骤①会用到下列仪器中的_______(填字母)。
| A.酒精灯 | B.漏斗 | C.坩埚 | D.泥三角 |
 、稀硫酸,离子方程式是
、稀硫酸,离子方程式是(3)步骤⑤“提取”包含以下四个过程。

①过程I使用的
 体积明显小于含I2溶液,即可使I2几乎完全地转移至
体积明显小于含I2溶液,即可使I2几乎完全地转移至 中,推测I2在
中,推测I2在 ”或“
”或“ ”)中的溶解度更大。
”)中的溶解度更大。②I2与
 浓溶液反应的离子方程式是
浓溶液反应的离子方程式是③过程I→过程III的目的是
您最近半年使用:0次
名校
解题方法
6 . 钴是一种重要战略物质,由钴催化剂废料(含Co2O3、Fe2O3、CuO等杂质)制备CoCO3和高效净水剂黄钠铁矾[NaFe3(SO4)2(OH)6]的工艺流程如图所示:

已知:(i)氧化性:Co3+>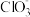 >Fe3+。
>Fe3+。
(ii)CoCO3、Co(OH)2、黄钠铁矾[NaFe3(SO4)2 (OH)6]均难溶于水。
(1)写出两条提高还原含钴废催化剂时浸取率的措施_______ 。
(2)“还原浸出”中,Co2O3被Na2SO3还原的化学方程式为_______ 。
(3)“氧化”中,被氧化的离子有_______ 。
(4)如图表示几种含铁物质稳定存在时与溶液和温度的关系,其中阴影部分表示黄钠铁矾。若工艺在100℃左右进行,为使铁转化为黄钠铁矾,应控制溶液的pH范围为_______ 。

(5)若选用MnS“除铜”,计算常温下“除铜”反应的平衡常数K=_______ [已知常温下,Ksp(MnS)=2.6 ×10-13,Kp (CuS)=1.3×10-36]。
(6)“沉钴”时,加入小苏打发生反应的离子反应方程式为_______ ,不宜用 Na2CO3代替NaHCO3的原因是_______ 。

已知:(i)氧化性:Co3+>
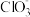 >Fe3+。
>Fe3+。(ii)CoCO3、Co(OH)2、黄钠铁矾[NaFe3(SO4)2 (OH)6]均难溶于水。
(1)写出两条提高还原含钴废催化剂时浸取率的措施
(2)“还原浸出”中,Co2O3被Na2SO3还原的化学方程式为
(3)“氧化”中,被氧化的离子有
(4)如图表示几种含铁物质稳定存在时与溶液和温度的关系,其中阴影部分表示黄钠铁矾。若工艺在100℃左右进行,为使铁转化为黄钠铁矾,应控制溶液的pH范围为

(5)若选用MnS“除铜”,计算常温下“除铜”反应的平衡常数K=
(6)“沉钴”时,加入小苏打发生反应的离子反应方程式为
您最近半年使用:0次
2022-08-25更新
|
828次组卷
|
5卷引用:甘肃省张掖市高台县第一中学2022-2023学年高三上学期开学第一次检测化学试题
甘肃省张掖市高台县第一中学2022-2023学年高三上学期开学第一次检测化学试题江苏省如东高级中学2023届高三上学期期初学情检测化学试题四川省乐山市高中2022届第一次调研考试理综化学试题江苏省泰州中学2022-2023学年高三上学期第一次月度检测化学试题(已下线)化学(全国乙卷理综卷)-学易金卷:2023年高考第一次模拟考试卷
名校
解题方法
7 . 元素铬(Cr)的几种化合物存在下列转化关系,下列判断不正确的是
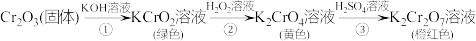
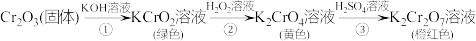
A.反应①表明 有酸性氧化物的性质 有酸性氧化物的性质 |
| B.反应②发生时应避免溶液温度过高 |
C.反应②的离子方程式为 |
| D.反应②、③中铬元素的化合价均发生了变化 |
您最近半年使用:0次
2022-08-16更新
|
929次组卷
|
6卷引用:甘肃省张掖市高台县第一中学2022-2023学年高二上学期开校检测化学试题
解题方法
8 . 某工厂以废料(主要含 ,还含少量的
,还含少量的 、
、 、
、 )为原料制备碳酸铈、氯化铈等铈产品的流程如下:
)为原料制备碳酸铈、氯化铈等铈产品的流程如下:
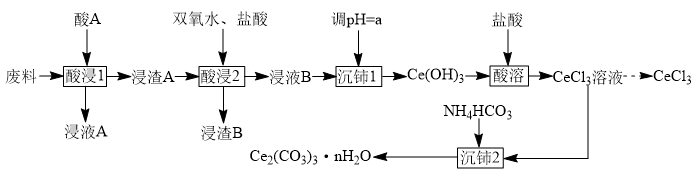
已知: 具有强氧化性,通常情况下不和无机酸反应。
具有强氧化性,通常情况下不和无机酸反应。
回答下列问题:
(1)为加快“酸浸1”的速率,可采取的措施是___________ (写一条即可)。
(2)检验“浸液 ”中含有
”中含有 的试剂是
的试剂是___________ (填化学式,下同)溶液,“浸渣 ”的主要成分为
”的主要成分为___________ 。
(3)“酸浸2”中双氧水的作用是___________ (用离子方程式回答)。
(4)获得 的方法:将
的方法:将 和
和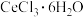 混合灼烧,得到
混合灼烧,得到 并放出能使品红溶液褪色的气体。加入
并放出能使品红溶液褪色的气体。加入 的原因是
的原因是___________ 。
(5)已知醋酸铵溶液呈中性,则 溶液中:
溶液中:
___________ (填“ ”、“
”、“ ”或“
”或“ ”)
”)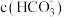 。
。
(6)测定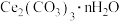 的纯度:
的纯度:
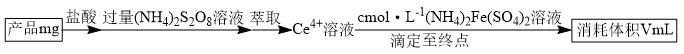
①已知 与
与 反应后的产物为
反应后的产物为 ,则该反应中氧化产物(
,则该反应中氧化产物( )与还原产物(
)与还原产物( )的物质的量之比为
)的物质的量之比为___________ 。
② 的纯度为
的纯度为___________  。[已知:
。[已知: 的摩尔质量为
的摩尔质量为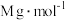 ]
]
③若其他操作均正确,滴定后俯视读数,则测得 的纯度
的纯度___________ (填“偏高”“偏低”或“无影响”)。
 ,还含少量的
,还含少量的 、
、 、
、 )为原料制备碳酸铈、氯化铈等铈产品的流程如下:
)为原料制备碳酸铈、氯化铈等铈产品的流程如下:
已知:
 具有强氧化性,通常情况下不和无机酸反应。
具有强氧化性,通常情况下不和无机酸反应。回答下列问题:
(1)为加快“酸浸1”的速率,可采取的措施是
(2)检验“浸液
 ”中含有
”中含有 的试剂是
的试剂是 ”的主要成分为
”的主要成分为(3)“酸浸2”中双氧水的作用是
(4)获得
 的方法:将
的方法:将 和
和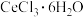 混合灼烧,得到
混合灼烧,得到 并放出能使品红溶液褪色的气体。加入
并放出能使品红溶液褪色的气体。加入 的原因是
的原因是(5)已知醋酸铵溶液呈中性,则
 溶液中:
溶液中:
 ”、“
”、“ ”或“
”或“ ”)
”)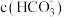 。
。(6)测定
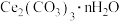 的纯度:
的纯度: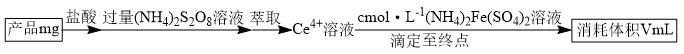
①已知
 与
与 反应后的产物为
反应后的产物为 ,则该反应中氧化产物(
,则该反应中氧化产物( )与还原产物(
)与还原产物( )的物质的量之比为
)的物质的量之比为②
 的纯度为
的纯度为 。[已知:
。[已知: 的摩尔质量为
的摩尔质量为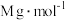 ]
]③若其他操作均正确,滴定后俯视读数,则测得
 的纯度
的纯度
您最近半年使用:0次
2021-08-30更新
|
273次组卷
|
4卷引用:甘肃省靖远县2021-2022学年高三上学期开学考试化学试题
名校
9 . H5IO6是白色晶体,易溶于水,在强酸溶液中能与Mn2+发生反应:_______Mn2++_______H5IO6=_______MnO +_______IO
+_______IO +_______H++_______H2O
+_______H++_______H2O
(1)配平上述离子反应_______ 。
(2)根据以上离子方程式判断,H5IO6是_______ (填“易”或“难”,下同)电离物质,HIO3是_______ 电离物质。
(3)上述反应中,被氧化的元素是_______ (填元素符号),当1molMn2+参加反应时,转移电子的物质的量为_______ 。
 +_______IO
+_______IO +_______H++_______H2O
+_______H++_______H2O(1)配平上述离子反应
(2)根据以上离子方程式判断,H5IO6是
(3)上述反应中,被氧化的元素是
您最近半年使用:0次



