名校
1 . 亚氯酸钠 主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下
主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下
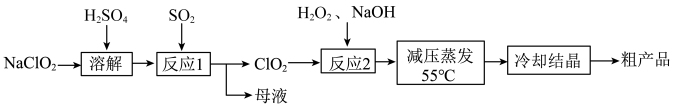
已知:①亚氯酸钠 受热易分解;②高浓度的
受热易分解;②高浓度的 易爆炸。
易爆炸。
(1) 与
与 因有强氧化性而用作常用消毒剂,消毒时均被还原为
因有强氧化性而用作常用消毒剂,消毒时均被还原为 ,则
,则 的消毒能力(转移电子的物质的量)是等质量的
的消毒能力(转移电子的物质的量)是等质量的 的
的______ 倍(保留小数点后一位)。“反应1”需要鼓入空气,空气的作用是______ 。
(2)“反应2”发生反应的化学方程式:______ 。“反应2”需要控制反应温度不能过高,温度过高可能导致______ 。
(3)从“母液”中可回收的主要物质是______ 。
(4)为探究 的氧化性,可以选择下列试剂
的氧化性,可以选择下列试剂______ 。根据选择的试剂,描述能体现 氧化性的实验现象是
氧化性的实验现象是______
A.淀粉-KI溶液 B.酸性高锰酸钾溶液 C.氯水 D. 溶液
溶液
 主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下
主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下
已知:①亚氯酸钠
 受热易分解;②高浓度的
受热易分解;②高浓度的 易爆炸。
易爆炸。(1)
 与
与 因有强氧化性而用作常用消毒剂,消毒时均被还原为
因有强氧化性而用作常用消毒剂,消毒时均被还原为 ,则
,则 的消毒能力(转移电子的物质的量)是等质量的
的消毒能力(转移电子的物质的量)是等质量的 的
的(2)“反应2”发生反应的化学方程式:
(3)从“母液”中可回收的主要物质是
(4)为探究
 的氧化性,可以选择下列试剂
的氧化性,可以选择下列试剂 氧化性的实验现象是
氧化性的实验现象是A.淀粉-KI溶液 B.酸性高锰酸钾溶液 C.氯水 D.
 溶液
溶液
您最近半年使用:0次
名校
解题方法
2 .  可用于催化剂载体及功能材料的制备。天然独居石的主要成分为
可用于催化剂载体及功能材料的制备。天然独居石的主要成分为 ,还含有
,还含有 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如图所示:
的工艺流程如图所示: 。
。
回答下列问题:
(1) 的空间结构为
的空间结构为_______ ,若在实验室进行“酸浸”,则不能使用玻璃仪器,原因是_______ 。
(2)滤渣1的主要成分是_______ (填化学式,下同),滤渣2的主要成分是_______ 。
(3)写出加入 、调
、调 时,生成沉淀的一个离子方程式:
时,生成沉淀的一个离子方程式:_______ 。
(4)已知 溶液显弱碱性,则
溶液显弱碱性,则 三者大小关系是
三者大小关系是_______ ,沉铈过程中会有一种气体产生,该气体是_______ (填化学式)。
(5) 与
与 、单质碳在高温下反应可得到用于制备电极材料的
、单质碳在高温下反应可得到用于制备电极材料的 ,同时伴随产生一种可燃性气体,反应的化学方程式为
,同时伴随产生一种可燃性气体,反应的化学方程式为_______ 。
(6)常温下, ,若
,若 恰好沉淀完全
恰好沉淀完全 时溶液的
时溶液的 ,则溶液中
,则溶液中
_______  。
。
 可用于催化剂载体及功能材料的制备。天然独居石的主要成分为
可用于催化剂载体及功能材料的制备。天然独居石的主要成分为 ,还含有
,还含有 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如图所示:
的工艺流程如图所示: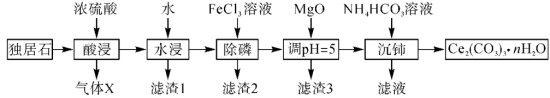
 。
。回答下列问题:
(1)
 的空间结构为
的空间结构为(2)滤渣1的主要成分是
(3)写出加入
 、调
、调 时,生成沉淀的一个离子方程式:
时,生成沉淀的一个离子方程式:(4)已知
 溶液显弱碱性,则
溶液显弱碱性,则 三者大小关系是
三者大小关系是(5)
 与
与 、单质碳在高温下反应可得到用于制备电极材料的
、单质碳在高温下反应可得到用于制备电极材料的 ,同时伴随产生一种可燃性气体,反应的化学方程式为
,同时伴随产生一种可燃性气体,反应的化学方程式为(6)常温下,
 ,若
,若 恰好沉淀完全
恰好沉淀完全 时溶液的
时溶液的 ,则溶液中
,则溶液中
 。
。
您最近半年使用:0次
2024-03-03更新
|
148次组卷
|
2卷引用:山东省菏泽市东明县第一中学2023-2024学年高三下学期开学化学试题
名校
解题方法
3 . 下列过程中的化学反应,相应的离子方程式正确的是
A.澄清石灰水中滴加少量 溶液: 溶液: |
B.用银氨溶液检验乙醛中的醛基: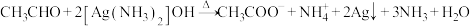 |
C.铅酸蓄电池充、放电原理: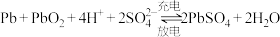 |
D.过量铁粉加入稀硝酸中: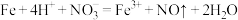 |
您最近半年使用:0次
2024-03-03更新
|
134次组卷
|
2卷引用:山东省菏泽市东明县第一中学2023-2024学年高三下学期开学化学试题
名校
4 . 二氧化铅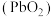 是一种强氧化剂,可以用作铅蓄电池的正极材料。
是一种强氧化剂,可以用作铅蓄电池的正极材料。 在酸性条件氧化
在酸性条件氧化 为
为 的方程式为
的方程式为 (方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是
(方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是
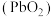 是一种强氧化剂,可以用作铅蓄电池的正极材料。
是一种强氧化剂,可以用作铅蓄电池的正极材料。 在酸性条件氧化
在酸性条件氧化 为
为 的方程式为
的方程式为 (方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是
(方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是A.X是 ,Y是 ,Y是 |
B.还原产物与氧化产物的物质的量之比为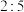 |
C.当生成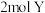 时,转移 时,转移 电子 电子 |
D.根据上述反应推测 不能氧化 不能氧化 |
您最近半年使用:0次
2024-02-27更新
|
188次组卷
|
3卷引用:山东省济宁市育才中学2023-2024学年高一下学期开学化学试题
名校
5 . 某工厂废液中含有大量的 、
、 及少量的
及少量的 、
、 ,利用该废液制备
,利用该废液制备 的流程如下:
的流程如下:
称取m g产品溶解于大量较浓盐酸中,在 氛围下用适量还原剂恰好将
氛围下用适量还原剂恰好将 还原为
还原为 ,用
,用 的
的 标准液滴定,终点时消耗标准液V mL。
标准液滴定,终点时消耗标准液V mL。
已知:①氧化性 ;
;
②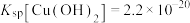 ,
,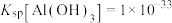 ;
;
③当溶液中离子浓度小于等于 时,可认为该离子沉淀完全。
时,可认为该离子沉淀完全。
根据上述产品含量测定的实验原理,下列说法错误的是
 、
、 及少量的
及少量的 、
、 ,利用该废液制备
,利用该废液制备 的流程如下:
的流程如下: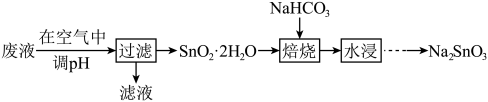
称取m g产品溶解于大量较浓盐酸中,在
 氛围下用适量还原剂恰好将
氛围下用适量还原剂恰好将 还原为
还原为 ,用
,用 的
的 标准液滴定,终点时消耗标准液V mL。
标准液滴定,终点时消耗标准液V mL。已知:①氧化性
 ;
;②
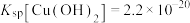 ,
,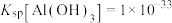 ;
;③当溶液中离子浓度小于等于
 时,可认为该离子沉淀完全。
时,可认为该离子沉淀完全。根据上述产品含量测定的实验原理,下列说法错误的是
A.实验室配制 溶液时需加入盐酸和锡粉 溶液时需加入盐酸和锡粉 |
| B.若加入的还原剂不足,则测定结果偏小 |
C.滴定时选用淀粉作指示剂,产生 的离子方程式: 的离子方程式: |
D.则产品中Sn的质量分数为 % % |
您最近半年使用:0次
解题方法
6 . 硝酸铈(Ⅳ)铵的化学式为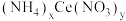 ,是一种橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验进行制备并测定其化学式。
,是一种橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验进行制备并测定其化学式。
步骤一:NH4HCO3溶液与CeCl3溶液反应制备Ce2(CO3)3。
已知:①氮化钙遇水可迅速产生NH3;②Ce(Ⅲ)易被空气氧化成Ce(Ⅳ)。___________ ,装置C的作用是___________ 。该实验以氮化钙和水制备NH3应选择装置___________ (填“A”或“D”)。
(2)实验时,“a”、“b”、“c”三个旋塞的打开顺序为___________ 。装置B中发生反应的离子方程式为___________ 。
(3)该实验装置存在的一处缺陷为___________ 。
步骤二:制备硝酸铈(Ⅳ)铵___________ 。
(5)“烘干”采取自然干燥的原因为___________ 。
步骤三:测定化学式
①称取一定质量的硝酸铈(Ⅳ)铵,充分灼烧得CeO2mg。
②另称取相同质量的硝酸铈(Ⅳ)铵,加入足量NaOH溶液微热,将产生的气体全部用V1mL水吸收。将吸收液滴入甲基橙,用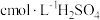 标准溶液滴定,重复2~3次,平均消耗H2SO4标准溶液V2mL。
标准溶液滴定,重复2~3次,平均消耗H2SO4标准溶液V2mL。
(6)计算y=___________ (用上述字母表示)。
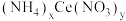 ,是一种橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验进行制备并测定其化学式。
,是一种橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验进行制备并测定其化学式。步骤一:NH4HCO3溶液与CeCl3溶液反应制备Ce2(CO3)3。
已知:①氮化钙遇水可迅速产生NH3;②Ce(Ⅲ)易被空气氧化成Ce(Ⅳ)。
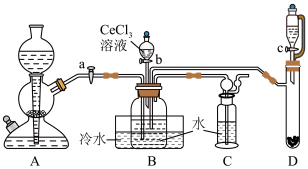
(2)实验时,“a”、“b”、“c”三个旋塞的打开顺序为
(3)该实验装置存在的一处缺陷为
步骤二:制备硝酸铈(Ⅳ)铵

(5)“烘干”采取自然干燥的原因为
步骤三:测定化学式
①称取一定质量的硝酸铈(Ⅳ)铵,充分灼烧得CeO2mg。
②另称取相同质量的硝酸铈(Ⅳ)铵,加入足量NaOH溶液微热,将产生的气体全部用V1mL水吸收。将吸收液滴入甲基橙,用
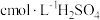 标准溶液滴定,重复2~3次,平均消耗H2SO4标准溶液V2mL。
标准溶液滴定,重复2~3次,平均消耗H2SO4标准溶液V2mL。(6)计算y=
您最近半年使用:0次
2024-02-02更新
|
247次组卷
|
3卷引用:山东省临沂市郯城县美澳学校2023-2024学年高三下学期开学考试化学试题
7 . 综合处理含SO2的尾气工艺流程如图。下列说法正确的是

A.“吸收”过程发生的反应为 |
B.可用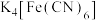 溶液检验“氧化”是否完全 溶液检验“氧化”是否完全 |
C.综合处理的总反应为 |
| D.向煤中加入石灰石可实现脱硫减排,该过程存在氧化还原反应 |
您最近半年使用:0次
2024-02-02更新
|
355次组卷
|
3卷引用:山东省临沂市郯城县美澳学校2023-2024学年高三下学期开学考试化学试题
名校
解题方法
8 . 从干海带中提取碘的实验流程如下:
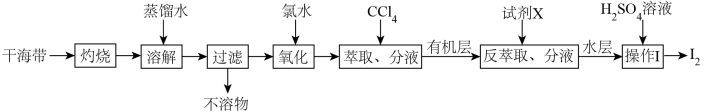
| A.氧化步骤中氯水可用过氧化氢代替 |
B.试剂X可以为 ,反萃取的离子方程式为: ,反萃取的离子方程式为: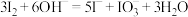 |
C. 可循环利用以有效提高干海带提碘的产率 可循环利用以有效提高干海带提碘的产率 |
| D.操作Ⅰ要用到普通漏斗、烧杯和玻璃棒 |
您最近半年使用:0次
2024-01-28更新
|
561次组卷
|
4卷引用:山东省烟台市莱州市第一中学2023-2024学年高一下学期开学化学试题
解题方法
9 . 钽(Ta)和铌(Nb)是性质相似的两种单质,一种以钽铌伴生矿(主要成分为SiO2、MnO2、Nb2O5、Ta2O5和少量的TiO2、FeO、CaO、MgO)为原料制取钽和铌的流程如下:

“浸取”后的浸出液中含有H2TaF7、H2NbF7两种二元强酸和锰、钛等元素。
已知:①MIBK为甲基异丁基酮;
② ,
, ,
, 。
。
(1)加快“浸取”速率可采取的措施是___________ 。
(2)浸渣的主要成分是___________ ,Ta2O5与氢氟酸反应的离子方程式为___________ 。
(3)MIBK“萃取”时可分为扩散萃取和动力学萃取两种类型。浸出液中钽的萃取率随搅拌速度的增加而进一步增加时为扩散萃取,若浸出液受到化学反应的控制则萃取类型将变为动力学萃取。搅拌速度对钽萃取率的影响如图所示。

搅拌速度在150rpm时的萃取类型为___________ ,350rpm到400rpm时但萃取率不再增加的原因是___________ 。
(4)金属铌可用金属钠还原K2NbF7,制取,也可用电解熔融的K2NbF7,制取。
①流程中钠热还原法制备铌粉的化学方程式为___________ 。
②传统的熔盐电解法采用的电解质体系通常为K2NbF7-NaCl,利用该方法制备1 mol Nb理论上消耗NaCl的物质的量为___________ mol。

“浸取”后的浸出液中含有H2TaF7、H2NbF7两种二元强酸和锰、钛等元素。
已知:①MIBK为甲基异丁基酮;
②
 ,
, ,
, 。
。(1)加快“浸取”速率可采取的措施是
(2)浸渣的主要成分是
(3)MIBK“萃取”时可分为扩散萃取和动力学萃取两种类型。浸出液中钽的萃取率随搅拌速度的增加而进一步增加时为扩散萃取,若浸出液受到化学反应的控制则萃取类型将变为动力学萃取。搅拌速度对钽萃取率的影响如图所示。

搅拌速度在150rpm时的萃取类型为
(4)金属铌可用金属钠还原K2NbF7,制取,也可用电解熔融的K2NbF7,制取。
①流程中钠热还原法制备铌粉的化学方程式为
②传统的熔盐电解法采用的电解质体系通常为K2NbF7-NaCl,利用该方法制备1 mol Nb理论上消耗NaCl的物质的量为
您最近半年使用:0次
10 . 黄铁矿制硫酸的副产物硒酸泥中含有较高品位的硒元素(其主要成分含量如下表所示),硒酸泥可用于制取硒单质。
步骤1:粗硒的制备

步骤2:粗硒的精制
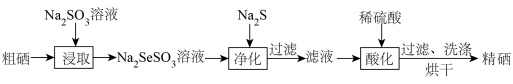
回答下列问题:
(1)步骤1中“浸取”的主要目的是为了除去硒酸泥中的___________ (填化学式),采取“热过滤”的主要原因是___________ 。
(2)步骤1中“氧化浸硒”时主要生成H2SeO3和C1O2,当NaClO3过量会有副产物H2SeO4生成。H2SeO3的化学名称为___________ ,生成H2SeO4的化学方程式为___________ 。反应过程中稀硫酸的浓度要大于3mol·L-1,原因是___________ 。
(3)步骤1中“还原”时硫脲[(NH2)2CS]和Na2SO3均为还原剂。酸性条件下,硫脲转化成(SCN2H3)2的半反应式为___________ 。若硫脲按此半反应式发生转化,则等物质的量的(NH2)2CS和Na2 SO3,还原能力较强的是___________ 。
(4)步骤2中“净化”时,Na2SeSO3溶液中少量的Fe2+转化为FeS沉淀而除去,若沉淀完全后要求Fe2+的浓度小于0.56mg·L-1,则此时溶液中的c(S2-)>___________ mol·L-1[ ]。
]。
(5)步骤2中“酸化”时发生反应的离子方程式为___________ 。
| 成分 | Se | S | Fe2O3 | SiO2 | CuO | ZnO |
| 质量分数(%) | 9.10 | 23.80 | 65.01 | 0.31 | 0.87 | 0.91 |

步骤2:粗硒的精制

回答下列问题:
(1)步骤1中“浸取”的主要目的是为了除去硒酸泥中的
(2)步骤1中“氧化浸硒”时主要生成H2SeO3和C1O2,当NaClO3过量会有副产物H2SeO4生成。H2SeO3的化学名称为
(3)步骤1中“还原”时硫脲[(NH2)2CS]和Na2SO3均为还原剂。酸性条件下,硫脲转化成(SCN2H3)2的半反应式为
(4)步骤2中“净化”时,Na2SeSO3溶液中少量的Fe2+转化为FeS沉淀而除去,若沉淀完全后要求Fe2+的浓度小于0.56mg·L-1,则此时溶液中的c(S2-)>
 ]。
]。(5)步骤2中“酸化”时发生反应的离子方程式为
您最近半年使用:0次



