名校
解题方法
1 .  可用于催化剂载体及功能材料的制备。天然独居石的主要成分为
可用于催化剂载体及功能材料的制备。天然独居石的主要成分为 ,还含有
,还含有 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如图所示:
的工艺流程如图所示: 。
。
回答下列问题:
(1) 的空间结构为
的空间结构为_______ ,若在实验室进行“酸浸”,则不能使用玻璃仪器,原因是_______ 。
(2)滤渣1的主要成分是_______ (填化学式,下同),滤渣2的主要成分是_______ 。
(3)写出加入 、调
、调 时,生成沉淀的一个离子方程式:
时,生成沉淀的一个离子方程式:_______ 。
(4)已知 溶液显弱碱性,则
溶液显弱碱性,则 三者大小关系是
三者大小关系是_______ ,沉铈过程中会有一种气体产生,该气体是_______ (填化学式)。
(5) 与
与 、单质碳在高温下反应可得到用于制备电极材料的
、单质碳在高温下反应可得到用于制备电极材料的 ,同时伴随产生一种可燃性气体,反应的化学方程式为
,同时伴随产生一种可燃性气体,反应的化学方程式为_______ 。
(6)常温下, ,若
,若 恰好沉淀完全
恰好沉淀完全 时溶液的
时溶液的 ,则溶液中
,则溶液中
_______  。
。
 可用于催化剂载体及功能材料的制备。天然独居石的主要成分为
可用于催化剂载体及功能材料的制备。天然独居石的主要成分为 ,还含有
,还含有 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如图所示:
的工艺流程如图所示: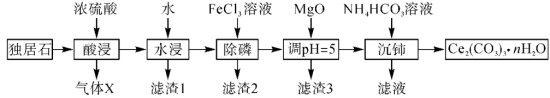
 。
。回答下列问题:
(1)
 的空间结构为
的空间结构为(2)滤渣1的主要成分是
(3)写出加入
 、调
、调 时,生成沉淀的一个离子方程式:
时,生成沉淀的一个离子方程式:(4)已知
 溶液显弱碱性,则
溶液显弱碱性,则 三者大小关系是
三者大小关系是(5)
 与
与 、单质碳在高温下反应可得到用于制备电极材料的
、单质碳在高温下反应可得到用于制备电极材料的 ,同时伴随产生一种可燃性气体,反应的化学方程式为
,同时伴随产生一种可燃性气体,反应的化学方程式为(6)常温下,
 ,若
,若 恰好沉淀完全
恰好沉淀完全 时溶液的
时溶液的 ,则溶液中
,则溶液中
 。
。
您最近一年使用:0次
2024-03-03更新
|
151次组卷
|
2卷引用:山东省菏泽市东明县第一中学2023-2024学年高三下学期开学化学试题
名校
解题方法
2 . 我国稀土产业发达,利用稀土元素制备新型电池材料是一个潜在的研究热点。铈(元素符号为Ce)是最重要的稀土元素之一,以氟碳铈矿(假设只含 、BaO、
、BaO、 )为原料制备氧化铈,其工艺流程如图所示:
)为原料制备氧化铈,其工艺流程如图所示:

提示:稀土元素离子易与 形成复盐沉淀。
形成复盐沉淀。 在空气中易被氧化为
在空气中易被氧化为 。
。
请回答下列问题:
(1)为提高焙烧效率,在焙烧前会将矿石粉碎,简要解释原因__________________ 。
(2)滤渣A的主要成分是 和
和______ (填化学式)。
(3)焙烧后加入稀硫酸浸出,Ce的浸出率和稀硫酸浓度、温度有关,其关系如图所示:
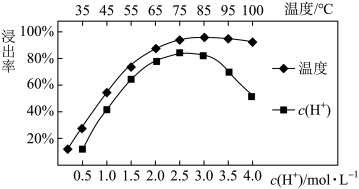
应选择的适宜条件为______ 。硫酸浓度过大时,浸出率降低的原因是______ 。
(4)在进行步骤③时,应该特别注意的问题是_____________________ 。
(5)写出步骤⑤中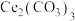 在空气中灼烧的化学反应方程式
在空气中灼烧的化学反应方程式__________________ 。
 、BaO、
、BaO、 )为原料制备氧化铈,其工艺流程如图所示:
)为原料制备氧化铈,其工艺流程如图所示:
提示:稀土元素离子易与
 形成复盐沉淀。
形成复盐沉淀。 在空气中易被氧化为
在空气中易被氧化为 。
。请回答下列问题:
(1)为提高焙烧效率,在焙烧前会将矿石粉碎,简要解释原因
(2)滤渣A的主要成分是
 和
和(3)焙烧后加入稀硫酸浸出,Ce的浸出率和稀硫酸浓度、温度有关,其关系如图所示:

应选择的适宜条件为
(4)在进行步骤③时,应该特别注意的问题是
(5)写出步骤⑤中
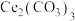 在空气中灼烧的化学反应方程式
在空气中灼烧的化学反应方程式
您最近一年使用:0次
解题方法
3 . 实验室利用CuCl2溶液与SO2气体制备CuCl的装置如图所示(夹持装置略)。
已知氯化亚铜是一种白色固体,微溶于水,不溶于酒精;在空易气中被迅速氧化。

实验步骤:
I.打开止水夹,通入一段时间N 2后,关上止水夹;打开分液漏斗旋塞,向三颈瓶中加盐酸调pH至2~3,打开止水夹,通入SO2,溶液中产生白色沉淀;待反应完全后,再通一段时间的N 2。
II.反应混合液经一系列过程得CuCl粗产品,纯化后得CuCl产品。
回答下列问题:
(1)①步骤I中反应前通入氮气的目的是___________ 。
②装置A中发生反应的离子方程式为___________ 。
③装置B的作用为___________ ;装置C中的试剂为___________ 。
(2)步骤II中一系列过程为___________。
(3)现取实验中的CuCl2溶液制得CuCl2·xH2O。
①CuCl2·xH2O晶体直接加热能否得到纯净的无水CuCl2 (填“能”或“不能”,若不能请说明正确的方法)___________ 。
②为测定x值进行如下实验:a.用电子天平称取3.420g的CuCl2·xH2O晶体;b.在坩埚中充分灼烧;c.在干燥器中冷却;d.称量所得黑色固体质量;e.重复b~d操作直至连续两次称量差值不超过0.001g。若最终得到黑色固体质量为1.600g,则
___________ 。
已知氯化亚铜是一种白色固体,微溶于水,不溶于酒精;在空易气中被迅速氧化。

实验步骤:
I.打开止水夹,通入一段时间N 2后,关上止水夹;打开分液漏斗旋塞,向三颈瓶中加盐酸调pH至2~3,打开止水夹,通入SO2,溶液中产生白色沉淀;待反应完全后,再通一段时间的N 2。
II.反应混合液经一系列过程得CuCl粗产品,纯化后得CuCl产品。
回答下列问题:
(1)①步骤I中反应前通入氮气的目的是
②装置A中发生反应的离子方程式为
③装置B的作用为
(2)步骤II中一系列过程为___________。
| A.减压过滤 水洗 干燥 | B.普通过滤 水洗 干燥 |
| C.减压过滤 乙醇洗 干燥 | D.普通过滤 乙醇洗 干燥 |
①CuCl2·xH2O晶体直接加热能否得到纯净的无水CuCl2 (填“能”或“不能”,若不能请说明正确的方法)
②为测定x值进行如下实验:a.用电子天平称取3.420g的CuCl2·xH2O晶体;b.在坩埚中充分灼烧;c.在干燥器中冷却;d.称量所得黑色固体质量;e.重复b~d操作直至连续两次称量差值不超过0.001g。若最终得到黑色固体质量为1.600g,则

您最近一年使用:0次
名校
解题方法
4 . 工业上以黄铁矿(主要成分为FeS2,含有少量NiS、CuS、SiO2等杂质)为原料制备K4[Fe(CN)6]•3H2O,工艺流程如图:
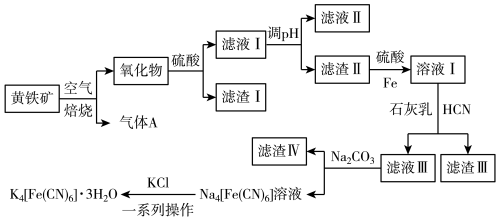
下列说法错误的是

下列说法错误的是
| A.“焙烧”时氧化产物有Fe2O3和SO2 |
| B.“调pH”分离Fe3+与Cu2+、Ni2+是利用了它们氢氧化物Ksp的不同 |
| C.“溶液Ⅰ”中主要反应的离子方程式为6OH-+6HCN+Fe2+=[Fe(CN)6]4-+6H2O |
| D.“一系列操作”为过滤、洗涤、干燥 |
您最近一年使用:0次
2022-03-22更新
|
2180次组卷
|
12卷引用:山东省济南第一中学2023届高三上学期开学考试化学试题
山东省济南第一中学2023届高三上学期开学考试化学试题山东省济南市2022届高三3月高考模拟考试(一模)化学试题(已下线)2022年山东省高考真题变式题(不定项选择题)(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(不定项选择题)湖北省枣阳市第一中学2022届高三下学期5月第三次模拟考试化学试题(已下线)专题13 物质的反应和转化-2022年高考真题模拟题分项汇编湖南省湘西自治州古丈县第一中学2021-2022学年高三下学期第二次模拟化学试题湖南省邵阳市第二中学2022-2023学年高三上学期第五次月考化学试题湖南省怀化市会同县第一中学2021-2022学年高三下学期第二次调研考试化学试题湖南省怀化市沅陵县第二中学2021-2022学年高三下学期四月第一次调研考试化学试题(已下线)学科特色7 工艺流程推断湖南省衡阳市第一中学2023届高三下学期第四次月考化学试题
名校
解题方法
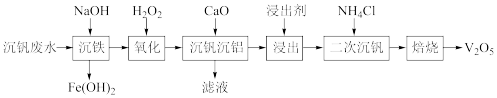
5 . 钒广泛应用于钢铁工业,钒的氧化物在化学工业常用作催化剂。某沉钒废水(含Al3+、Fe2+、VO2+)钒含量约为2%。从该沉钒废水中分离出铁元素并制备V2O5的流程如下所示:
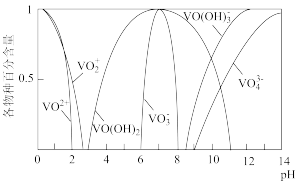
已知:①钒元素的存在形态较多,部分四价钒和五价钒物种的分布分数与pH的关系如图所示。
②Fe(OH)2完全沉淀的pH为8.4;VO(OH)2完全溶解的pH约为11。
③吉布斯自由能(∆G)可以用来判断反应进行的方向。一个反应的∆G越小,反应发生的可能性越大。
(1)写出基态V原子的核外电子排布式___________ 。
(2)“沉铁”时调节pH时不能用氨水代替氢氧化钠的原因是___________ 。
(3)写出“氧化'‘时发生的离子方程式___________ 。
(4)①“沉钒沉铝”中所得沉淀物与浸出剂反应∆G与温度的关系如图所示。“浸出”时应控制温度低于60℃,原因是___________ 。

②若“浸出”时浸出剂中添加NaOH固体,并边浸出边通入CO2,可大大提高钒的浸出率,原因是___________ 。
(5)“二次沉钒”时,先调节pH约为6〜8,得到含钒铵盐沉淀,写出“焙烧”时该铵盐沉淀发生分解的化学方程式___________ 。

已知:①钒元素的存在形态较多,部分四价钒和五价钒物种的分布分数与pH的关系如图所示。

②Fe(OH)2完全沉淀的pH为8.4;VO(OH)2完全溶解的pH约为11。
③吉布斯自由能(∆G)可以用来判断反应进行的方向。一个反应的∆G越小,反应发生的可能性越大。
(1)写出基态V原子的核外电子排布式
(2)“沉铁”时调节pH时不能用氨水代替氢氧化钠的原因是
(3)写出“氧化'‘时发生的离子方程式
(4)①“沉钒沉铝”中所得沉淀物与浸出剂反应∆G与温度的关系如图所示。“浸出”时应控制温度低于60℃,原因是

②若“浸出”时浸出剂中添加NaOH固体,并边浸出边通入CO2,可大大提高钒的浸出率,原因是
(5)“二次沉钒”时,先调节pH约为6〜8,得到含钒铵盐沉淀,写出“焙烧”时该铵盐沉淀发生分解的化学方程式
您最近一年使用:0次
2021-12-14更新
|
1091次组卷
|
6卷引用: 山东省曹县第一中学2022-2023学年高三下学期开学考试化学试卷
解题方法
6 . 实验室用酸性蚀刻废液(含Cu2+、H+、CuC 、Cl-等)和碱性蚀刻废液[N
、Cl-等)和碱性蚀刻废液[N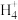 、Cu(NH3
、Cu(NH3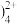 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
、NH3·H2O等]制备CuI(白色固体)的实验流程如下:

(1)步骤Ⅰ中发生了多个反应,其中Cu(NH3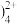 与盐酸反应生成Cu(OH)Cl的离子方程式为
与盐酸反应生成Cu(OH)Cl的离子方程式为______ 。
(2)步骤Ⅳ需控制pH为1~2,80 ℃下进行,合适的加热方式是______ 。
(3)步骤Ⅴ的具体步骤是蒸发浓缩、______ 、____ 。
(4)步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。
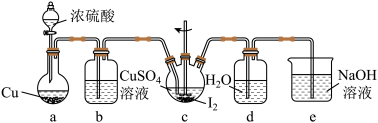
①装置a中盛装浓硫酸的仪器的名称是____ ,圆底烧瓶中发生反应的化学方程式为____ 。
②用装置d中的溶液洗涤制得的CuI的目的是____ ,然后再用无水乙醇洗涤的目的是____ 。
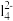 、Cl-等)和碱性蚀刻废液[N
、Cl-等)和碱性蚀刻废液[N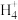 、Cu(NH3
、Cu(NH3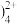 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
(1)步骤Ⅰ中发生了多个反应,其中Cu(NH3
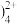 与盐酸反应生成Cu(OH)Cl的离子方程式为
与盐酸反应生成Cu(OH)Cl的离子方程式为(2)步骤Ⅳ需控制pH为1~2,80 ℃下进行,合适的加热方式是
(3)步骤Ⅴ的具体步骤是蒸发浓缩、
(4)步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。

①装置a中盛装浓硫酸的仪器的名称是
②用装置d中的溶液洗涤制得的CuI的目的是
您最近一年使用:0次



