名校
解题方法
1 .  可用于催化剂载体及功能材料的制备。天然独居石的主要成分为
可用于催化剂载体及功能材料的制备。天然独居石的主要成分为 ,还含有
,还含有 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如图所示:
的工艺流程如图所示: 。
。
回答下列问题:
(1) 的空间结构为
的空间结构为_______ ,若在实验室进行“酸浸”,则不能使用玻璃仪器,原因是_______ 。
(2)滤渣1的主要成分是_______ (填化学式,下同),滤渣2的主要成分是_______ 。
(3)写出加入 、调
、调 时,生成沉淀的一个离子方程式:
时,生成沉淀的一个离子方程式:_______ 。
(4)已知 溶液显弱碱性,则
溶液显弱碱性,则 三者大小关系是
三者大小关系是_______ ,沉铈过程中会有一种气体产生,该气体是_______ (填化学式)。
(5) 与
与 、单质碳在高温下反应可得到用于制备电极材料的
、单质碳在高温下反应可得到用于制备电极材料的 ,同时伴随产生一种可燃性气体,反应的化学方程式为
,同时伴随产生一种可燃性气体,反应的化学方程式为_______ 。
(6)常温下, ,若
,若 恰好沉淀完全
恰好沉淀完全 时溶液的
时溶液的 ,则溶液中
,则溶液中
_______  。
。
 可用于催化剂载体及功能材料的制备。天然独居石的主要成分为
可用于催化剂载体及功能材料的制备。天然独居石的主要成分为 ,还含有
,还含有 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如图所示:
的工艺流程如图所示: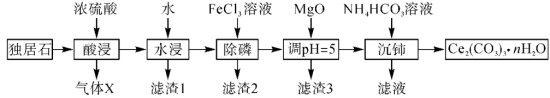
 。
。回答下列问题:
(1)
 的空间结构为
的空间结构为(2)滤渣1的主要成分是
(3)写出加入
 、调
、调 时,生成沉淀的一个离子方程式:
时,生成沉淀的一个离子方程式:(4)已知
 溶液显弱碱性,则
溶液显弱碱性,则 三者大小关系是
三者大小关系是(5)
 与
与 、单质碳在高温下反应可得到用于制备电极材料的
、单质碳在高温下反应可得到用于制备电极材料的 ,同时伴随产生一种可燃性气体,反应的化学方程式为
,同时伴随产生一种可燃性气体,反应的化学方程式为(6)常温下,
 ,若
,若 恰好沉淀完全
恰好沉淀完全 时溶液的
时溶液的 ,则溶液中
,则溶液中
 。
。
您最近一年使用:0次
2024-03-03更新
|
151次组卷
|
2卷引用:山东省菏泽市东明县第一中学2023-2024学年高三下学期开学化学试题
名校
2 . 二氧化铅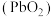 是一种强氧化剂,可以用作铅蓄电池的正极材料。
是一种强氧化剂,可以用作铅蓄电池的正极材料。 在酸性条件氧化
在酸性条件氧化 为
为 的方程式为
的方程式为 (方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是
(方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是
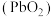 是一种强氧化剂,可以用作铅蓄电池的正极材料。
是一种强氧化剂,可以用作铅蓄电池的正极材料。 在酸性条件氧化
在酸性条件氧化 为
为 的方程式为
的方程式为 (方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是
(方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是A.X是 ,Y是 ,Y是 |
B.还原产物与氧化产物的物质的量之比为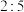 |
C.当生成 时,转移 时,转移 电子 电子 |
D.根据上述反应推测 不能氧化 不能氧化 |
您最近一年使用:0次
2024-02-27更新
|
211次组卷
|
3卷引用:山东省济宁市育才中学2023-2024学年高一下学期开学化学试题
解题方法
3 . 钽(Ta)和铌(Nb)是性质相似的两种单质,一种以钽铌伴生矿(主要成分为SiO2、MnO2、Nb2O5、Ta2O5和少量的TiO2、FeO、CaO、MgO)为原料制取钽和铌的流程如下:

“浸取”后的浸出液中含有H2TaF7、H2NbF7两种二元强酸和锰、钛等元素。
已知:①MIBK为甲基异丁基酮;
② ,
, ,
, 。
。
(1)加快“浸取”速率可采取的措施是___________ 。
(2)浸渣的主要成分是___________ ,Ta2O5与氢氟酸反应的离子方程式为___________ 。
(3)MIBK“萃取”时可分为扩散萃取和动力学萃取两种类型。浸出液中钽的萃取率随搅拌速度的增加而进一步增加时为扩散萃取,若浸出液受到化学反应的控制则萃取类型将变为动力学萃取。搅拌速度对钽萃取率的影响如图所示。

搅拌速度在150rpm时的萃取类型为___________ ,350rpm到400rpm时但萃取率不再增加的原因是___________ 。
(4)金属铌可用金属钠还原K2NbF7,制取,也可用电解熔融的K2NbF7,制取。
①流程中钠热还原法制备铌粉的化学方程式为___________ 。
②传统的熔盐电解法采用的电解质体系通常为K2NbF7-NaCl,利用该方法制备1 mol Nb理论上消耗NaCl的物质的量为___________ mol。

“浸取”后的浸出液中含有H2TaF7、H2NbF7两种二元强酸和锰、钛等元素。
已知:①MIBK为甲基异丁基酮;
②
 ,
, ,
, 。
。(1)加快“浸取”速率可采取的措施是
(2)浸渣的主要成分是
(3)MIBK“萃取”时可分为扩散萃取和动力学萃取两种类型。浸出液中钽的萃取率随搅拌速度的增加而进一步增加时为扩散萃取,若浸出液受到化学反应的控制则萃取类型将变为动力学萃取。搅拌速度对钽萃取率的影响如图所示。

搅拌速度在150rpm时的萃取类型为
(4)金属铌可用金属钠还原K2NbF7,制取,也可用电解熔融的K2NbF7,制取。
①流程中钠热还原法制备铌粉的化学方程式为
②传统的熔盐电解法采用的电解质体系通常为K2NbF7-NaCl,利用该方法制备1 mol Nb理论上消耗NaCl的物质的量为
您最近一年使用:0次
4 . 黄铁矿制硫酸的副产物硒酸泥中含有较高品位的硒元素(其主要成分含量如下表所示),硒酸泥可用于制取硒单质。
步骤1:粗硒的制备

步骤2:粗硒的精制
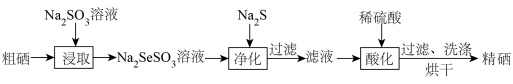
回答下列问题:
(1)步骤1中“浸取”的主要目的是为了除去硒酸泥中的___________ (填化学式),采取“热过滤”的主要原因是___________ 。
(2)步骤1中“氧化浸硒”时主要生成H2SeO3和C1O2,当NaClO3过量会有副产物H2SeO4生成。H2SeO3的化学名称为___________ ,生成H2SeO4的化学方程式为___________ 。反应过程中稀硫酸的浓度要大于3mol·L-1,原因是___________ 。
(3)步骤1中“还原”时硫脲[(NH2)2CS]和Na2SO3均为还原剂。酸性条件下,硫脲转化成(SCN2H3)2的半反应式为___________ 。若硫脲按此半反应式发生转化,则等物质的量的(NH2)2CS和Na2 SO3,还原能力较强的是___________ 。
(4)步骤2中“净化”时,Na2SeSO3溶液中少量的Fe2+转化为FeS沉淀而除去,若沉淀完全后要求Fe2+的浓度小于0.56mg·L-1,则此时溶液中的c(S2-)>___________ mol·L-1[ ]。
]。
(5)步骤2中“酸化”时发生反应的离子方程式为___________ 。
| 成分 | Se | S | Fe2O3 | SiO2 | CuO | ZnO |
| 质量分数(%) | 9.10 | 23.80 | 65.01 | 0.31 | 0.87 | 0.91 |

步骤2:粗硒的精制

回答下列问题:
(1)步骤1中“浸取”的主要目的是为了除去硒酸泥中的
(2)步骤1中“氧化浸硒”时主要生成H2SeO3和C1O2,当NaClO3过量会有副产物H2SeO4生成。H2SeO3的化学名称为
(3)步骤1中“还原”时硫脲[(NH2)2CS]和Na2SO3均为还原剂。酸性条件下,硫脲转化成(SCN2H3)2的半反应式为
(4)步骤2中“净化”时,Na2SeSO3溶液中少量的Fe2+转化为FeS沉淀而除去,若沉淀完全后要求Fe2+的浓度小于0.56mg·L-1,则此时溶液中的c(S2-)>
 ]。
]。(5)步骤2中“酸化”时发生反应的离子方程式为
您最近一年使用:0次
解题方法
5 . 一种以铍矿石(含BeO、 、
、 及少量Ca、Mg、Mn等元素)与配料(氟硅酸钠、碳酸钠)生产氧化铍的工艺流程如下:
及少量Ca、Mg、Mn等元素)与配料(氟硅酸钠、碳酸钠)生产氧化铍的工艺流程如下:
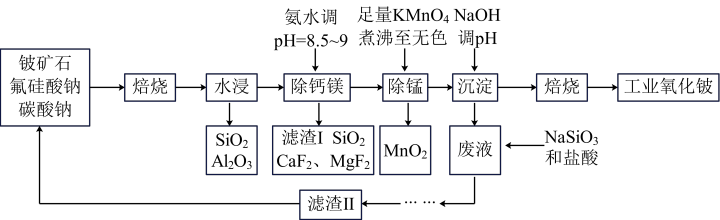
已知:Ⅰ.氟硅酸钠( )、
)、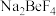 微溶于冷水,溶解度随温度升高有所增大。
微溶于冷水,溶解度随温度升高有所增大。
Ⅱ.常温下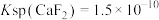 ,
, 。
。
Ⅲ.Be、Al的化合物性质相似。
回答下列问题:
(1)焙烧时Be、Si元素分别转化为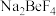 、
、 ,铍矿石中BeO发生反应的化学方程式为
,铍矿石中BeO发生反应的化学方程式为________ 。
(2)水浸时为了增大铍元素的浸出率可采取的措施有________ (答1条即可)。
(3)氨水调pH目的之一是除去未反应的 ,离子方程式为
,离子方程式为________ ,同时产物可除去 、
、 。
。
(4)除锰液中存在 ,常温下,平衡常数
,常温下,平衡常数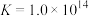 。当溶液中
。当溶液中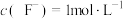 ,
,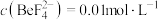 时,加NaOH调pH应稍大于
时,加NaOH调pH应稍大于________ ,若pH过大会造成氧化铍产率________ (填“增大”、“减小”或“不变”)。
(5)废液处理后得到滤渣Ⅱ________ (填化学式)可回收利用。回收滤渣Ⅱ后,废液中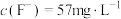 ,每升废液中需要加熟石灰至少
,每升废液中需要加熟石灰至少________ mg,才能达到排放标准 (结果保留整数)。
(结果保留整数)。
 、
、 及少量Ca、Mg、Mn等元素)与配料(氟硅酸钠、碳酸钠)生产氧化铍的工艺流程如下:
及少量Ca、Mg、Mn等元素)与配料(氟硅酸钠、碳酸钠)生产氧化铍的工艺流程如下:
已知:Ⅰ.氟硅酸钠(
 )、
)、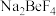 微溶于冷水,溶解度随温度升高有所增大。
微溶于冷水,溶解度随温度升高有所增大。Ⅱ.常温下
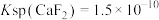 ,
, 。
。Ⅲ.Be、Al的化合物性质相似。
回答下列问题:
(1)焙烧时Be、Si元素分别转化为
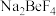 、
、 ,铍矿石中BeO发生反应的化学方程式为
,铍矿石中BeO发生反应的化学方程式为(2)水浸时为了增大铍元素的浸出率可采取的措施有
(3)氨水调pH目的之一是除去未反应的
 ,离子方程式为
,离子方程式为 、
、 。
。(4)除锰液中存在
 ,常温下,平衡常数
,常温下,平衡常数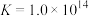 。当溶液中
。当溶液中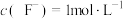 ,
,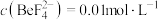 时,加NaOH调pH应稍大于
时,加NaOH调pH应稍大于(5)废液处理后得到滤渣Ⅱ
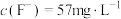 ,每升废液中需要加熟石灰至少
,每升废液中需要加熟石灰至少 (结果保留整数)。
(结果保留整数)。
您最近一年使用:0次
名校
解题方法
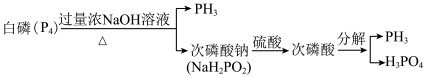
6 . PH3常作为一种熏蒸剂,在贮粮中用于防治害虫,一种制备PH3的流程如图所示:
下列说法正确的是

下列说法正确的是
| A.流程中,每一步均属于氧化还原反应 |
| B.次磷酸的分子式为H3PO2,属于三元酸 |
C.白磷与浓NaOH溶液反应的化学方程式为:P4+3NaOH(浓)+3H2O PH3↑+3NaH2PO2 PH3↑+3NaH2PO2 |
| D.理论上,1 mol白磷可生产2.0 mol PH3 |
您最近一年使用:0次
2023-07-21更新
|
1038次组卷
|
9卷引用:山东省德州市第一中学2023-2024学年高三上学期开学考试化学试题
山东省德州市第一中学2023-2024学年高三上学期开学考试化学试题湖南省长沙市雅礼中学2023-2024学年高二上学期入学考试化学试题重庆育才中学2022届高考适应性考试二化学试题甘肃省天水市一中2021-2022学年高三上学期第二次阶段考试化学试题(已下线)考点01 物质的分类和转化-备战2023年高考化学一轮复习考点帮(全国通用)重庆市石柱中学校2021-2022学年高三上学期第四次月考化学试题(已下线)考点01 物质的分类和转化(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖北省黄石市第二中学2023-2024学年高二上学期9月月考化学试题安徽省淮北市树人高级中学2023-2024学年高一上学期11月考试化学试题
名校
7 . 已知Co2O3在酸性溶液中易被还原成Co2+且Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列叙述中,正确的是
| A.Cl2通入FeI2溶液中,可存在反应 3Cl2+6FeI2=2FeCl3+4FeI3 |
| B.每1 mol Co2O3在酸性溶液中被还原生成Co2+时转移2 mol e- |
| C.FeCl3溶液能使淀粉KI试纸变蓝 |
| D.I2具有较强的氧化性,可以将Co2+氧化成Co2O3 |
您最近一年使用:0次
8 . 在“价-类”二维图中融入“杠杆模型”,可直观辨析部分物质间的转化及其定量关系。图中字母代表常见的含氯元素的物质,b、e均为钠盐。下列说法正确的是


| A.a、d、f都属于一元强酸 |
| B.c、d均具有强氧化性和漂白性 |
C.的转化中,每消耗1mol c转移 个电子 个电子 |
D.b、e在一定条件下反应生成c时,物质的量之比 |
您最近一年使用:0次
名校
解题方法
9 . 随着生活水平的不断提高,人们越来越重视消毒防护和环境保护,其中化学物质发挥了重要作用。
(1)亚氯酸钠 是一种高效消毒剂。
是一种高效消毒剂。 的一种生产工艺如图所示。
的一种生产工艺如图所示。

①“反应”工序中 中
中 元素的化合价为
元素的化合价为___________ 。
②“吸收”工序反应的离子方程式为___________ ,制得 理论上需要消耗标况下
理论上需要消耗标况下 的体积为
的体积为___________ L。
(2)某氨氮废水( 、
、 )的生物法处理流程如图所示:
)的生物法处理流程如图所示:

①过程Ⅰ主要操作为加 溶液调节
溶液调节 至9充分反应后,升温至30℃,然后通入空气。以上操作能降低废水中氨氮含量的原因为
至9充分反应后,升温至30℃,然后通入空气。以上操作能降低废水中氨氮含量的原因为___________ (用离子方程式和必要的文字说明)
②过程Ⅱ在硝化细菌作用下实现 的转化,称为硝化过程。在碱性条件下实现上述硝化过程的总反应的离子方程式为
的转化,称为硝化过程。在碱性条件下实现上述硝化过程的总反应的离子方程式为___________ 。
③过程Ⅲ在反硝化菌存在下,向废水中加入有机碳源 ,与
,与 共同作用转化为
共同作用转化为 、
、 而排放。理论上过程Ⅱ消耗的
而排放。理论上过程Ⅱ消耗的 和过程Ⅲ消耗的
和过程Ⅲ消耗的 物质的量之比为
物质的量之比为___________ 。
(1)亚氯酸钠
 是一种高效消毒剂。
是一种高效消毒剂。 的一种生产工艺如图所示。
的一种生产工艺如图所示。
①“反应”工序中
 中
中 元素的化合价为
元素的化合价为②“吸收”工序反应的离子方程式为
 理论上需要消耗标况下
理论上需要消耗标况下 的体积为
的体积为(2)某氨氮废水(
 、
、 )的生物法处理流程如图所示:
)的生物法处理流程如图所示:
①过程Ⅰ主要操作为加
 溶液调节
溶液调节 至9充分反应后,升温至30℃,然后通入空气。以上操作能降低废水中氨氮含量的原因为
至9充分反应后,升温至30℃,然后通入空气。以上操作能降低废水中氨氮含量的原因为②过程Ⅱ在硝化细菌作用下实现
 的转化,称为硝化过程。在碱性条件下实现上述硝化过程的总反应的离子方程式为
的转化,称为硝化过程。在碱性条件下实现上述硝化过程的总反应的离子方程式为③过程Ⅲ在反硝化菌存在下,向废水中加入有机碳源
 ,与
,与 共同作用转化为
共同作用转化为 、
、 而排放。理论上过程Ⅱ消耗的
而排放。理论上过程Ⅱ消耗的 和过程Ⅲ消耗的
和过程Ⅲ消耗的 物质的量之比为
物质的量之比为
您最近一年使用:0次
2023-02-12更新
|
568次组卷
|
3卷引用:山东省德州市2022-2023学年高一下学期开学考试化学试题
10 . 某炼铜厂湿法炼铜的低铜萃取余液含Co2+、Cu2+、Fe2+、Fe3+、Mn2+、H+、SO ,从该余液中回收金属的工艺流程如图所示。
,从该余液中回收金属的工艺流程如图所示。

已知:室温下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)本流程中多次进行了固液分离,下列仪器中,在实验室进行普通过滤不需要的仪器有______ (填仪器名称)。

(2)“调pH”时,选用CaO浆液代替CaO固体的目的是______ ,调节pH在4.0~4.5,“滤渣I”的成分可能为______ 。
(3)“氧化除Fe、Mn”时,生成MnO2的离子方程式为______ 。
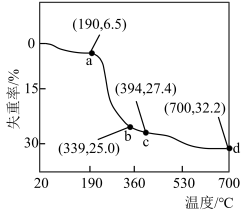
(4)在pH等于7时,进行“沉钴”,生成Co5(CO3)2(OH)6·xH2O的离子方程式为______ 。采用热重分析法测定碱式碳酸钴晶体[Co5(CO3)2(OH)6·xH2O]所含结晶水数,将纯净碱式碳酸钴晶体在空气中加热,加热过程中钴元素无损失,失重率与温度的关系如图所示。已知20~190℃为失去结晶水阶段,则 的值为式为
的值为式为______ ,在 点时剩余固体为氧化物,其化学式为
点时剩余固体为氧化物,其化学式为______ 。
 ,从该余液中回收金属的工艺流程如图所示。
,从该余液中回收金属的工艺流程如图所示。
已知:室温下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Co2+ | Cu2+ | Fe3+ | Mn2+ |
| 开始沉淀时的pH | 7.8 | 5.5 | 1.8 | 8.3 |
| 完全沉淀时的pH | 9.4 | 6.7 | 2.9 | 10.9 |
(1)本流程中多次进行了固液分离,下列仪器中,在实验室进行普通过滤不需要的仪器有

(2)“调pH”时,选用CaO浆液代替CaO固体的目的是
(3)“氧化除Fe、Mn”时,生成MnO2的离子方程式为
(4)在pH等于7时,进行“沉钴”,生成Co5(CO3)2(OH)6·xH2O的离子方程式为
 的值为式为
的值为式为 点时剩余固体为氧化物,其化学式为
点时剩余固体为氧化物,其化学式为
您最近一年使用:0次



