1 . 铅位于IVA族,PbO偏碱性,易溶于硝酸,PbO2偏酸性,难溶于硝酸。已知:PbS与稀HNO3发生反应I :3PbS + 8HNO3(稀) =3Pb(NO3)2 +3S↓+2NO↑+4H2O;PbS与浓HNO3发生反应II:PbS +8HNO3(浓) = PbSO4+8NO2↑+4H2O。下列推断正确的是
| A.Pb3O4 与HNO3溶液发生反应:Pb3O4 +4H+= PbO2 +2Pb2+ +2H2O |
| B.由反应I、II可知,氧化性:HNO3(浓)>HNO3(稀)>PbO2 |
| C.反应I若生成4.48LNO,转移0.6NA电子 |
D.S可以与浓硝酸反应:S +6HNO3(浓) H2SO4 +6NO2↑+2H2O H2SO4 +6NO2↑+2H2O |
您最近一年使用:0次
2020-09-30更新
|
333次组卷
|
4卷引用:山东省潍坊第一中学2021届高三上学期开学检测化学试题
名校
2 . 高铁酸钾是一种高效多功能的新型非氯绿色消毒剂,主要用于饮用水处理。工业上制备K2FeO4的方法:向KOH溶液中通入氯气,然后再加入Fe(NO3)3溶液:
①Cl2+KOH→KCl+KClO+KClO3+H2O(未配平);
②2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O。
下列说法不正确的是
①Cl2+KOH→KCl+KClO+KClO3+H2O(未配平);
②2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O。
下列说法不正确的是
| A.反应①中每消耗4 mol KOH,吸收标准状况下22.4 L Cl2 |
B.若反应①中n(ClO−):n( )=5:1,则氧化剂与还原剂的物质的量之比为2:1 )=5:1,则氧化剂与还原剂的物质的量之比为2:1 |
| C.K2FeO4在消毒杀菌过程中还可以净水 |
| D.若反应①的氧化产物只有KClO,则得到0.2 mol K2FeO4时最少消耗0.3 mol Cl2 |
您最近一年使用:0次
2020-09-25更新
|
337次组卷
|
5卷引用:山东省济南市历城第二中学2022届高三上学期开学考试化学试卷(A)
名校
解题方法
3 . (1) S2O 可以与Fe2+反应制备Fe2O3纳米颗粒。
可以与Fe2+反应制备Fe2O3纳米颗粒。
①若S2O 与Fe2+的物质的量之比为1:2,配平该反应的离子方程式:
与Fe2+的物质的量之比为1:2,配平该反应的离子方程式:
___ Fe2++___ S2O +
+___ H2O2+___ OH- = ___ Fe2O3+___ S2O +
+___ H2O
②下列关于该反应的说法中正确的是______ (填序号)。
A 该反应中S2O 表现了氧化性
表现了氧化性
B 已知生成的Fe2O3纳米颗粒直径为10纳米,则Fe2O3纳米颗粒为胶体
C 该反应中H2O2作氧化剂
(2)人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:
_____ Cu2S+____ Fe3++____ H2O 
____ Cu2++____ Fe2++___ ( ) +____ SO
(3)书写下列反应的热化学方程式: 1 molN2(g)与适量O2(g)反应生成NO (g),需吸收68 kJ的热量;_________ 。
 可以与Fe2+反应制备Fe2O3纳米颗粒。
可以与Fe2+反应制备Fe2O3纳米颗粒。①若S2O
 与Fe2+的物质的量之比为1:2,配平该反应的离子方程式:
与Fe2+的物质的量之比为1:2,配平该反应的离子方程式: +
+ +
+②下列关于该反应的说法中正确的是
A 该反应中S2O
 表现了氧化性
表现了氧化性B 已知生成的Fe2O3纳米颗粒直径为10纳米,则Fe2O3纳米颗粒为胶体
C 该反应中H2O2作氧化剂
(2)人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:


(3)书写下列反应的热化学方程式: 1 molN2(g)与适量O2(g)反应生成NO (g),需吸收68 kJ的热量;
您最近一年使用:0次
解题方法
4 . 能正确表示下列反应的离子方程式为
| A.大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
| B.钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+ |
| C.Fe2+与H2O2在酸性溶液中的反应:Fe2++H2O2+2H+=Fe3++2H2O |
| D.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ |
您最近一年使用:0次
2020-09-04更新
|
106次组卷
|
2卷引用:山东省济宁市微山县第二中学2021届高三上学期开学收心考试化学试题
名校
解题方法
5 . 近年来,FePO4作为制备锂离子电池正极材料LiFePO4的重要原料而成为研究热点。一种以FeCl3、H3PO4、氨水为主要原料制备FePO4的流程如下图。

已知:H3PO4是弱电解质
(1)将FeCl3溶液与H3PO4溶液按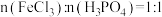 混合,没有明显现象,逐渐滴加氨水至pH = 1.5左右,生成FePO4·2H2O沉淀。
混合,没有明显现象,逐渐滴加氨水至pH = 1.5左右,生成FePO4·2H2O沉淀。
①操作a为______ 。
②生成FePO4·2H2O的离子方程式是______ 。
③控制氨水用量,避免因pH偏高而产生______ 杂质。
(2)测定产物样品中铁元素的质量分数,主要步骤如下:
i.取a g样品,加入过量盐酸充分溶解,再滴加SnCl2(还原剂)至溶液呈浅黄色;
ii.加入TiCl3,恰好将i中残余的少量Fe3+还原为Fe2+;
iii.用c mol·L–1 K2Cr2O7标准溶液滴定Fe2+,消耗v mLK2Cr2O7标准溶液。
①将步骤iii的离子方程式补充完整:
____  +
+____ Fe2++___ =____ Cr3++____ Fe3++____ ;
②产物中铁元素的质量分数为_____ 。

已知:H3PO4是弱电解质
(1)将FeCl3溶液与H3PO4溶液按
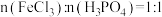 混合,没有明显现象,逐渐滴加氨水至pH = 1.5左右,生成FePO4·2H2O沉淀。
混合,没有明显现象,逐渐滴加氨水至pH = 1.5左右,生成FePO4·2H2O沉淀。①操作a为
②生成FePO4·2H2O的离子方程式是
③控制氨水用量,避免因pH偏高而产生
(2)测定产物样品中铁元素的质量分数,主要步骤如下:
i.取a g样品,加入过量盐酸充分溶解,再滴加SnCl2(还原剂)至溶液呈浅黄色;
ii.加入TiCl3,恰好将i中残余的少量Fe3+还原为Fe2+;
iii.用c mol·L–1 K2Cr2O7标准溶液滴定Fe2+,消耗v mLK2Cr2O7标准溶液。
①将步骤iii的离子方程式补充完整:
 +
+②产物中铁元素的质量分数为
您最近一年使用:0次
2020-06-13更新
|
350次组卷
|
4卷引用:山东省潍坊第一中学2021届高三上学期开学检测化学试题
解题方法
6 . 氮、硫、碳的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系: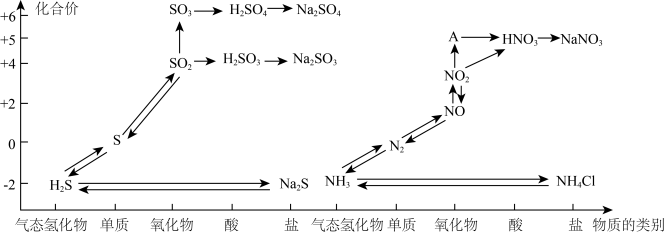
(1)根据A对应的化合价和物质类别,A为___________ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的化合物有____________ 。
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择________ ,反应的离子方程式为______________ 。
(3)某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4。回答下列问题:

①写出制取SO2的化学方程式:_______________ 。
②该同学利用实验现象来检验SO2的还原性,则选用的试剂为_____ 。
A. 品红溶液 B. 酸性高锰酸钾溶液 C. 双氧水(H2O2)
(4)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学反应方程式_______ 。
(5)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2吸收Br2反应的化学方程式为____________ 。

(1)根据A对应的化合价和物质类别,A为
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(3)某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4。回答下列问题:

①写出制取SO2的化学方程式:
②该同学利用实验现象来检验SO2的还原性,则选用的试剂为
A. 品红溶液 B. 酸性高锰酸钾溶液 C. 双氧水(H2O2)
(4)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学反应方程式
(5)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2吸收Br2反应的化学方程式为
您最近一年使用:0次
2020-05-29更新
|
709次组卷
|
2卷引用:山东省济宁市鱼台县第一中学2019-2020学年高一5月开学考试化学试题
7 . 下列解释事实的方程式不正确的是
| A.实验室配制酸性高锰酸钾溶液不用盐酸:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O |
| B.用熟石灰处理泄漏的液氯:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O |
| C.足量铁粉与稀硝酸反应:Fe+4H++NO3-=Fe3++2H2O+NO↑ |
| D.用氨水除去烟气中的SO2:SO2+2NH3·H2O=(NH4)2SO3+H2O |
您最近一年使用:0次
8 . 高铁酸钠是一种新型高效水处理剂,主要制备方法如下:
湿法:Fe(OH)3+NaClO+NaOH—Na2FeO4+NaCl+H2O(反应未配平)
干法:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列说法正确的是
湿法:Fe(OH)3+NaClO+NaOH—Na2FeO4+NaCl+H2O(反应未配平)
干法:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列说法正确的是
| A.高铁酸钠既有杀菌消毒的作用也有净水的作用 |
| B.用湿法制备1molNa2FeO4需消耗1mol NaClO |
| C.干法中被FeSO4还原的Na2O2与做还原剂的Na2O2的物质的量之比为4:1 |
| D.分别用湿法和干法制备等量高铁酸钠,两个反应过程中转移的电子数相同 |
您最近一年使用:0次
2020-05-28更新
|
375次组卷
|
4卷引用:山东省夏津第一中学2022届高三上学期9月入学考试化学试题
名校
解题方法
9 . 利用如图装置(略去部分夹持仪器,气密性已检验)生产硫代硫酸钠晶体(Na2S2O3·5H2O)。实验步骤是先向装置①的烧瓶中滴加80%的浓H2SO4;充分反应后过滤装置③中混合物,滤液经结晶即得到产品。
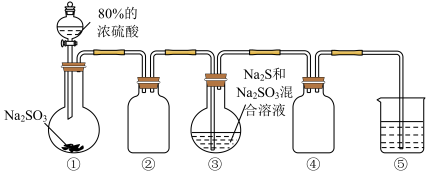
已知:2Na2S+Na2SO3+3SO2=3Na2S2O3。下列判断不正确的是( )

已知:2Na2S+Na2SO3+3SO2=3Na2S2O3。下列判断不正确的是( )
| A.应用装置①,利用H2O2和MnO2可制备少量O2 |
| B.装置③中Na2S和Na2SO3的物质的量之比最好为1:2 |
| C.实验过程中,装置②和装置④的作用相同 |
| D.装置⑤中盛有NaOH溶液,可吸收多余的尾气 |
您最近一年使用:0次
2020-04-04更新
|
146次组卷
|
6卷引用:【全国百强校】山东省济南市外国语学校2019届高三上学期第一次月考化学试题
【全国百强校】山东省济南市外国语学校2019届高三上学期第一次月考化学试题(已下线)专题3.4 硫及其化合物 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》河南省天一大联考2018届高三阶段性测试(五)(河南版) 理科综合化学试题江苏省徐州市第一中学2019-2020学年高二下学期第四次线上周考化学试题黑龙江宾县第一中学2021届高三上学期第二次月考化学试题安徽师范大学附属外国语学校2020-2021学年高一4月月考化学试题
解题方法
10 . 实验室用酸性蚀刻废液(含Cu2+、H+、CuC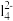 、Cl-等)和碱性蚀刻废液[N
、Cl-等)和碱性蚀刻废液[N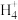 、Cu(NH3
、Cu(NH3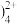 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
、NH3·H2O等]制备CuI(白色固体)的实验流程如下:

(1)步骤Ⅰ中发生了多个反应,其中Cu(NH3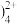 与盐酸反应生成Cu(OH)Cl的离子方程式为
与盐酸反应生成Cu(OH)Cl的离子方程式为______ 。
(2)步骤Ⅳ需控制pH为1~2,80 ℃下进行,合适的加热方式是______ 。
(3)步骤Ⅴ的具体步骤是蒸发浓缩、______ 、____ 。
(4)步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。
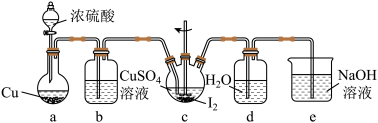
①装置a中盛装浓硫酸的仪器的名称是____ ,圆底烧瓶中发生反应的化学方程式为____ 。
②用装置d中的溶液洗涤制得的CuI的目的是____ ,然后再用无水乙醇洗涤的目的是____ 。
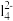 、Cl-等)和碱性蚀刻废液[N
、Cl-等)和碱性蚀刻废液[N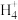 、Cu(NH3
、Cu(NH3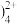 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
(1)步骤Ⅰ中发生了多个反应,其中Cu(NH3
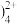 与盐酸反应生成Cu(OH)Cl的离子方程式为
与盐酸反应生成Cu(OH)Cl的离子方程式为(2)步骤Ⅳ需控制pH为1~2,80 ℃下进行,合适的加热方式是
(3)步骤Ⅴ的具体步骤是蒸发浓缩、
(4)步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。

①装置a中盛装浓硫酸的仪器的名称是
②用装置d中的溶液洗涤制得的CuI的目的是
您最近一年使用:0次



