名校
解题方法
1 . 元素的“价一类”二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。如图为铁元素的“价一类”二维图,箭头表示部分物质间的转化关系。
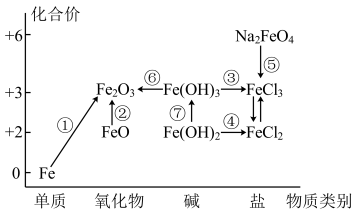
请回答以下问题:
(1)Na2FeO4中Fe的化合价为_______ 。
(2)Fe2O3是否为碱性氧化物_______ (填是或否),理由:_______ 。
(3)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:_______ 。
(4)已知Na2FeO4在强碱溶液中稳定存在,pH越小稳定性越差;则制备Na2FeO4时需要在_______ (填“酸性”“碱性”或“中性”)环境中进行;Na2FeO4也可以作为净水剂,能与水反应生成具有吸附性的Fe(OH)3胶体,写出其中离子方程式:_______ 。其中检验溶液中Fe3+的试剂是_______ 。

请回答以下问题:
(1)Na2FeO4中Fe的化合价为
(2)Fe2O3是否为碱性氧化物
(3)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:
(4)已知Na2FeO4在强碱溶液中稳定存在,pH越小稳定性越差;则制备Na2FeO4时需要在
您最近一年使用:0次
名校
解题方法
2 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,有强还原性,在空气中极易被氧化。用NaHSO3还原法制备保险粉的流程如下:
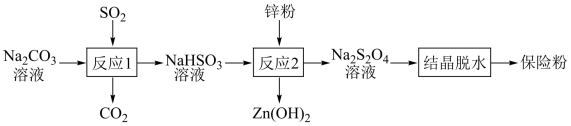
下列说法错误的是

下列说法错误的是
| A.反应1说明酸性:H2SO3>H2CO3 |
| B.反应1结束后,可用盐酸酸化的 BaCl2溶液检验NaHSO3是否被氧化 |
| C.反应2中消耗的氧化剂和还原剂的物质的量之比为1∶2 |
| D.反应2最好在无氧条件下进行 |
您最近一年使用:0次
2021-01-25更新
|
2875次组卷
|
28卷引用:山东省聊城市第一中学2021届高三下学期开学模拟考试化学试题
山东省聊城市第一中学2021届高三下学期开学模拟考试化学试题(已下线)2021年秋季高三开学摸底考化学试卷03(江苏专用)江西省丰城中学2023-2024学年高三上学期开学考试化学试题重庆市2021年普通高中学业水平选择考适应性测试化学试题(已下线)热点8 无机化工流程分析(选择题)-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)押山东卷第09题 化工生产流程选择题-备战2021年高考化学临考题号押题(山东卷)天津市第一中学2020-2021学年高一下学期期中考试化学试题广东省广州市广州大学附属中学2020-2021学年高一下学期4月月考试题湖南省衡阳市第八中学2020-2021学年高一下学期期末考试化学试题江苏省苏州市相城区陆慕高级中学2021-2022学年高三上学期第一次阶段性诊断测试化学试题湖南省天壹名校联盟.宁乡市2021-2022学年高三11月调研考试化学试题湖南师范大学附属中学2021-2022学年高三上学期月考(三)化学试题福建省师范大学附属中学擎云级2021-2022学年高三上学期12月月考化学试题(已下线)专题14 无机综合运用(选择题)-2022年高考化学二轮复习重点专题常考点突破练湖南省长沙市宁乡市2021-2022学年高三11月调研考试化学试题陕西省洋县中学2021-2022学年高一上学期期末考试化学试题(已下线)卷05 工艺流程型选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)辽宁省沈阳市东北育才学校2021-2022高一下学期期中考试化学试题(已下线)第14讲 硫、二氧化硫【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)山西省长治市第二中学校2021-2022学年高一下学期第二次月考化学试题 河南省洛阳市2021-2022学年高一下学期期末质量检测化学试题山东省泰安市新泰中学2021-2022学年高一上学期12月月考化学试题重庆市璧山来凤中学校2022-2023学年高三10月月考化学试题福建省泉州科技中学2021-2022学年高三上学期期中考试化学试题福建省泉州科技中学2021-2022学年高三上学期期中考试化学试题 天津市实验中学2021-2022学年高三上学期第一次阶段考试化学试题 河南省南阳镇平一高2023-2024学年高一上学期化学学科训练试题黑龙江省哈尔滨师范大学青冈实验中学校2023-2024学年高三上学期12月份考试化学试题
名校
3 . 高铁酸钾是一种高效多功能的新型非氯绿色消毒剂,主要用于饮用水处理。工业上制备K2FeO4的方法:向KOH溶液中通入氯气,然后再加入Fe(NO3)3溶液:
①Cl2+KOH→KCl+KClO+KClO3+H2O(未配平);
②2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O。
下列说法不正确的是
①Cl2+KOH→KCl+KClO+KClO3+H2O(未配平);
②2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O。
下列说法不正确的是
| A.反应①中每消耗4 mol KOH,吸收标准状况下22.4 L Cl2 |
B.若反应①中n(ClO−):n( )=5:1,则氧化剂与还原剂的物质的量之比为2:1 )=5:1,则氧化剂与还原剂的物质的量之比为2:1 |
| C.K2FeO4在消毒杀菌过程中还可以净水 |
| D.若反应①的氧化产物只有KClO,则得到0.2 mol K2FeO4时最少消耗0.3 mol Cl2 |
您最近一年使用:0次
2020-09-25更新
|
337次组卷
|
5卷引用:山东省聊城市第二中学2022-2023学年高三上学期开学考试化学试题
名校
4 . 碱性锌锰电池的工作原理:Zn+2MnO2+2H2O 2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料——MnxZn(1−x)Fe2O4,其工艺流程如图所示:
2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料——MnxZn(1−x)Fe2O4,其工艺流程如图所示:
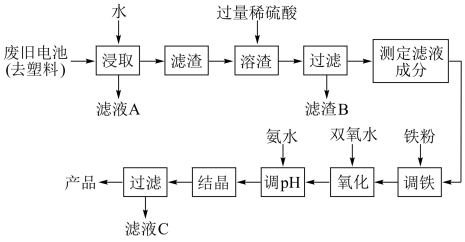
(1)已知MnxZn(1−x)Fe2O4中锰元素的化合价与实验室用二氧化锰制 取氯气时还原产物中的锰相同,则铁元素的化合价为
取氯气时还原产物中的锰相同,则铁元素的化合价为___________ 。
(2)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:_________________________________ 。
(3)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1−x)Fe2O4相符合。
①写出“调铁”工序中发生反应的离子方程式:______________________ 、_______ 。
②若测得滤液的成分为c(Mn2+)+c( Zn2+)=a mol·L−1,c(Fe2+)+c(Fe3+)=b mol·L−1,滤液体积为1 m3,“调铁”工序中,需加入的铁粉质量为
Zn2+)=a mol·L−1,c(Fe2+)+c(Fe3+)=b mol·L−1,滤液体积为1 m3,“调铁”工序中,需加入的铁粉质量为__________  _kg(忽略溶液体积变化,用含a、b的代数式表示)。
_kg(忽略溶液体积变化,用含a、b的代数式表示)。
(4)在“氧化”工序中,加入双氧水的目的是把 Fe 2+氧化为 Fe 3+;生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是______________________ 。
(5)用氨水“调pH”后,经“结晶”、“过滤”可得到产品和滤液C,从滤液C中还可分离出一种氮肥,该氮肥的溶液中离子浓度由大到小的排序为_______________ 。
 2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料——MnxZn(1−x)Fe2O4,其工艺流程如图所示:
2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料——MnxZn(1−x)Fe2O4,其工艺流程如图所示:
(1)已知MnxZn(1−x)Fe2O4中锰元素的化合价与实验室用二氧化锰制
 取氯气时还原产物中的锰相同,则铁元素的化合价为
取氯气时还原产物中的锰相同,则铁元素的化合价为(2)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:
(3)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1−x)Fe2O4相符合。
①写出“调铁”工序中发生反应的离子方程式:
②若测得滤液的成分为c(Mn2+)+c(
 Zn2+)=a mol·L−1,c(Fe2+)+c(Fe3+)=b mol·L−1,滤液体积为1 m3,“调铁”工序中,需加入的铁粉质量为
Zn2+)=a mol·L−1,c(Fe2+)+c(Fe3+)=b mol·L−1,滤液体积为1 m3,“调铁”工序中,需加入的铁粉质量为 _kg(忽略溶液体积变化,用含a、b的代数式表示)。
_kg(忽略溶液体积变化,用含a、b的代数式表示)。(4)在“氧化”工序中,加入双氧水的目的是把 Fe 2+氧化为 Fe 3+;生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是
(5)用氨水“调pH”后,经“结晶”、“过滤”可得到产品和滤液C,从滤液C中还可分离出一种氮肥,该氮肥的溶液中离子浓度由大到小的排序为
您最近一年使用:0次
2019-04-15更新
|
1231次组卷
|
8卷引用:山东省聊城市第一中学2021届高三下学期开学模拟考试化学试题



