名校
解题方法
1 . 化学反应在生产、生活中有广泛的用途。
素材I:海洋约占地球表面积的71%,其中水资源和其他化学资源具有巨大的开发潜力。海水中含有多种物质,如NaCl(①)、MgSO4(②)等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和食盐水(③)用以生产NaOH(④)、Na2CO3(⑤)、Na(⑥)、Cl2(⑦)、盐酸(⑧)等,苦卤经过氯气氧化,热空气吹出、SO2(⑨)吸收等一系列操作可获得Br2。海水淡化与化工生产、能源开发等相结合已经成为海水综合利用的重要方向。
(1)上述标有序号的物质中,属于电解质的是_______ (填序号)。
(2)写出⑤在水中的电离方程式_______ 。
(3)已知SO2为酸性氧化物,试写出将足量SO2通入④的水溶液中发生反应的离子方程式_______ 。
(4)向空气中排放SO2会造成酸雨,检测出某地雨水中的离子组成和浓度如下表所示:
该雨水中氢离子的浓度a=_______ m mol/L。
素材II:储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,此反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、Cr2(SO4)3、K2SO4、H2O七种物质。
(5)请用上述物质填空,并配平化学方程式:_______ 。
______C+______+______ H2SO4→______ K2SO4+_____+_______+_______H2O。
(6)H2SO4在上述反应中表现出来的性质是_______(填选项编号)。
素材I:海洋约占地球表面积的71%,其中水资源和其他化学资源具有巨大的开发潜力。海水中含有多种物质,如NaCl(①)、MgSO4(②)等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和食盐水(③)用以生产NaOH(④)、Na2CO3(⑤)、Na(⑥)、Cl2(⑦)、盐酸(⑧)等,苦卤经过氯气氧化,热空气吹出、SO2(⑨)吸收等一系列操作可获得Br2。海水淡化与化工生产、能源开发等相结合已经成为海水综合利用的重要方向。
(1)上述标有序号的物质中,属于电解质的是
(2)写出⑤在水中的电离方程式
(3)已知SO2为酸性氧化物,试写出将足量SO2通入④的水溶液中发生反应的离子方程式
(4)向空气中排放SO2会造成酸雨,检测出某地雨水中的离子组成和浓度如下表所示:
| 离子 |  |  | Na+ | Cl- | H+ |
| 浓度(mmol/L) | 0.06 | 0.08 | 0.02 | 0.04 |  |
该雨水中氢离子的浓度a=
素材II:储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,此反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、Cr2(SO4)3、K2SO4、H2O七种物质。
(5)请用上述物质填空,并配平化学方程式:
______C+______+______ H2SO4→______ K2SO4+_____+_______+_______H2O。
(6)H2SO4在上述反应中表现出来的性质是_______(填选项编号)。
| A.氧化性 | B.氧化性和酸性 | C.酸性 | D.还原性和酸性 |
您最近一年使用:0次
2023-01-20更新
|
153次组卷
|
2卷引用:山东省曹县第一中学 2022-2023学年高一下学期开学考试化学试题
名校
解题方法
2 . 新冠肺炎疫情期间,环境消毒极其关键。“84”消毒液是一种以NaClO为主的高效消毒剂,被广泛用于宾馆、旅游、医院、食品加工行业、家庭等的卫生消毒,某84消毒液瓶体部分标签如图所示,该84消毒液通常稀释100倍(体积之比)后使用,请回答下列问题:
(1)某同学量取100mL此84消毒液,按说明要求稀释后用于消毒,则稀释后的溶液中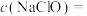
______  。
。
(2)某化学实验小组欲用NaClO固体配制含25%NaClO的消毒液480mL。
①计算配制此溶液需用托盘天平称取NaClO固体的质量为______ 。
②如图所示的仪器中配制溶液需要使用的是______ (填字母),还缺少的玻璃仪器是______ 。

(3)配制时,其正确的操作顺序是______ (填字母,每个字母只能用一次)。
A.用30mL水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,振荡
B.将准确称量的NaClO固体倒入烧杯中,再加适量水溶解
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.通过玻璃棒继续往容量瓶内小心加水,直到液面接近刻度线下1~2cm处
(4)下列操作可能使配制溶液浓度偏低的是______ (填字母)。
A.移液时,未洗涤烧杯内壁和玻璃棒 B.溶解后未经冷却就移液且马上定容
C.移液时,有少量液体溅出 D.定容时,仰视刻度线
E.容量瓶内有少量水
(5)曾有报道,在清洗卫生间时,因混合使用“洁厕灵”(主要成分是盐酸)与“84”消毒液而发生氯气中毒事件。请用离子方程式解释其原因:______ 。
84消毒液 【有效成分】NaClO 【规格】1000mL 【质量分数】25% 【密度】  【使用方法】稀释100倍(体积比)后使用 |
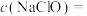
 。
。(2)某化学实验小组欲用NaClO固体配制含25%NaClO的消毒液480mL。
①计算配制此溶液需用托盘天平称取NaClO固体的质量为
②如图所示的仪器中配制溶液需要使用的是

(3)配制时,其正确的操作顺序是
A.用30mL水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,振荡
B.将准确称量的NaClO固体倒入烧杯中,再加适量水溶解
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.通过玻璃棒继续往容量瓶内小心加水,直到液面接近刻度线下1~2cm处
(4)下列操作可能使配制溶液浓度偏低的是
A.移液时,未洗涤烧杯内壁和玻璃棒 B.溶解后未经冷却就移液且马上定容
C.移液时,有少量液体溅出 D.定容时,仰视刻度线
E.容量瓶内有少量水
(5)曾有报道,在清洗卫生间时,因混合使用“洁厕灵”(主要成分是盐酸)与“84”消毒液而发生氯气中毒事件。请用离子方程式解释其原因:
您最近一年使用:0次
2023-01-16更新
|
97次组卷
|
2卷引用:山东省曹县第一中学 2022-2023学年高一下学期开学考试化学试题
名校
3 . 已知三氯化铁的熔点为306℃,沸点为315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验。
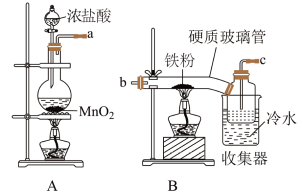
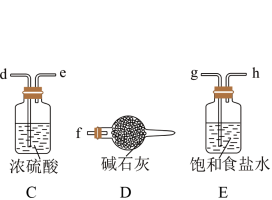
(1)反应开始时,应先点燃_______ 装置的酒精灯(填“A”或“B”)。
(2)碱石灰的作用是_______ 。
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

淡红色溶液中加入过量 后溶液红色加深的原因请用离子方程式表达
后溶液红色加深的原因请用离子方程式表达_______ 。
(4)已知红色褪去的同时有气体生成,经检验为 。该小组同学对红色褪去的原因进行探究。通过查阅资料获知:
。该小组同学对红色褪去的原因进行探究。通过查阅资料获知: 在
在 催化作用下可分解;
催化作用下可分解; 可被氧化剂氧化。据此进行了如下实验:
可被氧化剂氧化。据此进行了如下实验:
①取褪色后溶液三份,第一份滴加 溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和
溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和 溶液,产生白色沉淀。
溶液,产生白色沉淀。
②另取同物质的量浓度的 溶液滴加2滴试剂X,溶液变红,再通入
溶液滴加2滴试剂X,溶液变红,再通入 ,无明显变化。
,无明显变化。
实验①说明_______ (填离子符号)发生了反应;实验②的目的是排除_______ ;得出结论:红色褪去的原因是_______ 。


(1)反应开始时,应先点燃
(2)碱石灰的作用是
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

淡红色溶液中加入过量
 后溶液红色加深的原因请用离子方程式表达
后溶液红色加深的原因请用离子方程式表达(4)已知红色褪去的同时有气体生成,经检验为
 。该小组同学对红色褪去的原因进行探究。通过查阅资料获知:
。该小组同学对红色褪去的原因进行探究。通过查阅资料获知: 在
在 催化作用下可分解;
催化作用下可分解; 可被氧化剂氧化。据此进行了如下实验:
可被氧化剂氧化。据此进行了如下实验:①取褪色后溶液三份,第一份滴加
 溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和
溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和 溶液,产生白色沉淀。
溶液,产生白色沉淀。②另取同物质的量浓度的
 溶液滴加2滴试剂X,溶液变红,再通入
溶液滴加2滴试剂X,溶液变红,再通入 ,无明显变化。
,无明显变化。实验①说明
您最近一年使用:0次
2023-01-14更新
|
571次组卷
|
3卷引用:山东省曹县第一中学 2022-2023学年高一下学期开学考试化学试题
名校
解题方法
4 . 下列离子方程式书写正确的是
A.向 溶液中通入少量 溶液中通入少量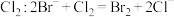 |
B.用白醋浸泡过的淀粉- 试纸检验加碘盐中的 试纸检验加碘盐中的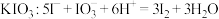 |
C.向 溶液中通入 溶液中通入 气体产生白色沉淀: 气体产生白色沉淀: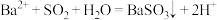 |
D. 的 的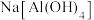 溶液和 溶液和 的 的 溶液等体积混合: 溶液等体积混合: |
您最近一年使用:0次
2022-12-16更新
|
304次组卷
|
2卷引用: 山东省曹县第一中学2022-2023学年高三下学期开学考试化学试卷
名校
解题方法
5 . 价类二维图是学习元素及其化合物知识的重要模型。它是以元素化合价为纵坐标,以物质类别为横坐标的二维平面图像。如图为氯元素的价类二维图。回答下列问题:

(1)上述6种物质,属于电解质有_______ 种 。
(2)⑤与⑥在酸性条件下反应的离子方程式为_______________________ 。
(3)将②与SO2按1∶1通入紫色石蕊试液中,现象为_____ ,解释原因(写离子方程式)______ 。
(4)管道工人通常用浓氨水检查输送②的管道是否漏气,如果有白烟现象,则说明管道漏气,写出产生该现象的化学方程式______________ 。
(5)③是国际上公认的对饮用水、食品等杀菌消毒的理想药剂。商业上常用“有效氯”来说明消毒剂的消毒能力。“有效氯”指的是一定质量的这种消毒剂与多少质量的氯气的氧化能力相当,其数值用此时的氯气的质量对消毒剂质量的百分比来表示。例如,100g某84消毒液与3.55g氯气的氧化能力相当,该产品的“有效氯”就是3.55%。据此计算试剂③的“有效氯”为___________ (保留三位有效数字)。

(1)上述6种物质,属于电解质有
(2)⑤与⑥在酸性条件下反应的离子方程式为
(3)将②与SO2按1∶1通入紫色石蕊试液中,现象为
(4)管道工人通常用浓氨水检查输送②的管道是否漏气,如果有白烟现象,则说明管道漏气,写出产生该现象的化学方程式
(5)③是国际上公认的对饮用水、食品等杀菌消毒的理想药剂。商业上常用“有效氯”来说明消毒剂的消毒能力。“有效氯”指的是一定质量的这种消毒剂与多少质量的氯气的氧化能力相当,其数值用此时的氯气的质量对消毒剂质量的百分比来表示。例如,100g某84消毒液与3.55g氯气的氧化能力相当,该产品的“有效氯”就是3.55%。据此计算试剂③的“有效氯”为
您最近一年使用:0次
2022-12-13更新
|
69次组卷
|
2卷引用:山东省潍坊市临朐县实验中学2021-2022学年高一下学期开学收心考试化学试题
名校
解题方法
6 . 钨是熔点最高的金属,是重要的战略物资,广泛用于钢铁工业、电真空照明材料等方面。钨在自然界主要以钨(+6价)酸盐的形式存在。有开采价值的钨矿石是白钨矿和黑钨矿。黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成FeWO4、MnWO4.黑钨矿传统冶炼工艺的第一阶段是碱熔法(如下图,已知钨酸是一种难溶性强酸、对热不稳定)。
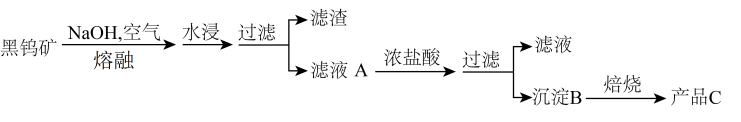
(1)第一次过滤除掉铁、锰元素,滤液A的成分(写化学式):_________ 。
(2)生成沉淀B的化学方程式:_________ ;沉淀B焙烧可得到同价态的氧化物产品C,用H2作还原剂,得到高纯度的钨。写出H2与产品C反应的化学方程式:_________ 。
(3)目前,冶炼拉制钨丝的金属钨,都用组成为非整比的钨氧化物为原料,这种氧化钨中存在五价和六价两种价态的钨。试确定组成为WO2.9的氧化钨中五价和六价的钨原子数之比等于_________ 。

(1)第一次过滤除掉铁、锰元素,滤液A的成分(写化学式):
(2)生成沉淀B的化学方程式:
(3)目前,冶炼拉制钨丝的金属钨,都用组成为非整比的钨氧化物为原料,这种氧化钨中存在五价和六价两种价态的钨。试确定组成为WO2.9的氧化钨中五价和六价的钨原子数之比等于
您最近一年使用:0次
解题方法
7 . 亚氯酸钠 是一种高效的氧化剂和优质漂白剂,在水中溶解度较大,遇酸放出
是一种高效的氧化剂和优质漂白剂,在水中溶解度较大,遇酸放出 。某探究小组设计实验制备
。某探究小组设计实验制备 固体的装置如图所示(夹持装置省略):
固体的装置如图所示(夹持装置省略):

已知:① 饱和溶液在温度低于
饱和溶液在温度低于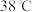 时会析出
时会析出 ,高于
,高于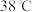 时析出
时析出 ,高于
,高于 时
时 分解成
分解成 和
和 。②
。② 的沸点为
的沸点为 ,易溶于水。
,易溶于水。
回答下列问题:
(1)进行本实验时需用 的
的 溶液,配制时需要的玻璃仪器除烧杯、胶头滴管和量筒外,还需要
溶液,配制时需要的玻璃仪器除烧杯、胶头滴管和量筒外,还需要_______ 。
(2)写出装置A三颈烧瓶中生成 的化学方程式:
的化学方程式:_______ ;装置A中使用浓硫酸而不使用稀硫酸的原因是_______ 。
(3)装置C中 与
与 反应生成
反应生成 和一种助燃气体,该反应中还原剂与氧化剂的物质的量之比为
和一种助燃气体,该反应中还原剂与氧化剂的物质的量之比为_______ ;装置C用冰水浴冷却的主要目的是_______ 。
(4)该套装置存在的明显缺陷是_______ 。
(5)充分反应后,为从产品溶液中获取 晶体,从下列选项中选出合理的操作并排序:
晶体,从下列选项中选出合理的操作并排序:_______ 。_______→_______→_______→干燥。
a.趁热过滤 b. 水洗涤 c.加热蒸发结晶 d.冰水洗涤 e.
水洗涤 c.加热蒸发结晶 d.冰水洗涤 e.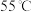 恒温减压蒸发结晶
恒温减压蒸发结晶
(6)测定样品中 的纯度。准确称取所得
的纯度。准确称取所得 样品
样品 于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液稀释成
于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液稀释成 待测溶液。移取
待测溶液。移取 待测溶液于锥形瓶中,加几滴淀粉溶液,用
待测溶液于锥形瓶中,加几滴淀粉溶液,用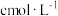 的
的 标准溶液滴定至终点,重复2次,测得消耗
标准溶液滴定至终点,重复2次,测得消耗 标准溶液的体积平均值为
标准溶液的体积平均值为 。(已知:
。(已知: )。该样品中
)。该样品中 的质量分数为
的质量分数为_______ (用含m、c、V的代数式表示)。若在检测中加入稀硫酸的量过少,将导致测定值_______ (填“偏高”或“偏低”)。
 是一种高效的氧化剂和优质漂白剂,在水中溶解度较大,遇酸放出
是一种高效的氧化剂和优质漂白剂,在水中溶解度较大,遇酸放出 。某探究小组设计实验制备
。某探究小组设计实验制备 固体的装置如图所示(夹持装置省略):
固体的装置如图所示(夹持装置省略):
已知:①
 饱和溶液在温度低于
饱和溶液在温度低于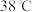 时会析出
时会析出 ,高于
,高于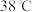 时析出
时析出 ,高于
,高于 时
时 分解成
分解成 和
和 。②
。② 的沸点为
的沸点为 ,易溶于水。
,易溶于水。回答下列问题:
(1)进行本实验时需用
 的
的 溶液,配制时需要的玻璃仪器除烧杯、胶头滴管和量筒外,还需要
溶液,配制时需要的玻璃仪器除烧杯、胶头滴管和量筒外,还需要(2)写出装置A三颈烧瓶中生成
 的化学方程式:
的化学方程式:(3)装置C中
 与
与 反应生成
反应生成 和一种助燃气体,该反应中还原剂与氧化剂的物质的量之比为
和一种助燃气体,该反应中还原剂与氧化剂的物质的量之比为(4)该套装置存在的明显缺陷是
(5)充分反应后,为从产品溶液中获取
 晶体,从下列选项中选出合理的操作并排序:
晶体,从下列选项中选出合理的操作并排序:a.趁热过滤 b.
 水洗涤 c.加热蒸发结晶 d.冰水洗涤 e.
水洗涤 c.加热蒸发结晶 d.冰水洗涤 e. 恒温减压蒸发结晶
恒温减压蒸发结晶(6)测定样品中
 的纯度。准确称取所得
的纯度。准确称取所得 样品
样品 于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液稀释成
于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液稀释成 待测溶液。移取
待测溶液。移取 待测溶液于锥形瓶中,加几滴淀粉溶液,用
待测溶液于锥形瓶中,加几滴淀粉溶液,用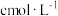 的
的 标准溶液滴定至终点,重复2次,测得消耗
标准溶液滴定至终点,重复2次,测得消耗 标准溶液的体积平均值为
标准溶液的体积平均值为 。(已知:
。(已知: )。该样品中
)。该样品中 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
8 . 回答下列问题:
(1)2022年2月27日11时06分,我国在文昌卫星发射场用长征八号遥二运载火箭,成功将22颗卫星分别送入预定轨道、创造了我国一箭多星发射的新纪录。

①“长征八号”运载火箭—子级所用燃料是以煤炭为原料制得的煤基航天煤油,其化学式可用CH3(CH2)nCH3来表示(式中n=8~16),下列有关叙述中,正确的是____ (填选项序号A、B、C、D之一)。
a.航天煤油属于无机物
b.由煤炭制取航天煤油属于化学变化
c.航天煤油中含多种分子
d.CH3(CH2)8CH3和CH3(CH2)16CH3的性质有差异
A.只有ab B.只有abd C.只有bcd D.只有cd
②该发动机工作时发生的反应为:CH3(CH2)nCH3+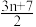 O2
O2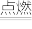 (n+2)CO2+(n+3)H2O,则该反应属于
(n+2)CO2+(n+3)H2O,则该反应属于______ 反应(填“化合”“分解”“复分解”“氧化”“置换”之一)。
③2022年6月5日,长征二号F运载火箭(CZ-2F)将神舟十四号载人飞船成功发射。该运载火箭是以偏二甲肼(C2H8N2)和四氧化二氢(N2O4)作推动剂,发生反应的化学方程式为C2H8N2+2N2O4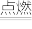 3X+
3X+ CO2+
CO2+ H2O,请在方框内填写该反应的化学计量数,完成化学方程式的配平,写出X单质的化学式:
H2O,请在方框内填写该反应的化学计量数,完成化学方程式的配平,写出X单质的化学式:____ 。
(2)2021年2月10日19时52分,中国首次火星探测任务“天问一号”探测器成功进入环火轨道,成为中国第一颗人造火星卫星。试回答下列问题:

①“天问一号”已着陆火星并成功释放火星车。火星车主要采用太阳能电池板供电,电池中的半导体材料高纯硅,可以利用石英砂(主要成分是SiO2)制得。在高温下,SiO2和碳可以发生化学反应,生成硅和一氧化碳,请写出该反应的化学方程式:_____ 。
②“天问一号”采用了我国自主研制的高性能碳化硅增强铝基复合材料。工业上制取碳化硅,是用二氧化硅和碳为原料,在高温条件下反应,生成碳化硅(SiC)和一氧化碳。该化学反应方程式为______ 。
③“天问一号”使用工程塑料、玻璃钢等作为隔热材料,用二硫化铝(MoS2)固体润滑剂等作为运动部件的润滑材料。已知MoS2中硫元素的化合价为-2价,则其中银元素(Mo)的化合价为____ 价。
(1)2022年2月27日11时06分,我国在文昌卫星发射场用长征八号遥二运载火箭,成功将22颗卫星分别送入预定轨道、创造了我国一箭多星发射的新纪录。

①“长征八号”运载火箭—子级所用燃料是以煤炭为原料制得的煤基航天煤油,其化学式可用CH3(CH2)nCH3来表示(式中n=8~16),下列有关叙述中,正确的是
a.航天煤油属于无机物
b.由煤炭制取航天煤油属于化学变化
c.航天煤油中含多种分子
d.CH3(CH2)8CH3和CH3(CH2)16CH3的性质有差异
A.只有ab B.只有abd C.只有bcd D.只有cd
②该发动机工作时发生的反应为:CH3(CH2)nCH3+
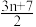 O2
O2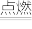 (n+2)CO2+(n+3)H2O,则该反应属于
(n+2)CO2+(n+3)H2O,则该反应属于③2022年6月5日,长征二号F运载火箭(CZ-2F)将神舟十四号载人飞船成功发射。该运载火箭是以偏二甲肼(C2H8N2)和四氧化二氢(N2O4)作推动剂,发生反应的化学方程式为C2H8N2+2N2O4
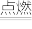 3X+
3X+ CO2+
CO2+ H2O,请在方框内填写该反应的化学计量数,完成化学方程式的配平,写出X单质的化学式:
H2O,请在方框内填写该反应的化学计量数,完成化学方程式的配平,写出X单质的化学式:(2)2021年2月10日19时52分,中国首次火星探测任务“天问一号”探测器成功进入环火轨道,成为中国第一颗人造火星卫星。试回答下列问题:

①“天问一号”已着陆火星并成功释放火星车。火星车主要采用太阳能电池板供电,电池中的半导体材料高纯硅,可以利用石英砂(主要成分是SiO2)制得。在高温下,SiO2和碳可以发生化学反应,生成硅和一氧化碳,请写出该反应的化学方程式:
②“天问一号”采用了我国自主研制的高性能碳化硅增强铝基复合材料。工业上制取碳化硅,是用二氧化硅和碳为原料,在高温条件下反应,生成碳化硅(SiC)和一氧化碳。该化学反应方程式为
③“天问一号”使用工程塑料、玻璃钢等作为隔热材料,用二硫化铝(MoS2)固体润滑剂等作为运动部件的润滑材料。已知MoS2中硫元素的化合价为-2价,则其中银元素(Mo)的化合价为
您最近一年使用:0次
解题方法
9 . 回答下列问题:
(1)2022年3月13日,永恒的“微火”在万众瞩目中缓缓熄灭,为北京冬奥画上圆满的句号。北京作为双奥之城为世界奉献了一届简约、精彩、卓越的冬奥盛会。
①“微火”不微,照亮世界。奥运火炬“飞扬”的外壳是由聚硅氮烷树脂和碳纤维材料制成,能经受住1200℃的高温。“飞扬”火炬外壳属于____ (填“金属材料”“有机高分子材料”“复合材料”之一)。

②科技“战衣”,助力中国速度。短道速滑“战衣”所用面料能承受碰撞中冰刀的切割,它由聚乙烯(化学式为 )、聚氨基甲酸酯等化学纤维复合而成。在聚乙烯中,碳元素和氢元素的质量比为
)、聚氨基甲酸酯等化学纤维复合而成。在聚乙烯中,碳元素和氢元素的质量比为_____ (填最简整数比)。
③“氢”车上阵,助力绿色冬奥。氢氧燃料电池就像冬奥大巴车的“心脏”,在这种电池中,氢气和氧气通过化学反应生成水。下列有关说法中,不合理的是____ (填选项序号之一)。

A.H2和O2发生了氧化还原反应
B.该种电池的应用有利于环保
C.该电池的使用过程中,电能转化为化学能
(2)我国著名化学家侯德榜先生创立了侯氏制碱法,促进了世界制碱技术的发展。其生产过程中有下列反应:
NaCl+NH3+CO2+H2O=NaHCO3+NH4C1
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
Na2CO3和NaCl的溶解度曲线如图1所示,试回答下列问题:

①将t1℃时相同质量的Na2CO3饱和溶液和NaCl饱和溶液分别升温至t2℃,此时所得两溶液的溶质质量分数相比较是____ 。(选填“前者大”“后者大”“相等”之一)。
②t3℃时,将5 g Na2CO3放入试管中,加入10 g水,充分溶解,所得溶液的质量是____ g;然后将试管放入盛有水的烧杯中(如图2所示),再取适量硝酸铵固体放入烧杯内的水中,用玻璃棒搅拌溶解,此时可观察到试管底部固体____ (填“增加”“减少”“无变化”之一)。

③氨盐水比食盐水更容易吸收二氧化碳的原因是_____ 。
④生活在盐碱湖附近的人们有一句谚语“夏天晒盐,冬天捞碱”,请结合溶解度曲线,从化学角度说明这句谚语的原理:____ 。
(1)2022年3月13日,永恒的“微火”在万众瞩目中缓缓熄灭,为北京冬奥画上圆满的句号。北京作为双奥之城为世界奉献了一届简约、精彩、卓越的冬奥盛会。
①“微火”不微,照亮世界。奥运火炬“飞扬”的外壳是由聚硅氮烷树脂和碳纤维材料制成,能经受住1200℃的高温。“飞扬”火炬外壳属于

②科技“战衣”,助力中国速度。短道速滑“战衣”所用面料能承受碰撞中冰刀的切割,它由聚乙烯(化学式为
 )、聚氨基甲酸酯等化学纤维复合而成。在聚乙烯中,碳元素和氢元素的质量比为
)、聚氨基甲酸酯等化学纤维复合而成。在聚乙烯中,碳元素和氢元素的质量比为③“氢”车上阵,助力绿色冬奥。氢氧燃料电池就像冬奥大巴车的“心脏”,在这种电池中,氢气和氧气通过化学反应生成水。下列有关说法中,不合理的是

A.H2和O2发生了氧化还原反应
B.该种电池的应用有利于环保
C.该电池的使用过程中,电能转化为化学能
(2)我国著名化学家侯德榜先生创立了侯氏制碱法,促进了世界制碱技术的发展。其生产过程中有下列反应:
NaCl+NH3+CO2+H2O=NaHCO3+NH4C1
2NaHCO3
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2ONa2CO3和NaCl的溶解度曲线如图1所示,试回答下列问题:

①将t1℃时相同质量的Na2CO3饱和溶液和NaCl饱和溶液分别升温至t2℃,此时所得两溶液的溶质质量分数相比较是
②t3℃时,将5 g Na2CO3放入试管中,加入10 g水,充分溶解,所得溶液的质量是

③氨盐水比食盐水更容易吸收二氧化碳的原因是
④生活在盐碱湖附近的人们有一句谚语“夏天晒盐,冬天捞碱”,请结合溶解度曲线,从化学角度说明这句谚语的原理:
您最近一年使用:0次
名校
解题方法
10 . 2022年4月16日,神舟十三号载人飞船成功返回地面,圆满完成任务。氧气和水是保障航天员生命的重要物质。如图为核心舱环控生保半封闭系统工作原理示意图。请分析过程,回答下列问题。

(1)从微观角度分析液态水与气态水的区别是_______ 。
(2)通过环控生保系统得到的饮用水为软水。水净化系统在沉降过程中,可用明矾作絮凝剂,其化学式为 ,n的值为
,n的值为_______ ,生活中常用_______ 区分硬水和软水。
(3)二氧化碳收集系统中的分子筛表面布满孔穴,结构类似于活性炭,具有_______ 作用。
(4)早期空间站内二氧化碳可用超氧化钾(KO2)吸收,生成碳酸钾和氧气,该反应的化学方程式是_______ 。萨巴蒂尔反应器内,在温度 和钌作催化剂的作用下便可生成水和M(M是最简单的有机物),试写出萨巴蒂尔反应器中发生反应的化学方程式
和钌作催化剂的作用下便可生成水和M(M是最简单的有机物),试写出萨巴蒂尔反应器中发生反应的化学方程式_______ ,该技术的优点是_______ 。

(1)从微观角度分析液态水与气态水的区别是
(2)通过环控生保系统得到的饮用水为软水。水净化系统在沉降过程中,可用明矾作絮凝剂,其化学式为
 ,n的值为
,n的值为(3)二氧化碳收集系统中的分子筛表面布满孔穴,结构类似于活性炭,具有
(4)早期空间站内二氧化碳可用超氧化钾(KO2)吸收,生成碳酸钾和氧气,该反应的化学方程式是
 和钌作催化剂的作用下便可生成水和M(M是最简单的有机物),试写出萨巴蒂尔反应器中发生反应的化学方程式
和钌作催化剂的作用下便可生成水和M(M是最简单的有机物),试写出萨巴蒂尔反应器中发生反应的化学方程式
您最近一年使用:0次
2022-09-07更新
|
116次组卷
|
2卷引用:山东省临沂市重点中学2022-2023学年高一上学期9月入学考试化学试题



