名校
解题方法
1 . 某学习小组的同学用MnO2和浓盐酸反应来制备纯净的氯气并验证其有无漂白性,设计装置如图:

(1)A装置中反应的化学方程式:____________________________ ;D装置中现象:___________________ ;该套装置存在的缺陷:_________________________________ 。
(2)取少量E装置中溶液与洁厕灵(含盐酸)混合产生有毒气体,原因是_______________________ (用离子方程式表示)。
(3)若将Cl2通入热的烧碱溶液中,可以发生如下两个反应:
Cl2+2NaOH=NaCl+NaClO+H2O和3Cl2+6NaOH=5NaCl+NaClO3+3H2O。
从氧化还原角度分析Cl2表现了_______________ 。当混合液中Cl-和ClO 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为__________________ 。
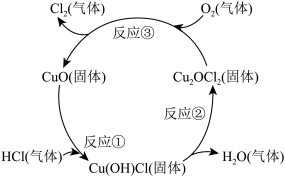
(4)近年来,随着化学工业的快速发展,氯气的需求迅速增加。下图是制备氯气的原理示意图,其反应物是___________ ,CuO的作用是_____________ ,写出总反应的化学方程式,并用单线桥法标出该反应的电子转移情况______________________________ 。

(1)A装置中反应的化学方程式:
(2)取少量E装置中溶液与洁厕灵(含盐酸)混合产生有毒气体,原因是
(3)若将Cl2通入热的烧碱溶液中,可以发生如下两个反应:
Cl2+2NaOH=NaCl+NaClO+H2O和3Cl2+6NaOH=5NaCl+NaClO3+3H2O。
从氧化还原角度分析Cl2表现了
 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为(4)近年来,随着化学工业的快速发展,氯气的需求迅速增加。下图是制备氯气的原理示意图,其反应物是

您最近一年使用:0次
2022-12-14更新
|
395次组卷
|
3卷引用:上海市松江二中2021-2022学年高一上学期期末考试化学试题
名校
2 . 中国疾控中心指出,消毒是疫情防控的重要措施。含氯消毒剂是一种高效、安全的杀菌消毒剂。
I.
(1)已知HClO的杀菌能力比ClO-强。25℃时将氯气溶于水形成氯气—氯水体系,该体系中Cl2(aq)、HClO和 ClO-的物质的量分数(α)随pH变化的关系如图所示。
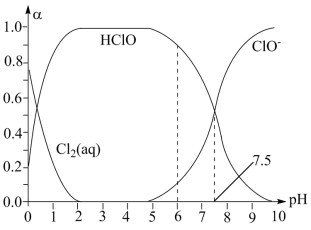
由图分析,用氯气处理饮用水时,pH=6与pH=7.5两种情况下,pH=___________ 时杀菌效果强;当pH=7.5时,氯水中含氯元素的微粒有HClO、ClO-和___________ 。
(2)84消毒液是一种家庭常用消毒剂,但不能用于钢制器具的消毒,原因是___________ ;在使用时不能与洁厕灵(主要成分为盐酸)混合使用,混合时会产生黄绿色的有毒气体,其反应的离子方程式为___________ 。
(3) 是国际上公认的高效、安全的杀菌消毒剂。工业制备ClO2的反应原理为:
是国际上公认的高效、安全的杀菌消毒剂。工业制备ClO2的反应原理为: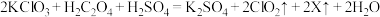 ,X的化学式为
,X的化学式为___________ ,每生成1mol ClO2,反应中转移电子___________ mol。
II.如图是实验室制备氯气并进行一系列相关实验的装置(部分夹持装置已略去)。
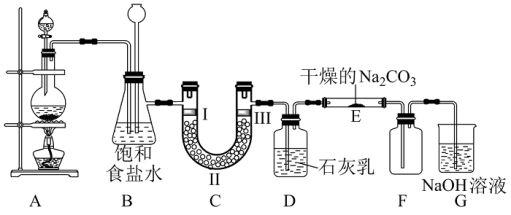
(4)装置B有安全瓶作用,监测实验进行时C中是否发生堵塞,发生堵塞时B中的现象为___________ 。
(5)装置E中潮湿的Cl2与Na2CO3以物质的量比2:1反应,生成Cl2O气体,试写出该反应的化学方程式:___________ 。
I.
(1)已知HClO的杀菌能力比ClO-强。25℃时将氯气溶于水形成氯气—氯水体系,该体系中Cl2(aq)、HClO和 ClO-的物质的量分数(α)随pH变化的关系如图所示。

由图分析,用氯气处理饮用水时,pH=6与pH=7.5两种情况下,pH=
(2)84消毒液是一种家庭常用消毒剂,但不能用于钢制器具的消毒,原因是
(3)
 是国际上公认的高效、安全的杀菌消毒剂。工业制备ClO2的反应原理为:
是国际上公认的高效、安全的杀菌消毒剂。工业制备ClO2的反应原理为: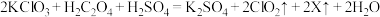 ,X的化学式为
,X的化学式为II.如图是实验室制备氯气并进行一系列相关实验的装置(部分夹持装置已略去)。

(4)装置B有安全瓶作用,监测实验进行时C中是否发生堵塞,发生堵塞时B中的现象为
(5)装置E中潮湿的Cl2与Na2CO3以物质的量比2:1反应,生成Cl2O气体,试写出该反应的化学方程式:
您最近一年使用:0次
名校
3 . 硫酸是当今世界上最重要的化工产品之一、
(1)《新修本草》中关于“青矾(FeSO4•7H2O)”的描述:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”。《物理小识》中说:“青矾厂气熏人,衣服当之易烂。栽木不茂”。
①赤色固体可能是___________ (填化学式)。
②为确认“青矾厂气”含有SO2和SO3,将其通入依次以下装置。
A、B中供选择的试剂有a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 c.浓硫酸
A中溶液为___________ (填标号),可观察到的现象为___________ 。
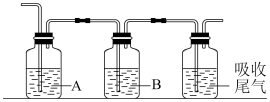
(2)工业制硫酸主要采用接触法,以黄铁矿(FeS2)为原料制备硫酸的主要设备和流程如图。
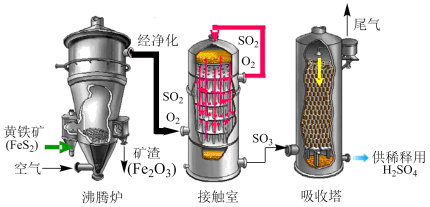
①“沸腾炉”中主要发生的反应为 。每反应消耗1molFeS2,转移的电子数为
。每反应消耗1molFeS2,转移的电子数为___________ 。
②“接触室”中生成SO3的化学方程式为___________ 。
③“吸收塔”中用于吸收SO3的试剂为___________ (填“水”或“浓硫酸”)。
④环保部门为了测定某硫酸厂周围空气中的SO2含量进行了如下实验。取标准状况下1.000L空气(含N2、O2、CO2、SO2),缓慢通过足量碘水。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为0.233g。则空气样品中SO2的体积分数为___________ 。
(1)《新修本草》中关于“青矾(FeSO4•7H2O)”的描述:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”。《物理小识》中说:“青矾厂气熏人,衣服当之易烂。栽木不茂”。
①赤色固体可能是
②为确认“青矾厂气”含有SO2和SO3,将其通入依次以下装置。

A、B中供选择的试剂有a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 c.浓硫酸
A中溶液为
(2)工业制硫酸主要采用接触法,以黄铁矿(FeS2)为原料制备硫酸的主要设备和流程如图。

①“沸腾炉”中主要发生的反应为
 。每反应消耗1molFeS2,转移的电子数为
。每反应消耗1molFeS2,转移的电子数为②“接触室”中生成SO3的化学方程式为
③“吸收塔”中用于吸收SO3的试剂为
④环保部门为了测定某硫酸厂周围空气中的SO2含量进行了如下实验。取标准状况下1.000L空气(含N2、O2、CO2、SO2),缓慢通过足量碘水。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为0.233g。则空气样品中SO2的体积分数为
您最近一年使用:0次
2022-02-28更新
|
407次组卷
|
2卷引用:福建省厦门双十中学2021-2022学年高一上学期第二次月考化学试题
名校
4 . Ⅰ.分类方法应用比较广泛,属于同一类的物质具有相似性,在生活和学习中使用分类的方法处理问题,可以做到举一反三,还可以做到由此及彼。如:
(1)CO2、SiO2、SO2、SO3都属于酸性氧化物,由CO2+Ca(OH)2=CaCO3↓+H2O,可完成SO3与NaOH反应的方程式为:___ 。
(2)NaHCO3、NaHSO3、NaHS都属于弱酸形成的酸式盐,NaHCO3+HCl=NaCl+H2O+CO2↑及NaHCO3+NaOH=Na2CO3+H2O,可完成NaHS分别与HCl、NaOH反应的方程式为:___ 、___ 。
Ⅱ.氧化还原反应在人类的生产、生活中有着重要的应用。
(3)按如图所示操作,充分反应后:
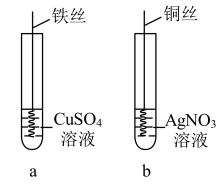
①a中发生反应的离子方程式为___ 。
②b中铜丝上观察到的现象是___ 。
③结合a、b实验现象可知:Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为__ 。
(4)氮氧化物是造成酸雨的成分之一,治理汽车尾气的一种方法是在汽车的排气管上装一个催化转换装置,使NO和CO反应,生成两种空气中的无毒气体。写出该反应的化学方程式,并用双线桥标出电子转移情况:___ 。
(5)高铁酸钠(Na2FeO4)是一种新型的净水剂,可以通过下述反应制取(未配平):Fe(OH)3+NaClO→Na2FeO4+NaCl+H2O。
①该反应中氧化剂是___ (填化学式),___ 元素被氧化(填元素符号)。
②将下面方程式配平、补充完整:__ 。
 Fe(OH)3+
Fe(OH)3+ +
+ NaClO→
NaClO→ Na2FeO4+
Na2FeO4+ NaCl+
NaCl+ H2O
H2O
(1)CO2、SiO2、SO2、SO3都属于酸性氧化物,由CO2+Ca(OH)2=CaCO3↓+H2O,可完成SO3与NaOH反应的方程式为:
(2)NaHCO3、NaHSO3、NaHS都属于弱酸形成的酸式盐,NaHCO3+HCl=NaCl+H2O+CO2↑及NaHCO3+NaOH=Na2CO3+H2O,可完成NaHS分别与HCl、NaOH反应的方程式为:
Ⅱ.氧化还原反应在人类的生产、生活中有着重要的应用。
(3)按如图所示操作,充分反应后:

①a中发生反应的离子方程式为
②b中铜丝上观察到的现象是
③结合a、b实验现象可知:Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为
(4)氮氧化物是造成酸雨的成分之一,治理汽车尾气的一种方法是在汽车的排气管上装一个催化转换装置,使NO和CO反应,生成两种空气中的无毒气体。写出该反应的化学方程式,并用双线桥标出电子转移情况:
(5)高铁酸钠(Na2FeO4)是一种新型的净水剂,可以通过下述反应制取(未配平):Fe(OH)3+NaClO→Na2FeO4+NaCl+H2O。
①该反应中氧化剂是
②将下面方程式配平、补充完整:
 Fe(OH)3+
Fe(OH)3+ +
+ NaClO→
NaClO→ Na2FeO4+
Na2FeO4+ NaCl+
NaCl+ H2O
H2O
您最近一年使用:0次
名校
解题方法
5 . 以硫铁矿(主要成分为 还有少量CuS、
还有少量CuS、 等杂质)为原料制备绿矾晶体(
等杂质)为原料制备绿矾晶体( )的工艺流程如下:
)的工艺流程如下:
(1)烟气中的 会污染环境,可用足量氨水吸收,写出该反应的离子方程式
会污染环境,可用足量氨水吸收,写出该反应的离子方程式_______ 。
(2)仅用一种试剂检验溶液中金属阳离子,则所用试剂及现象分别为_______ 、_______ 。
(3)写出由滤液得到绿矾晶体实验操作方法为:在隔绝空气的条件下_______ 、_______ 、过滤,洗涤,干燥。
(4)细菌脱硫法是用氧化亚铁硫杆菌做对硫铁矿进行催化脱硫,同时得到 溶液。其总反应为:
溶液。其总反应为: ,过程如下图所示:
,过程如下图所示:

写出过程Ⅱ反应的离子方程式_______ 。
(5)大量排放 容易造成酸雨等环境问题,工业上可用双脱硫法处理废气,过程如下图所示,其中可循环使用的试剂是
容易造成酸雨等环境问题,工业上可用双脱硫法处理废气,过程如下图所示,其中可循环使用的试剂是_______ ,写出双碱法脱硫法的总反应方程式:_______ 。

 还有少量CuS、
还有少量CuS、 等杂质)为原料制备绿矾晶体(
等杂质)为原料制备绿矾晶体( )的工艺流程如下:
)的工艺流程如下:(1)烟气中的
 会污染环境,可用足量氨水吸收,写出该反应的离子方程式
会污染环境,可用足量氨水吸收,写出该反应的离子方程式(2)仅用一种试剂检验溶液中金属阳离子,则所用试剂及现象分别为
(3)写出由滤液得到绿矾晶体实验操作方法为:在隔绝空气的条件下
(4)细菌脱硫法是用氧化亚铁硫杆菌做对硫铁矿进行催化脱硫,同时得到
 溶液。其总反应为:
溶液。其总反应为: ,过程如下图所示:
,过程如下图所示:
写出过程Ⅱ反应的离子方程式
(5)大量排放
 容易造成酸雨等环境问题,工业上可用双脱硫法处理废气,过程如下图所示,其中可循环使用的试剂是
容易造成酸雨等环境问题,工业上可用双脱硫法处理废气,过程如下图所示,其中可循环使用的试剂是
您最近一年使用:0次
2022-05-16更新
|
369次组卷
|
2卷引用:广东省广州中学2020-2021学年高一下学期期中考试化学试题
6 . 钠及其化合物在自然界广泛存在,并有重要用途。
(1)写出过氧化钠中阴离子的电子式:_______ 。
(2)把一定量过氧化钠和未知量碳酸氢钠混合物放置在密闭体系中,充分加热后排出气体,固体残留物中一定含有的物质是_______ (填化学式)。
(3)熔融态的过氧化钠是非常好的氧化剂,可用于工业上氧化FeSO4制高铁酸钠(Na2FeO4)(称为干法制备),干法制备中每1mol FeSO4参加反应转移4mol电子,产物中还有氧气生成。写出干法制取高铁酸钠的化学方程式:_______ 。
(4)将燃烧的钠迅速伸入盛满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上黏附着白色物质。实验小组对该白色物质进行如下探究:
【提出假设】假设1:白色物质是Na2O;
假设2:白色物质是Na2CO3;
假设3:白色物质是Na2O和Na2CO3的混合物。
该小组对燃烧后的白色产物进行如下探究:
【思考与交流】
①通过方案1和方案2的实验,上述三个假设中,_______ 成立。钠在二氧化碳中燃烧的化学方程式为_______ 。
②有同学认为白色物质可能是氢氧化钠,你是否同意他的观点,简述理由:_______ 。
(1)写出过氧化钠中阴离子的电子式:
(2)把一定量过氧化钠和未知量碳酸氢钠混合物放置在密闭体系中,充分加热后排出气体,固体残留物中一定含有的物质是
(3)熔融态的过氧化钠是非常好的氧化剂,可用于工业上氧化FeSO4制高铁酸钠(Na2FeO4)(称为干法制备),干法制备中每1mol FeSO4参加反应转移4mol电子,产物中还有氧气生成。写出干法制取高铁酸钠的化学方程式:
(4)将燃烧的钠迅速伸入盛满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上黏附着白色物质。实验小组对该白色物质进行如下探究:
【提出假设】假设1:白色物质是Na2O;
假设2:白色物质是Na2CO3;
假设3:白色物质是Na2O和Na2CO3的混合物。
该小组对燃烧后的白色产物进行如下探究:
| 实验操作 | 实验现象 | 结论 | |
| 方案一 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞溶液 | 溶液变成红色 | 白色物质为Na2O |
| 方案二 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CuCl2溶液 | 出现白色沉淀 | |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞溶液 | 无明显现象 |
【思考与交流】
①通过方案1和方案2的实验,上述三个假设中,
②有同学认为白色物质可能是氢氧化钠,你是否同意他的观点,简述理由:
您最近一年使用:0次
名校
解题方法
7 . 实验室需要用容量瓶等仪器配制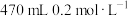 的NaCl溶液。
的NaCl溶液。
(1)配制上述NaCl溶液时,需利用托盘天平称取固体NaCl的质量为___________ g。
(2)以下操作会引起所配制溶液浓度偏低的是___________ ,偏高的是___________ 。(填序号)
a.未洗涤烧杯 b.容量瓶未烘干,底部有少量水
c.定容时俯视 d.定容摇匀后有溶液溅出
(3)现利用上述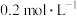 的NaCl溶液配制
的NaCl溶液配制 的NaCl溶液,需利用量筒量取
的NaCl溶液,需利用量筒量取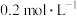 的NaCl溶液的体积为
的NaCl溶液的体积为___________ mL。
(4)某同学怀疑配制的NaCl溶液中可能混入了 ,可以利用
,可以利用___________ 的方法验证,证明存在 的实验现象为
的实验现象为___________ 。
(5)某工厂用电解NaCl溶液的方法制备氯气,其原理如下: ,请将此方程式补充完整
,请将此方程式补充完整___________ 。
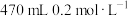 的NaCl溶液。
的NaCl溶液。(1)配制上述NaCl溶液时,需利用托盘天平称取固体NaCl的质量为
(2)以下操作会引起所配制溶液浓度偏低的是
a.未洗涤烧杯 b.容量瓶未烘干,底部有少量水
c.定容时俯视 d.定容摇匀后有溶液溅出
(3)现利用上述
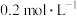 的NaCl溶液配制
的NaCl溶液配制 的NaCl溶液,需利用量筒量取
的NaCl溶液,需利用量筒量取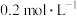 的NaCl溶液的体积为
的NaCl溶液的体积为(4)某同学怀疑配制的NaCl溶液中可能混入了
 ,可以利用
,可以利用 的实验现象为
的实验现象为(5)某工厂用电解NaCl溶液的方法制备氯气,其原理如下:
 ,请将此方程式补充完整
,请将此方程式补充完整
您最近一年使用:0次
名校
解题方法
8 . 回答下列问题:
I.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是___________ (填序号),可作为证据的实验现象是___________ (填字母序号)。
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO___________ H2O2(填“>”或“<”);当有0.1molO2生成时,转移电子的物质的量为___________ mol。
II.全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下,配平此化学方程式。___________
(3)_____NaIO3+______NaHSO3——_____NaHSO4+_______Na2SO4+_____I2+_____H2O
III.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下。已知:辉锑矿的主要成分为Sb2S3,还含As2S5、PbS、CuO和SiO2等;浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AlCl3和PbCl2等。
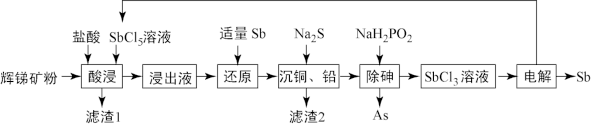
(4)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是___________ (填化学式)。
(5)写出“还原”反应的化学方程式___________ 。
I.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是
| 序号 | 实验 | 实验现象 |
| 1 | 向5%H2O2溶液中滴加酸性KMnO4溶液 | a.溶液紫色褪去; b.有大量气泡产生 |
| 2 | 向5%H2O2溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO
II.全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下,配平此化学方程式。
(3)_____NaIO3+______NaHSO3——_____NaHSO4+_______Na2SO4+_____I2+_____H2O
III.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下。已知:辉锑矿的主要成分为Sb2S3,还含As2S5、PbS、CuO和SiO2等;浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AlCl3和PbCl2等。

(4)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是
(5)写出“还原”反应的化学方程式
您最近一年使用:0次
2021-07-28更新
|
1110次组卷
|
3卷引用:吉林省长春希望高中2020-2021学年高二下学期期末考试化学试题
名校
9 . 二氧化氯(ClO2)是一种绿色消毒剂,常温常压下为黄绿色气体,易溶于水。常见的化学合成方法有氧化法和还原法。
(1)过硫酸盐氧化法:用原料亚氯酸钠(NaClO2)和过硫酸钠(Na2S2O8)直接反应,操作简单,同时可得到副产品Na2SO4。
①制备时发生反应的离子方程式为___________ 。
②下列说法正确的是___________ 。
A.基态硫原子价电子的轨道表示式为 B.原子半径:r(S)>r(Cl)>r(O)
B.原子半径:r(S)>r(Cl)>r(O)
C.第一电离能: I1(Cl)>I1(S)>I1(O) D.Na+的价电子(外围电子)排布式为3s1
(2)盐酸还原法:此法制得的二氧化氯消毒液中常含有ClO2和Cl2两种主要成分,为测定某二氧化氯消毒液中ClO2的浓度,进行如下实验:
量取5.00 mL二氧化氯消毒液于锥形瓶中,加蒸馏水稀释到25.00 mL,再向其中加入过量KI溶液,充分振荡;用0.10 mol/L Na2S2O3标准溶液滴定至浅黄色后,加入指示剂,继续滴定至终点,消耗Na2S2O3标准溶液5.50 mL;再向锥形瓶加入稀H2SO4调节溶液pH=3, 再用0.10 mol/L Na2S2O3标准溶液滴定,滴至浅黄色时加入指示剂,继续滴定至终点,第二次滴定消耗Na2S2O3溶液20.00 mL。
已知:2ClO2+ 2KI=2KClO2 +I2;KClO2+4KI+2H2SO4= KCl+2K2SO4+2I2+2H2O;2Na2S2O3+I2=Na2S4O6+2NaI
①Na2S2O3标准溶液应装在___________ 中,均以淀粉溶液作指示剂,滴定终点的现象为___________ 。
②计算该二氧化氯消毒液中ClO2的物质的量浓度___________ (写出计算过程)。
③若实验中调节溶液pH时稀硫酸用量不足,将导致测得的ClO2浓度___________ (填“偏高”“偏低”或“无影响”)。
(1)过硫酸盐氧化法:用原料亚氯酸钠(NaClO2)和过硫酸钠(Na2S2O8)直接反应,操作简单,同时可得到副产品Na2SO4。
①制备时发生反应的离子方程式为
②下列说法正确的是
A.基态硫原子价电子的轨道表示式为
 B.原子半径:r(S)>r(Cl)>r(O)
B.原子半径:r(S)>r(Cl)>r(O)C.第一电离能: I1(Cl)>I1(S)>I1(O) D.Na+的价电子(外围电子)排布式为3s1
(2)盐酸还原法:此法制得的二氧化氯消毒液中常含有ClO2和Cl2两种主要成分,为测定某二氧化氯消毒液中ClO2的浓度,进行如下实验:
量取5.00 mL二氧化氯消毒液于锥形瓶中,加蒸馏水稀释到25.00 mL,再向其中加入过量KI溶液,充分振荡;用0.10 mol/L Na2S2O3标准溶液滴定至浅黄色后,加入指示剂,继续滴定至终点,消耗Na2S2O3标准溶液5.50 mL;再向锥形瓶加入稀H2SO4调节溶液pH=3, 再用0.10 mol/L Na2S2O3标准溶液滴定,滴至浅黄色时加入指示剂,继续滴定至终点,第二次滴定消耗Na2S2O3溶液20.00 mL。
已知:2ClO2+ 2KI=2KClO2 +I2;KClO2+4KI+2H2SO4= KCl+2K2SO4+2I2+2H2O;2Na2S2O3+I2=Na2S4O6+2NaI
①Na2S2O3标准溶液应装在
②计算该二氧化氯消毒液中ClO2的物质的量浓度
③若实验中调节溶液pH时稀硫酸用量不足,将导致测得的ClO2浓度
您最近一年使用:0次
10 . 工业上用黄铁矿(FeS2)为原料制备硫酸的流程如图:
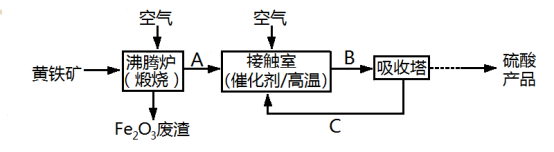
回答下列问题:
(1)在接触室中发生的反应是2SO2+O2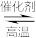 2SO3,该反应属于
2SO3,该反应属于_______ (填字母)
a.氧化还原反应 b.离子反应
c.化合反应 d.可逆反应
(2)写出Cu和浓硫酸反应的化学方程式_______ 。
(3)写出沸腾炉中发生反应的化学方程式:_______
(4)取硫酸产品加入蔗糖中,有“黑面包”现象发生,该过程体现出浓硫酸的性质是_______ 。
(5)SO2可用于杀菌、消毒。葡萄酒里含有微量SO2,起保鲜、杀菌和抗氧化作用,其中抗氧化作用是利用了SO2的还原性。氯水和SO2都有漂白性,有人为增强漂白效果,将Cl2和SO2混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:_______ 。

回答下列问题:
(1)在接触室中发生的反应是2SO2+O2
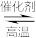 2SO3,该反应属于
2SO3,该反应属于a.氧化还原反应 b.离子反应
c.化合反应 d.可逆反应
(2)写出Cu和浓硫酸反应的化学方程式
(3)写出沸腾炉中发生反应的化学方程式:
(4)取硫酸产品加入蔗糖中,有“黑面包”现象发生,该过程体现出浓硫酸的性质是
(5)SO2可用于杀菌、消毒。葡萄酒里含有微量SO2,起保鲜、杀菌和抗氧化作用,其中抗氧化作用是利用了SO2的还原性。氯水和SO2都有漂白性,有人为增强漂白效果,将Cl2和SO2混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:
您最近一年使用:0次



