1 . “协同去污,变废为宝”为处理工业废水提供了新思路。现有含 、
、 的电镀废液以及含
的电镀废液以及含 的废液。现联合处理废水,回收
的废液。现联合处理废水,回收 并生产铁红和媒染剂
并生产铁红和媒染剂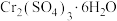 ,回收过程如下,请回答以下问题:
,回收过程如下,请回答以下问题:________ 。
(2)对于该工艺的说法错误的是________。
(3)写出铁铜废液中加入试剂1发生的离子方程式________ 。滤液与含酸性 的废液反应的离子方程式为
的废液反应的离子方程式为________ 。
(4)证明滤液已被试剂3完全氧化的实验方法是________ 。
(5)从 溶液制取
溶液制取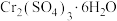 晶体的实验操作方法为蒸发浓缩、
晶体的实验操作方法为蒸发浓缩、________ 、过滤、________ 、干燥。
(6)已知 化学性质与
化学性质与 类似,若将流程中
类似,若将流程中 的溶液转化为氢氧化铬,则转化过程中发生的离子方程式为
的溶液转化为氢氧化铬,则转化过程中发生的离子方程式为________ 。
 、
、 的电镀废液以及含
的电镀废液以及含 的废液。现联合处理废水,回收
的废液。现联合处理废水,回收 并生产铁红和媒染剂
并生产铁红和媒染剂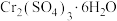 ,回收过程如下,请回答以下问题:
,回收过程如下,请回答以下问题: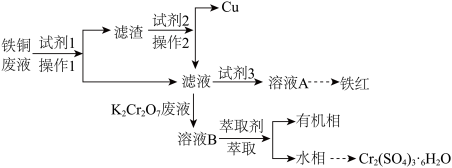
(2)对于该工艺的说法错误的是________。
| A.操作1和操作2都是过滤 |
B.试剂1是过量的 粉,试剂2是过量的 粉,试剂2是过量的 |
| C.可从有机相中提取出某成分加入到溶液A中,提高产量,剩余成分可循环利用 |
D.试剂3只能是 ,目的是将 ,目的是将 氧化成 氧化成 |
(3)写出铁铜废液中加入试剂1发生的离子方程式
 的废液反应的离子方程式为
的废液反应的离子方程式为(4)证明滤液已被试剂3完全氧化的实验方法是
(5)从
 溶液制取
溶液制取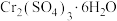 晶体的实验操作方法为蒸发浓缩、
晶体的实验操作方法为蒸发浓缩、(6)已知
 化学性质与
化学性质与 类似,若将流程中
类似,若将流程中 的溶液转化为氢氧化铬,则转化过程中发生的离子方程式为
的溶液转化为氢氧化铬,则转化过程中发生的离子方程式为
您最近一年使用:0次
名校
解题方法
2 . 大力发展新能源汽车产业是我国兑现碳中和承诺的重要战略之一。随着这一产业的发展,如何处理废旧锂电池成为一个亟需解决的问题。某废弃的钴酸锂( )电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:
)电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:

已知: 与草酸根离子(
与草酸根离子( )结合生成较稳定的
)结合生成较稳定的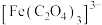 ,
,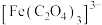 在强酸性条件下分解重新生成
在强酸性条件下分解重新生成 。
。
(1)操作①的名称为______ ;由此可推测,氧化铝______ (填“能”或“不能”)溶于氢氧化钠溶液。
(2)溶液②中所含主要溶质为LiCl、 ,请写出
,请写出 和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)
和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)______ 。
(3)将溶液中的 转化为
转化为 沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是
沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是__________________ 。
(4)为证明操作④获得的 沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入
沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入______ ,若无白色沉淀生成,则证明沉淀洗涤干净。
(5)取3.66 g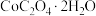 (相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为
(相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为______ (填化学式);在956℃条件下反应完全后,剩余固体相对最开始反应前失重59%,此时固体成分的化学式为 ,
,
______ 。
(6)某同学设计如图装置测定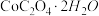 晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是
晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是______ (填选项)。

A. B中应装入浓硫酸,目的是除去水蒸气
B. 利用干燥管前后质量差可计算出结晶水的含量
C. 图中半透膜可让气体通过又可防止固体粉末进入导管
D. 反应结束后,应先停止加热,一段时间后再停止通空气
(7)溶液④中,铁元素主要以______ 离子形态存在,应加入______ 后再进行后续操作。
(8) 溶液在工业上常用于电路板的蚀刻,发生的反应为
溶液在工业上常用于电路板的蚀刻,发生的反应为 。某同学向含有
。某同学向含有 、
、 和
和 三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为
三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为______ (填选项)。
A. Fe B. Fe和Zn C. Fe和Cu D. Cu和Zn
(9)某a g混合粉末中含有铁、石墨、硫和碳酸氢铵,在空气中充分加热至完全反应后,重新称量剩余固体质量,仍为a g,则混合物中铁的质量分数为______ 。
 )电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:
)电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:
已知:
 与草酸根离子(
与草酸根离子( )结合生成较稳定的
)结合生成较稳定的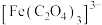 ,
,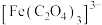 在强酸性条件下分解重新生成
在强酸性条件下分解重新生成 。
。(1)操作①的名称为
(2)溶液②中所含主要溶质为LiCl、
 ,请写出
,请写出 和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)
和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)(3)将溶液中的
 转化为
转化为 沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是
沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是(4)为证明操作④获得的
 沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入
沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入(5)取3.66 g
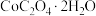 (相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为
(相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为 ,
,
(6)某同学设计如图装置测定
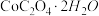 晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是
晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是
A. B中应装入浓硫酸,目的是除去水蒸气
B. 利用干燥管前后质量差可计算出结晶水的含量
C. 图中半透膜可让气体通过又可防止固体粉末进入导管
D. 反应结束后,应先停止加热,一段时间后再停止通空气
(7)溶液④中,铁元素主要以
(8)
 溶液在工业上常用于电路板的蚀刻,发生的反应为
溶液在工业上常用于电路板的蚀刻,发生的反应为 。某同学向含有
。某同学向含有 、
、 和
和 三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为
三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为A. Fe B. Fe和Zn C. Fe和Cu D. Cu和Zn
(9)某a g混合粉末中含有铁、石墨、硫和碳酸氢铵,在空气中充分加热至完全反应后,重新称量剩余固体质量,仍为a g,则混合物中铁的质量分数为
您最近一年使用:0次
解题方法
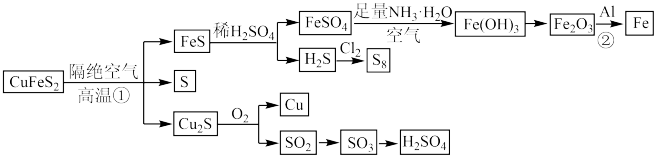
3 . 硫在自然界中主要以黄铜矿(CuFeS2)和黄铁矿(FeS2)等矿物形式存在,其中黄铜矿在工业上除冶炼铁和铜外,还可以制备硫及硫酸。黄铜矿的综合利用如图所示。
回答下列问题:
(1)丹霞地貌的岩层因含_____ (填某种含铁氧化物的化学式)而呈红色。可利用铜的焰色反应鉴别黄铜矿(CuFeS2)和黄铁矿(FeS2),铜的焰色反应颜色是____ (填标号)。
A.黄色 B.紫色 C.砖红色 D.绿色
(2)黄铜矿中Fe和Cu均为+2价,上述流程转化中共有____ 个氧化还原反应。
(3)写出反应①的化学方程式_____ 。在上述流程转化中,能证明氯的非金属性比硫强的化学方程式为____ 。
(4)如图所示为反应②的实验装置,下列有关该反应的说法正确的是___ (填标号)。
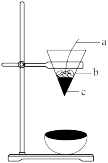
A.铝热反应需在高温条件下进行,故该反应为吸热反应
B.b为氧化铁与铝粉的混合物
C.2mol氧化剂参与反应,则转移的电子数目为12NA
(5)某黄铜矿(主要成分为CuFeS2,含少量SiO2)中S元素的质量分数为32%。现有100kg该黄铜矿,按上述流程转化,理论上最多可制得____ kg硫酸。

回答下列问题:
(1)丹霞地貌的岩层因含
A.黄色 B.紫色 C.砖红色 D.绿色
(2)黄铜矿中Fe和Cu均为+2价,上述流程转化中共有
(3)写出反应①的化学方程式
(4)如图所示为反应②的实验装置,下列有关该反应的说法正确的是

A.铝热反应需在高温条件下进行,故该反应为吸热反应
B.b为氧化铁与铝粉的混合物
C.2mol氧化剂参与反应,则转移的电子数目为12NA
(5)某黄铜矿(主要成分为CuFeS2,含少量SiO2)中S元素的质量分数为32%。现有100kg该黄铜矿,按上述流程转化,理论上最多可制得
您最近一年使用:0次
名校
解题方法
4 . 溴元素主要以Br-形式存在于海水(呈弱碱性)中,利用空气吹出法从海水中提溴,工艺流程示意如图。已知:常温下溴呈液态,深红棕色,易挥发。
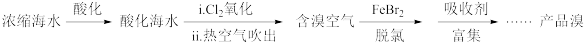
(1)氧化:请写出i中的化学方程式_____ 。
(2)脱氯:除去含溴空气中残留的Cl2。
①具有脱氯作用的离子是_____ 。
②溶液失去脱氯作用后,补加FeBr2或加入_____ ,脱氯作用恢复。
(3)富集、制取Br2:
用Na2CO3溶液吸收溴,Br2歧化为BrO 和Br-。再用H2SO4酸化后可以得到Br2。写出加入H2SO4酸化生成Br2的离子方程式
和Br-。再用H2SO4酸化后可以得到Br2。写出加入H2SO4酸化生成Br2的离子方程式_____ 。
(4)探究NaBr溶液与H2SO4溶液反应时H2SO4浓度对生成Br2的影响,实验如下:
①B中溶液呈棕红色说明产生了_____ 。
②分析C中溶液颜色变浅的原因,甲同学认为是发生了化学反应所致;乙同学认为是用水稀释所致。若认为甲同学的分析合理,请用具体的反应说明理由。若认为乙同学的分析合理,请进一步设计实验方案证明。请从甲乙同学的说法中任选一个作答。
认为甲合理的理由_____ (具体反应)。
认为乙合理的实验方案_____ 。
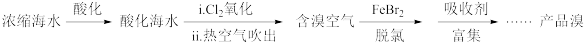
(1)氧化:请写出i中的化学方程式
(2)脱氯:除去含溴空气中残留的Cl2。
①具有脱氯作用的离子是
②溶液失去脱氯作用后,补加FeBr2或加入
(3)富集、制取Br2:
用Na2CO3溶液吸收溴,Br2歧化为BrO
 和Br-。再用H2SO4酸化后可以得到Br2。写出加入H2SO4酸化生成Br2的离子方程式
和Br-。再用H2SO4酸化后可以得到Br2。写出加入H2SO4酸化生成Br2的离子方程式(4)探究NaBr溶液与H2SO4溶液反应时H2SO4浓度对生成Br2的影响,实验如下:
| 序号 | A | B | C |
| 试剂组成 | 1mol/LNaBr 20%H2SO4 | 1mol/LNaBr 98%H2SO4 | 将B中反应后溶液用水 稀释 |
| 实验现象 | 无明显现象 | 溶液呈棕红色,放热 | 溶液颜色变得很浅 |
①B中溶液呈棕红色说明产生了
②分析C中溶液颜色变浅的原因,甲同学认为是发生了化学反应所致;乙同学认为是用水稀释所致。若认为甲同学的分析合理,请用具体的反应说明理由。若认为乙同学的分析合理,请进一步设计实验方案证明。请从甲乙同学的说法中任选一个作答。
认为甲合理的理由
认为乙合理的实验方案
您最近一年使用:0次
名校
5 . 氯化亚铜(CuCl,白色、易被氧化,Ksp=1.2×10-6)广泛用作催化剂、脱臭剂、脱色剂等。工业上用初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备活性CuCl的流程如下:
(1)反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S+MnO2 + H2SO4→CuSO4 +S+MnSO4 + H2O(未配平);滤渣Ⅰ成分是:__________ 。
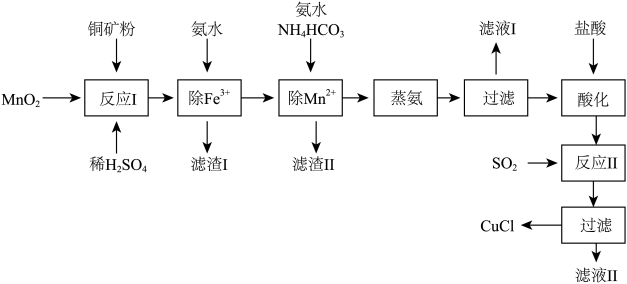
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为_________________________ 。
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。
Cu(OH)2+4NH3 [Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
由表中信息可知蒸氨的条件应选_______ (填序号),请用平衡移动原理解释选择该条件的原因是________________________________ 。
(4)反应Ⅱ的离子方程式___________________________ 。
(5)实验证明通过如图装置也可获得CuCl,现象为
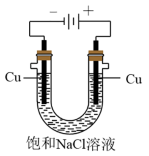
阴极:产生无色气体;
阳极:有白色胶状沉淀生成且逐渐增多;
U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。
①生成CuCl的电极反应式为________________________________ 。
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些不能支持该同学的说法________ 。(填序号)
a.容易脱水变成红色的Cu2O
b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15
d.易被氧化成Cu(OH)2
(1)反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S+MnO2 + H2SO4→CuSO4 +S+MnSO4 + H2O(未配平);滤渣Ⅰ成分是:

(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。
Cu(OH)2+4NH3
 [Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:| 序号 | 温度/℃ | 时间/min | 压强/KPa | 残液颜色 |
| a | 110 | 60 | 101.3 | 浅蓝色 |
| b | 100 | 40 | 74.6 | 几乎很浅 |
| c | 90 | 30 | 60.0 | 无色透明 |
(4)反应Ⅱ的离子方程式
(5)实验证明通过如图装置也可获得CuCl,现象为

阴极:产生无色气体;
阳极:有白色胶状沉淀生成且逐渐增多;
U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。
①生成CuCl的电极反应式为
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些不能支持该同学的说法
a.容易脱水变成红色的Cu2O
b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15
d.易被氧化成Cu(OH)2
您最近一年使用:0次
6 . 含SO2和H2S废气的治理可以变废为宝,使硫资源得以利用。
(1)一种处理SO2废气的工艺流程如图所示。________ ;SO2吸收塔中发生反应化学方程式为________ 。
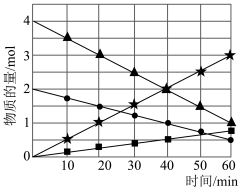
(2)CO与SO2在铝矾土作催化剂、773K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图所示,写出该反应的化学方程式:________ 。________ 。
②亚硫酸钠粗品中含有少量Na2SO4,设计实验证明亚硫酸钠粗品中含有少量Na2SO4的方案:________ 。(必须使用的试剂有:蒸馏水、稀盐酸、BaCl2溶液)
(1)一种处理SO2废气的工艺流程如图所示。

(2)CO与SO2在铝矾土作催化剂、773K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图所示,写出该反应的化学方程式:

②亚硫酸钠粗品中含有少量Na2SO4,设计实验证明亚硫酸钠粗品中含有少量Na2SO4的方案:
您最近一年使用:0次
7 . 五氧化二钒( )为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为
)为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为 ,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备
,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备 的一种流程如图所示:
的一种流程如图所示:
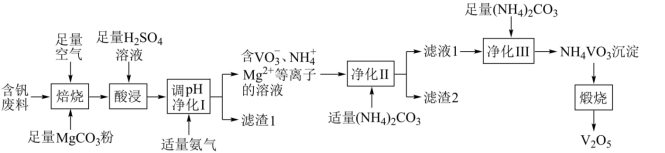
已知:①含钒离子在溶液中的存在形式与溶液pH的关系
②25℃时,难溶电解质的溶度积常数如表所示:
请回答下列问题:
(1)写出基态V原子的价层电子排布式:___________ 。
(2)“焙烧”的目的之一是将 转化成
转化成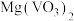 ,请写出转化的化学方程式:
,请写出转化的化学方程式:___________ 。
(3)“酸浸”时,为了提升各物质的浸出速率,除了适当升高温度外,还可以采取的措施是___________ (写一条即可)。
(4)25℃,“调pH净化Ⅰ”时需将 、
、 、
、 三种离子去除干净(浓度
三种离子去除干净(浓度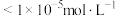 时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为
时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为___________ 。
(5)“净化Ⅱ”的目的是除 、
、 ,若该过程加入过量
,若该过程加入过量 ,可能导致的结果是
,可能导致的结果是___________ 。
(6)“滤液1”中加入 的目的是将
的目的是将 变成沉淀偏钒酸铵(
变成沉淀偏钒酸铵( ),简称“沉钒”。“沉钒”得到的
),简称“沉钒”。“沉钒”得到的 需进行洗涤、干燥,请写出证明
需进行洗涤、干燥,请写出证明 已洗净的实验操作及现象:
已洗净的实验操作及现象:___________ 。
(7)煅烧 得到的产物中,可以在该流程中循环利用的物质是
得到的产物中,可以在该流程中循环利用的物质是___________ 。
(8)为测定该产品的纯度,某同学准确称取 产品1.000g,加入过量稀硫酸使其完全转化成
产品1.000g,加入过量稀硫酸使其完全转化成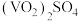 ,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的
,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的 标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中
标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中 被氧化为
被氧化为 ,该产品的纯度为
,该产品的纯度为___________ 。(计算结果保留两位小数)
 )为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为
)为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为 ,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备
,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备 的一种流程如图所示:
的一种流程如图所示:
已知:①含钒离子在溶液中的存在形式与溶液pH的关系
| 溶液pH | <4.0 | 6.0≤pH≤8.0 | >8.0 |
| 钒元素存在形式 |  |  | 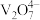 |
| 难溶电解质 |  |  |  |  |  |  |
 | 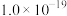 | 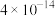 |  |  | 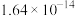 |  |
(1)写出基态V原子的价层电子排布式:
(2)“焙烧”的目的之一是将
 转化成
转化成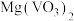 ,请写出转化的化学方程式:
,请写出转化的化学方程式:(3)“酸浸”时,为了提升各物质的浸出速率,除了适当升高温度外,还可以采取的措施是
(4)25℃,“调pH净化Ⅰ”时需将
 、
、 、
、 三种离子去除干净(浓度
三种离子去除干净(浓度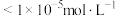 时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为
时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为(5)“净化Ⅱ”的目的是除
 、
、 ,若该过程加入过量
,若该过程加入过量 ,可能导致的结果是
,可能导致的结果是(6)“滤液1”中加入
 的目的是将
的目的是将 变成沉淀偏钒酸铵(
变成沉淀偏钒酸铵( ),简称“沉钒”。“沉钒”得到的
),简称“沉钒”。“沉钒”得到的 需进行洗涤、干燥,请写出证明
需进行洗涤、干燥,请写出证明 已洗净的实验操作及现象:
已洗净的实验操作及现象:(7)煅烧
 得到的产物中,可以在该流程中循环利用的物质是
得到的产物中,可以在该流程中循环利用的物质是(8)为测定该产品的纯度,某同学准确称取
 产品1.000g,加入过量稀硫酸使其完全转化成
产品1.000g,加入过量稀硫酸使其完全转化成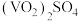 ,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的
,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的 标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中
标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中 被氧化为
被氧化为 ,该产品的纯度为
,该产品的纯度为
您最近一年使用:0次
名校
解题方法
8 . 三氧化二钴主要用作颜料、釉料及磁性材料,利用铜钻矿石制备Co2O3的工艺流程如图所示:
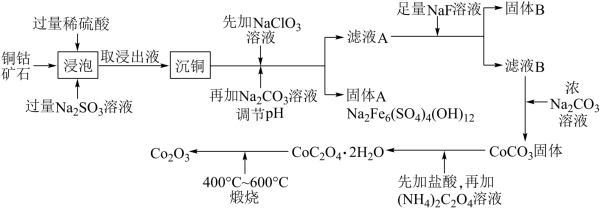
已知:铜钴矿石主要含有 CoO(OH)、CoCO3、Cu2(OH)2CO3,其中还含有一定量的Fe2O3、MgO和 CaO等。请回答下列问题:
(1)Co元素的价层电子排布式是___________ ,
(2)“浸泡”过程中,最好将铜钴矿石粉碎的原因是:___________ ,加入 Na2SO3 溶液的主要作用是:___________
(3)向“沉铜”后的滤液中加入 NaClO3 溶液,写出滤液中的金属离子与NaClO3反应的离子方程式为:___________ ,固体B的主要成分为:___________
(4)过滤出的 CoC2O4·2H2O固体经洗涤后,证明固体已洗净的操作是:___________ 。
(5)CoC2O4·2H2O在空气中高温烧得到 Co2O3的化学方程式是:___________ 。

已知:铜钴矿石主要含有 CoO(OH)、CoCO3、Cu2(OH)2CO3,其中还含有一定量的Fe2O3、MgO和 CaO等。请回答下列问题:
(1)Co元素的价层电子排布式是
(2)“浸泡”过程中,最好将铜钴矿石粉碎的原因是:
(3)向“沉铜”后的滤液中加入 NaClO3 溶液,写出滤液中的金属离子与NaClO3反应的离子方程式为:
(4)过滤出的 CoC2O4·2H2O固体经洗涤后,证明固体已洗净的操作是:
(5)CoC2O4·2H2O在空气中高温烧得到 Co2O3的化学方程式是:
您最近一年使用:0次
名校
解题方法
9 . Ⅰ.NaClO广泛用作水处理剂及漂白剂。
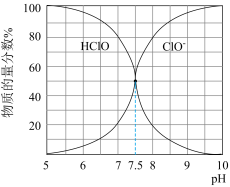
已知:25℃时NaClO溶液中HClO、 物质的量分数随pH的分布如右图所示。
物质的量分数随pH的分布如右图所示。
(1)工业上将 通入
通入 的NaOH溶液中制备NaClO。
的NaOH溶液中制备NaClO。
①NaClO属于___________ (填“酸”、“盐”、“氧化物”),制备NaClO的化学方程式为___________ 。
②溶液pH=9时,该溶液中主要存在的阴离子有___________ (填化学式)。
Ⅱ. 是一种重要的杀菌消毒剂,其一种生产工艺如下:
是一种重要的杀菌消毒剂,其一种生产工艺如下:
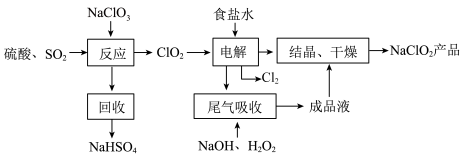
(2)写出“反应”步骤中生成 的化学方程式
的化学方程式___________ 。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去 和
和 ,要加入的试剂分别为
,要加入的试剂分别为___________ ,___________ 。精制时如何证明 已经完全除尽:
已经完全除尽:___________ 。
(4)“尾气吸收”是吸收“电解”过程排出的少量 ,发生如下反应:
,发生如下反应:
___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________
①配平上述化学方程式。___________
②某容器中发生一个化学反应,其中涉及 、
、 、
、 、
、 、
、 、
、 六种粒子。其中
六种粒子。其中 、
、 的物质的量随时间变化的曲线下图所示。
的物质的量随时间变化的曲线下图所示。

则该反应的离子方程式为:___________ 。
已知:25℃时NaClO溶液中HClO、
 物质的量分数随pH的分布如右图所示。
物质的量分数随pH的分布如右图所示。
(1)工业上将
 通入
通入 的NaOH溶液中制备NaClO。
的NaOH溶液中制备NaClO。①NaClO属于
②溶液pH=9时,该溶液中主要存在的阴离子有
Ⅱ.
 是一种重要的杀菌消毒剂,其一种生产工艺如下:
是一种重要的杀菌消毒剂,其一种生产工艺如下:
(2)写出“反应”步骤中生成
 的化学方程式
的化学方程式(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去
 和
和 ,要加入的试剂分别为
,要加入的试剂分别为 已经完全除尽:
已经完全除尽:(4)“尾气吸收”是吸收“电解”过程排出的少量
 ,发生如下反应:
,发生如下反应:___________
 ___________
___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________
①配平上述化学方程式。
②某容器中发生一个化学反应,其中涉及
 、
、 、
、 、
、 、
、 、
、 六种粒子。其中
六种粒子。其中 、
、 的物质的量随时间变化的曲线下图所示。
的物质的量随时间变化的曲线下图所示。
则该反应的离子方程式为:
您最近一年使用:0次
10 .  (钒酸铋)是一种黄色颜料。某小组以辉铋矿(含77.1%
(钒酸铋)是一种黄色颜料。某小组以辉铋矿(含77.1% 、19.5%Fe和3.4%
、19.5%Fe和3.4% )为原料制备钒酸铋,并回收
)为原料制备钒酸铋,并回收 制备食品抗氧化剂
制备食品抗氧化剂 的流程如下:
的流程如下: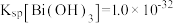 ,
,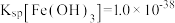 ;当金属离子浓度
;当金属离子浓度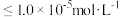 时,认为该离子已沉淀完全。请回答下列问题:
时,认为该离子已沉淀完全。请回答下列问题:
(1)“焙烧”中采用高压空气的目的是_______ , 转化成
转化成 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(2)浸渣的主要成分是_______ (填化学式)。
(3)“酸浸”得到的浸液中 ,则“除铁”调节pH的范围为
,则“除铁”调节pH的范围为_______ 。
(4)“合成”过程中将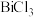 溶液和
溶液和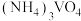 溶液混合容易形成
溶液混合容易形成 胶体,导致过滤困难。为防止生成胶体可采用的措施为
胶体,导致过滤困难。为防止生成胶体可采用的措施为_______ (答一条)。
(5)向饱和碳酸钠溶液中通入过量 可制得
可制得 ,发生反应的化学方程式为
,发生反应的化学方程式为_______ 。 易变质生成
易变质生成 ,设计简单实验证明产品是否变质:
,设计简单实验证明产品是否变质:_______ 。(已知: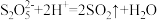 )
)
(6)某工厂用20吨该辉铋矿,最终得到18.468吨 ,则该过程中Bi的损耗率为
,则该过程中Bi的损耗率为______ %。
 (钒酸铋)是一种黄色颜料。某小组以辉铋矿(含77.1%
(钒酸铋)是一种黄色颜料。某小组以辉铋矿(含77.1% 、19.5%Fe和3.4%
、19.5%Fe和3.4% )为原料制备钒酸铋,并回收
)为原料制备钒酸铋,并回收 制备食品抗氧化剂
制备食品抗氧化剂 的流程如下:
的流程如下:
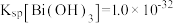 ,
,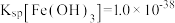 ;当金属离子浓度
;当金属离子浓度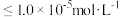 时,认为该离子已沉淀完全。请回答下列问题:
时,认为该离子已沉淀完全。请回答下列问题:(1)“焙烧”中采用高压空气的目的是
 转化成
转化成 发生反应的化学方程式为
发生反应的化学方程式为(2)浸渣的主要成分是
(3)“酸浸”得到的浸液中
 ,则“除铁”调节pH的范围为
,则“除铁”调节pH的范围为(4)“合成”过程中将
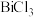 溶液和
溶液和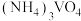 溶液混合容易形成
溶液混合容易形成 胶体,导致过滤困难。为防止生成胶体可采用的措施为
胶体,导致过滤困难。为防止生成胶体可采用的措施为(5)向饱和碳酸钠溶液中通入过量
 可制得
可制得 ,发生反应的化学方程式为
,发生反应的化学方程式为 易变质生成
易变质生成 ,设计简单实验证明产品是否变质:
,设计简单实验证明产品是否变质: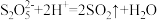 )
)(6)某工厂用20吨该辉铋矿,最终得到18.468吨
 ,则该过程中Bi的损耗率为
,则该过程中Bi的损耗率为
您最近一年使用:0次



