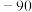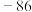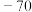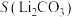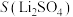1 . 以水钴矿(Co2O3·H2O,含Fe2O3、MgO、CaO)和辉铜矿(Cu2S,含SiO2、Fe2O3)为原料制取胆矾和单质钴。
①常温下,Ksp(MgF2)=6.25×10-9,Ksp(CaSO4)=7.1×10-7,Ksp(CoCO3)=2.4×10-7;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
③萃取Cu2+的反应原理;Cu2++2HR CuR2+2H+;
CuR2+2H+;
④Mg、Ca、Fe、Co均能与强酸反应产生H2。
回答下列问题:
(1)“酸浸”过程硫元素价态变为+6价,写出“酸浸”过程中主要反应的化学方程式:___________ 。
(2)“滤渣1”的主要成分为___________ 。
(3)常温下,“滤液1”中(Fe元素都以Fe3+形式存在)加“氧化铜”调pH不小于___________ 。
(4)常温下,若“滤液2”中c(Mg2+)=0.015mol/L(忽略溶液中极少量的Ca2+),除去2L“滤液2”中的Mg2+,至少需加入NaF固体的质量为___________ g(忽略溶液体积的变化)。
(5)“反萃取”步骤中加入的“试剂a”为___________ 。
(6)采用惰性电极电解CoCl2溶液﹑在无离子交换膜的条件下,不能用CoSO4溶液代替CoCl2溶液的理由是___________ 。
(7)将制得的胆矾配成溶液,先加入足量氨水,得到深蓝色溶液,再通入SO2至弱酸性,生成白色沉淀。经仪器分析:白色沉淀含H、N,O、S、Cu五种元素,且Cu∶N∶S=1∶4∶l;所含Cu离子中无单电子;晶体的部分组成微粒的空间构型分别为三角锥形和正四面体形。则白色沉淀的化学式为___________ 。
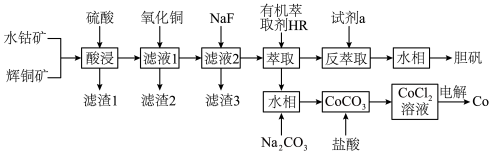
①常温下,Ksp(MgF2)=6.25×10-9,Ksp(CaSO4)=7.1×10-7,Ksp(CoCO3)=2.4×10-7;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 金属离子 | Fe3+ | Fe2+ | Co2+ | Cu2+ |
| 开始沉淀时(c=0.01mol/L)的pH | 2.7 | 7.5 | 7.6 | 4.7 |
| 完全沉淀时(c=10-5mol/L)的pH | 3.7 | 9.0 | 9.1 | 6.2 |
 CuR2+2H+;
CuR2+2H+;④Mg、Ca、Fe、Co均能与强酸反应产生H2。
回答下列问题:
(1)“酸浸”过程硫元素价态变为+6价,写出“酸浸”过程中主要反应的化学方程式:
(2)“滤渣1”的主要成分为
(3)常温下,“滤液1”中(Fe元素都以Fe3+形式存在)加“氧化铜”调pH不小于
(4)常温下,若“滤液2”中c(Mg2+)=0.015mol/L(忽略溶液中极少量的Ca2+),除去2L“滤液2”中的Mg2+,至少需加入NaF固体的质量为
(5)“反萃取”步骤中加入的“试剂a”为
(6)采用惰性电极电解CoCl2溶液﹑在无离子交换膜的条件下,不能用CoSO4溶液代替CoCl2溶液的理由是
(7)将制得的胆矾配成溶液,先加入足量氨水,得到深蓝色溶液,再通入SO2至弱酸性,生成白色沉淀。经仪器分析:白色沉淀含H、N,O、S、Cu五种元素,且Cu∶N∶S=1∶4∶l;所含Cu离子中无单电子;晶体的部分组成微粒的空间构型分别为三角锥形和正四面体形。则白色沉淀的化学式为
您最近一年使用:0次
解题方法
2 . 高纯 具有强的抗反射、抗氧化、抗老化的特性,可用于光学镀膜等对纯度要求较高的领域.以氟硅酸制备高纯
具有强的抗反射、抗氧化、抗老化的特性,可用于光学镀膜等对纯度要求较高的领域.以氟硅酸制备高纯 的工艺流程如下:
的工艺流程如下:
回答下列问题:
(1)纯 不稳定,易分解为
不稳定,易分解为 和
和___________ ,但其水溶液可以较稳定存在,能完全电离成 和
和 中心原子的配位数为
中心原子的配位数为___________ .
(2) 在热水中会发生水解,得到两种弱酸和一种盐,写出其发生的化学方程式为
在热水中会发生水解,得到两种弱酸和一种盐,写出其发生的化学方程式为______________________ .
(3)若没有“干燥”工序,会导致“热分解”产生的 纯度降低,其原因是
纯度降低,其原因是______________________ .
(4)“热分解”工序若采用直接加热分解的方式,会观察到生成的副产品1熔融包裹着未分解的物质,且发现随着时间延长分解效率增加不明显,解释原因______________________ .
(5)“合成”时,为了提升产品纯度,反应温度应该控制在___________  .
.
a.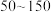 b.
b.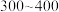 c.
c.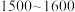
(6)在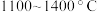 的条件下,将副产品2与
的条件下,将副产品2与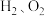 反应,可制得光导纤维的主要成分,反应的化学方程式为
反应,可制得光导纤维的主要成分,反应的化学方程式为______________________ .
 具有强的抗反射、抗氧化、抗老化的特性,可用于光学镀膜等对纯度要求较高的领域.以氟硅酸制备高纯
具有强的抗反射、抗氧化、抗老化的特性,可用于光学镀膜等对纯度要求较高的领域.以氟硅酸制备高纯 的工艺流程如下:
的工艺流程如下: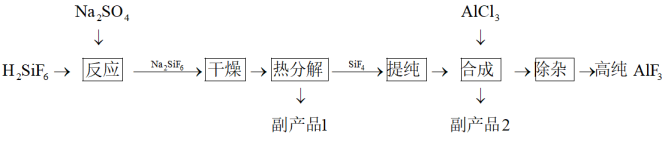
熔点 | 沸点 | 性质 | |
|
|
| 都易水解 |
|
| 57.6 | |
| 1040 | 1537 | |
| 194 | 178(升华) |
(1)纯
 不稳定,易分解为
不稳定,易分解为 和
和 和
和 中心原子的配位数为
中心原子的配位数为(2)
 在热水中会发生水解,得到两种弱酸和一种盐,写出其发生的化学方程式为
在热水中会发生水解,得到两种弱酸和一种盐,写出其发生的化学方程式为(3)若没有“干燥”工序,会导致“热分解”产生的
 纯度降低,其原因是
纯度降低,其原因是(4)“热分解”工序若采用直接加热分解的方式,会观察到生成的副产品1熔融包裹着未分解的物质,且发现随着时间延长分解效率增加不明显,解释原因
(5)“合成”时,为了提升产品纯度,反应温度应该控制在
 .
.a.
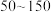 b.
b.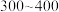 c.
c.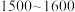
(6)在
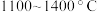 的条件下,将副产品2与
的条件下,将副产品2与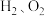 反应,可制得光导纤维的主要成分,反应的化学方程式为
反应,可制得光导纤维的主要成分,反应的化学方程式为
您最近一年使用:0次
解题方法
3 . 钛合金在航空航天领域有着广泛的应用.一种利用废脱硝催化剂(含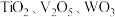 等成分)提取钛的工艺流程如图所示.下列说法错误的是
等成分)提取钛的工艺流程如图所示.下列说法错误的是
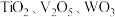 等成分)提取钛的工艺流程如图所示.下列说法错误的是
等成分)提取钛的工艺流程如图所示.下列说法错误的是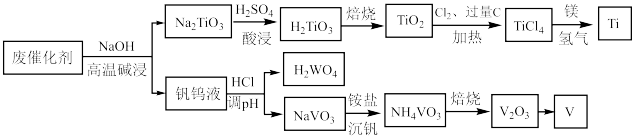
A.基态钛的价层电子排布式为 |
| B.上述流程中共涉及到3个氧化还原反应 |
C.高温碱浸生成 的离子方程式为: 的离子方程式为: |
| D.铝热反应制备钒与上述反应中镁冶炼钛的原理相似 |
您最近一年使用:0次
解题方法
4 . 2023 年诺贝尔化学奖授予发现量子点的三位科学家,量子点的尺寸一般在1 nm~10 nm之间,是一种纳米级别的半导体。量子点的尺寸不同,则发光颜色不同,吸收光谱波长不同。实验室一种制备CdSe量子点的方法如下:
一、CdSe量子点前驱体的制备
Ⅰ.N2气氛中,取1 mmol Se粉于三颈烧瓶中,加入15 mL的十八烯溶剂,加热到280℃,Se粉完全溶解形成橙色透明溶液;
Ⅱ.N2气氛中,将1 mmol CdCl2溶于4 mL油酸,加热至120℃,使CdCl2完全溶于油酸,形成油酸镉澄清液体。
二、CdSe量子点的生长与制备
Ⅲ.将步骤Ⅱ中制备好的油酸镉溶液注射至步骤Ⅰ中含有Se粉的三颈烧瓶中,如下图所示,保持反应温度为260℃,反应45min。
Ⅳ.待反应液冷却后,加入20 mL乙醇溶液,CdSe析出,离心分离,加入正己烷分散后,再次加入乙醇,离心分离,重复2~3次后,用乙醇和丙酮洗涤 CdSe,即可得到干净的CdSe量子点。
回答下列问题:
(1)Cd为第五周期ⅡB族,则Cd的价层电子排布式为___________ 。
(2)步骤Ⅱ中N2的作用为___________ ,油酸与镉配位的原子为___________ 。
(3)Se的一种制备方法如下:向Na2SeO3水溶液中加入 进行还原,得Se单质,过滤,洗涤,干燥,静置。制备过程中,会产生一种对环境无污染的气体,则该反应的离子方程式为
进行还原,得Se单质,过滤,洗涤,干燥,静置。制备过程中,会产生一种对环境无污染的气体,则该反应的离子方程式为___________ ;此方法获得Se单质过程中无需使用的仪器是___________ (填名称)。___________ 现象时,证明CdSe量子点生长基本停止,制备完成。除此方法外,还可利用___________ 物理现象初步鉴定CdSe量子点制备成功。
(5)步骤Ⅳ中加入20 mL乙醇的作用是___________ 。
(6)CdSe洗涤干净的标志是___________ 。
一、CdSe量子点前驱体的制备
Ⅰ.N2气氛中,取1 mmol Se粉于三颈烧瓶中,加入15 mL的十八烯溶剂,加热到280℃,Se粉完全溶解形成橙色透明溶液;
Ⅱ.N2气氛中,将1 mmol CdCl2溶于4 mL油酸,加热至120℃,使CdCl2完全溶于油酸,形成油酸镉澄清液体。
二、CdSe量子点的生长与制备
Ⅲ.将步骤Ⅱ中制备好的油酸镉溶液注射至步骤Ⅰ中含有Se粉的三颈烧瓶中,如下图所示,保持反应温度为260℃,反应45min。
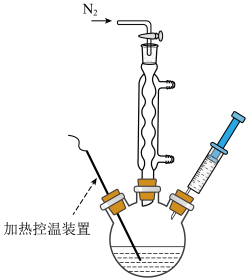
Ⅳ.待反应液冷却后,加入20 mL乙醇溶液,CdSe析出,离心分离,加入正己烷分散后,再次加入乙醇,离心分离,重复2~3次后,用乙醇和丙酮洗涤 CdSe,即可得到干净的CdSe量子点。
回答下列问题:
(1)Cd为第五周期ⅡB族,则Cd的价层电子排布式为
(2)步骤Ⅱ中N2的作用为
(3)Se的一种制备方法如下:向Na2SeO3水溶液中加入
 进行还原,得Se单质,过滤,洗涤,干燥,静置。制备过程中,会产生一种对环境无污染的气体,则该反应的离子方程式为
进行还原,得Se单质,过滤,洗涤,干燥,静置。制备过程中,会产生一种对环境无污染的气体,则该反应的离子方程式为
(5)步骤Ⅳ中加入20 mL乙醇的作用是
(6)CdSe洗涤干净的标志是
您最近一年使用:0次
2024-05-13更新
|
119次组卷
|
2卷引用:东北三省四市教研联合体2024届高三下学期高考模拟(二)化学试题
名校
5 . 以赤泥(含有大量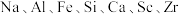 等的氧化物)为原料制备钪的工艺流程如下。
等的氧化物)为原料制备钪的工艺流程如下。
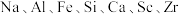 等的氧化物)为原料制备钪的工艺流程如下。
等的氧化物)为原料制备钪的工艺流程如下。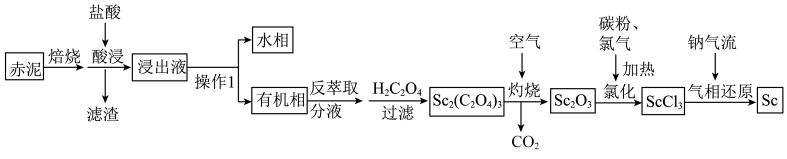
A. 位于元素周期表的第四周期ⅧB族 位于元素周期表的第四周期ⅧB族 |
| B.操作1使用的主要玻璃仪器为漏斗、烧杯 |
C.灼烧时生成 ,消耗 ,消耗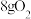 |
D.盐酸溶解 时生成难溶的 时生成难溶的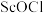 的离子反应为 的离子反应为 |
您最近一年使用:0次
2024-05-13更新
|
153次组卷
|
2卷引用:湖南省长沙市一中2024届高三下学期高考适应性演练(三)化学试题
名校
6 . 实验室以 溶液和碳酸氢铵溶液制备氧钒(IV)碱式碳酸铵晶体
溶液和碳酸氢铵溶液制备氧钒(IV)碱式碳酸铵晶体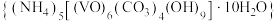 ,装置如图所示。已知:
,装置如图所示。已知: 能被
能被 氧化。下列说法不正确的是
氧化。下列说法不正确的是
 溶液和碳酸氢铵溶液制备氧钒(IV)碱式碳酸铵晶体
溶液和碳酸氢铵溶液制备氧钒(IV)碱式碳酸铵晶体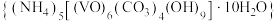 ,装置如图所示。已知:
,装置如图所示。已知: 能被
能被 氧化。下列说法不正确的是
氧化。下列说法不正确的是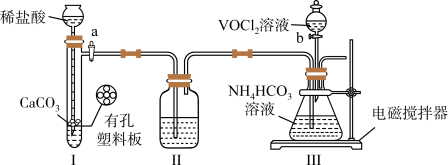
A.Ⅱ中的试剂为饱和 溶液 溶液 |
B.实验开始时应先打开活塞 ,一段时间后,再打开活塞 ,一段时间后,再打开活塞 |
| C.Ⅲ中的反应为氧化还原反应 |
D.反应完全,小心取下分液漏斗,停止通气,立即塞上橡胶塞,将锥形瓶置于 保护下的干燥器中,静置过夜,得到晶体 保护下的干燥器中,静置过夜,得到晶体 |
您最近一年使用:0次
2024-05-13更新
|
293次组卷
|
2卷引用:湖南省新高考教学教研联盟2023-2024学年高三下学期第二次联考化学试题
名校
解题方法
7 . 以 为载体的钯催化剂常用于石化行业加氢催化裂化过程中,工业上以失活后的废
为载体的钯催化剂常用于石化行业加氢催化裂化过程中,工业上以失活后的废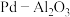 催化剂(主要含有Pd、
催化剂(主要含有Pd、 ,还有少量PdO、
,还有少量PdO、 、C)为原料制备氯化钯的流程如下:
、C)为原料制备氯化钯的流程如下:
(1)“氯化浸出”前必须“焙烧”去除废催化剂表面积碳,原因是_______ ,焙烧时间过长,“氯化浸出”率下降,可能的原因是_______ 。
(2) 中Cl原子的杂化类型是
中Cl原子的杂化类型是_______ ,“氯化浸出”时,若盐酸浓度过高,可能发生的副反应离子方程式为_______ 。
(3)滤渣1主要成分为_______ ,已知 ,若要使溶液中
,若要使溶液中 不高于
不高于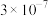 ,则应加入氨水使pH不低于
,则应加入氨水使pH不低于_______ 。
(4)工业上也可用 还原
还原 制取海绵Pd,该历程对环境友好。该反应的化学方程式为
制取海绵Pd,该历程对环境友好。该反应的化学方程式为_______ 。
(5)工业上测定Pd含量的原理为:试样用硝酸及盐酸溶解后,加过量EDTA络合钯,用锌标准溶液滴定过剩的EDTA.具体步聚如下:
I.标定锌标准溶液对钯的滴定度:
a.吸取25mLEDTA溶液置于烧杯中,滴加4~5滴盐酸,加适量水,用锌标准溶液滴定至终点,消耗锌标准溶液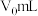 。
。
b.吸取15mL含0.0010gPd的Pd标准溶液于烧杯中,加入25mLEDTA溶液,加适量水用锌标准溶液滴定至试液由黄色变成紫红色为终点,消耗锌标准溶液 。
。
Ⅱ.滴定式样:
称取0.1000g试样置于烧杯中,加适量硝酸及盐酸充分溶解并作妥善处理,加入25mLEDT溶液,用锌标准溶液滴定至终点,消耗锌标准溶液VmL。则试样中Pd的质量分数为_______ %(用含V、 、
、 的式子表示)。
的式子表示)。
 为载体的钯催化剂常用于石化行业加氢催化裂化过程中,工业上以失活后的废
为载体的钯催化剂常用于石化行业加氢催化裂化过程中,工业上以失活后的废 催化剂(主要含有Pd、
催化剂(主要含有Pd、 ,还有少量PdO、
,还有少量PdO、 、C)为原料制备氯化钯的流程如下:
、C)为原料制备氯化钯的流程如下: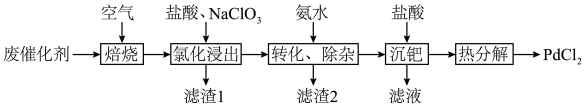
(1)“氯化浸出”前必须“焙烧”去除废催化剂表面积碳,原因是
(2)
 中Cl原子的杂化类型是
中Cl原子的杂化类型是(3)滤渣1主要成分为
 ,若要使溶液中
,若要使溶液中 不高于
不高于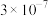 ,则应加入氨水使pH不低于
,则应加入氨水使pH不低于(4)工业上也可用
 还原
还原 制取海绵Pd,该历程对环境友好。该反应的化学方程式为
制取海绵Pd,该历程对环境友好。该反应的化学方程式为(5)工业上测定Pd含量的原理为:试样用硝酸及盐酸溶解后,加过量EDTA络合钯,用锌标准溶液滴定过剩的EDTA.具体步聚如下:
I.标定锌标准溶液对钯的滴定度:
a.吸取25mLEDTA溶液置于烧杯中,滴加4~5滴盐酸,加适量水,用锌标准溶液滴定至终点,消耗锌标准溶液
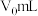 。
。b.吸取15mL含0.0010gPd的Pd标准溶液于烧杯中,加入25mLEDTA溶液,加适量水用锌标准溶液滴定至试液由黄色变成紫红色为终点,消耗锌标准溶液
 。
。Ⅱ.滴定式样:
称取0.1000g试样置于烧杯中,加适量硝酸及盐酸充分溶解并作妥善处理,加入25mLEDT溶液,用锌标准溶液滴定至终点,消耗锌标准溶液VmL。则试样中Pd的质量分数为
 、
、 的式子表示)。
的式子表示)。
您最近一年使用:0次
8 . 乙二胺四乙酸铁钠(化学式可用 表示,摩尔质量为
表示,摩尔质量为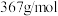 )可作为加铁盐和加铁酱油的铁剂。实验室利用废铁屑制备配合物乙二胺四乙酸铁钠的步骤如下:
)可作为加铁盐和加铁酱油的铁剂。实验室利用废铁屑制备配合物乙二胺四乙酸铁钠的步骤如下:
Ⅰ. 晶体制备
晶体制备
②快速搅拌条件下,向其中滴加氨水至过量,过滤并洗涤沉淀3次;
③将上述滤渣转移到三颈瓶中,保持80℃加热,边搅拌边逐滴滴加乙二胺四乙酸( )和碳酸钠溶液,调节
)和碳酸钠溶液,调节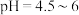 ,反应约1h;反应结束后将所得产品趁热减压过滤,将滤液加热浓缩至原体积
,反应约1h;反应结束后将所得产品趁热减压过滤,将滤液加热浓缩至原体积 ,冷却结晶得到土黄色高纯的
,冷却结晶得到土黄色高纯的 晶体。
晶体。
(1)步骤①盐酸过量的目的:一是作反应物,二是_______ 。
(2)写出上述颜色变为深棕色所发生离子反应方程式_______ 。
(3)滴加氨水时,滴加速率不宜过快且快速搅拌,其原因是_______ 。
(4)冷却水应从_______ (填“a”或“b”)口通入,仪器m的名称为_______ ;步骤③中宜采取的加热方式为_______ ;分离产品采取“趁热减压过滤”,趁热的目的是_______ 。
Ⅱ.纯度分析
准确称取20.00g产物放入 烧杯,加入
烧杯,加入 无氧蒸馏水和
无氧蒸馏水和 硫酸(
硫酸( ),搅拌溶解后,加入5g锌粉,加热反应30min,过滤,将得到的近无色溶液用
),搅拌溶解后,加入5g锌粉,加热反应30min,过滤,将得到的近无色溶液用 容量瓶定容。快速移取
容量瓶定容。快速移取 溶液至
溶液至 锥形瓶中,加入
锥形瓶中,加入
 混酸以掩蔽生成的
混酸以掩蔽生成的 的黄色,用
的黄色,用
 (
( )标准溶液平行滴定3次,平均消耗标准液
)标准溶液平行滴定3次,平均消耗标准液 。
。
(5) 标液应盛装在
标液应盛装在_______ (填“无色透明”或“棕色透明”)滴定管,滴定终点的现象为_______ 。
(6)上述 的纯度为
的纯度为_______ (保留4位有效数字)。
 表示,摩尔质量为
表示,摩尔质量为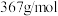 )可作为加铁盐和加铁酱油的铁剂。实验室利用废铁屑制备配合物乙二胺四乙酸铁钠的步骤如下:
)可作为加铁盐和加铁酱油的铁剂。实验室利用废铁屑制备配合物乙二胺四乙酸铁钠的步骤如下:Ⅰ.
 晶体制备
晶体制备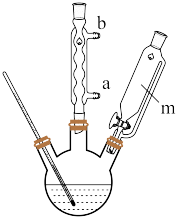
②快速搅拌条件下,向其中滴加氨水至过量,过滤并洗涤沉淀3次;
③将上述滤渣转移到三颈瓶中,保持80℃加热,边搅拌边逐滴滴加乙二胺四乙酸(
 )和碳酸钠溶液,调节
)和碳酸钠溶液,调节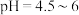 ,反应约1h;反应结束后将所得产品趁热减压过滤,将滤液加热浓缩至原体积
,反应约1h;反应结束后将所得产品趁热减压过滤,将滤液加热浓缩至原体积 ,冷却结晶得到土黄色高纯的
,冷却结晶得到土黄色高纯的 晶体。
晶体。(1)步骤①盐酸过量的目的:一是作反应物,二是
(2)写出上述颜色变为深棕色所发生离子反应方程式
(3)滴加氨水时,滴加速率不宜过快且快速搅拌,其原因是
(4)冷却水应从
Ⅱ.纯度分析
准确称取20.00g产物放入
 烧杯,加入
烧杯,加入 无氧蒸馏水和
无氧蒸馏水和 硫酸(
硫酸( ),搅拌溶解后,加入5g锌粉,加热反应30min,过滤,将得到的近无色溶液用
),搅拌溶解后,加入5g锌粉,加热反应30min,过滤,将得到的近无色溶液用 容量瓶定容。快速移取
容量瓶定容。快速移取 溶液至
溶液至 锥形瓶中,加入
锥形瓶中,加入
 混酸以掩蔽生成的
混酸以掩蔽生成的 的黄色,用
的黄色,用
 (
( )标准溶液平行滴定3次,平均消耗标准液
)标准溶液平行滴定3次,平均消耗标准液 。
。(5)
 标液应盛装在
标液应盛装在(6)上述
 的纯度为
的纯度为
您最近一年使用:0次
解题方法
9 . 碳酸锂是制备锂电池的重要原料。一种由α—锂辉石(主要成分可用 表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下:
表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下: ,各离子沉淀pH范围:
,各离子沉淀pH范围:
回答下列问题:
(1)“煅烧”过程中 转化为
转化为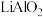 ,写出
,写出 与生石灰反应的化学反应方程式
与生石灰反应的化学反应方程式_______ 。
(2)硫酸作为浸取酸时需要加入少量硝酸,其作用是_______ ;“调节pH”步骤应当控制的pH范围为_______ ,
(3)写出“除锰”过程中的离子反应方程式_______ 。若“除钙”后滤液中Li+浓度为0.2mol/L,则该步骤后 浓度应该低于
浓度应该低于_______ mol/L。
(4)已知 、
、 的溶解度(g/100g水)如下表所示:
的溶解度(g/100g水)如下表所示:
“沉锂”后应该选择_______ ℃(选填“20”、“50”和“80”)蒸馏水洗涤,写出检验沉淀是否洗涤干净的操作_______ 。
(5)“沉锂”后所得碳酸锂再次经过“碳化”—“热解”步骤的目的是_______ 。将碳酸锂与 混合,在空气中焙烧可制备电池阴极材料
混合,在空气中焙烧可制备电池阴极材料 ,写出其化学反应方程式
,写出其化学反应方程式_______ 。
 表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下:
表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下:
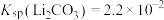 ,各离子沉淀pH范围:
,各离子沉淀pH范围:离子 |
|
|
|
|
开始沉淀pH | 7.6 | 2.7 | 3.8 | 8.3 |
沉淀完全pH | 9.7 | 3.2 | 5.2 | 9.8 |
(1)“煅烧”过程中
 转化为
转化为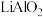 ,写出
,写出 与生石灰反应的化学反应方程式
与生石灰反应的化学反应方程式(2)硫酸作为浸取酸时需要加入少量硝酸,其作用是
(3)写出“除锰”过程中的离子反应方程式
 浓度应该低于
浓度应该低于(4)已知
 、
、 的溶解度(g/100g水)如下表所示:
的溶解度(g/100g水)如下表所示:T/℃ | 20 | 50 | 80 |
| 1.33 | 1.10 | 0.85 |
| 34.2 | 32.5 | 30.7 |
(5)“沉锂”后所得碳酸锂再次经过“碳化”—“热解”步骤的目的是
 混合,在空气中焙烧可制备电池阴极材料
混合,在空气中焙烧可制备电池阴极材料 ,写出其化学反应方程式
,写出其化学反应方程式
您最近一年使用:0次
10 . 下列化学反应与方程式相符的是
A.氢氧化钠溶液中加入过量草酸: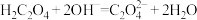 |
B.碱性条件下,氢氧化铁与次氯酸钠溶液反应制备高铁酸钠 : :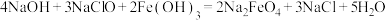 |
C.工业制取高纯硅: |
D.尿素与甲醛反应生成某线型脲醛树脂: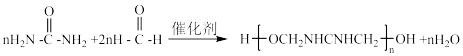 |
您最近一年使用:0次