1 . 硫酸亚硝酰合铁(Ⅱ)在现代化工行业有着广泛的应用,其一种工业制备流程如图所示。回答下列问题:

(1)“洗涤”的具体操作是将废铁屑置于 溶液中并加热至沸腾一段时间,加热至沸腾的好处是
溶液中并加热至沸腾一段时间,加热至沸腾的好处是___________ ,请写出“酸浸”副产物的一种用途:___________ 。
(2)“合成”阶段可在如图所示的装置中完成(加热及夹持装置略)。___________ ,向圆底烧瓶中加入稀硫酸前需要先通入一段时间的 ,否则易出现的不良后果是
,否则易出现的不良后果是___________ 。
②装置 中有
中有 生成,反应的离子方程式为
生成,反应的离子方程式为___________ ,装置 的作用是
的作用是___________ 。
③硫酸亚硝酰合铁(Ⅱ)化学式的确定。
(3)取一定量产品溶于水配制成 溶液,进行实验:
溶液,进行实验:
ⅰ.取 配制的溶液于试管中,加入足量
配制的溶液于试管中,加入足量 溶液,最终可得到
溶液,最终可得到 干燥纯净的白色沉淀。
干燥纯净的白色沉淀。
ⅱ.取 配制的溶液于试管中,用
配制的溶液于试管中,用 酸性
酸性 溶液滴定,滴定至终点时消耗酸性
溶液滴定,滴定至终点时消耗酸性 溶液
溶液 (最终氮元素全部以
(最终氮元素全部以 形式存在)。
形式存在)。
①“步骤ⅱ”滴定终点时的现象为___________ ,产品中
___________ 。
②若要确定产品化学式,则还需要获得一个数据,该数据是___________ 。

(1)“洗涤”的具体操作是将废铁屑置于
 溶液中并加热至沸腾一段时间,加热至沸腾的好处是
溶液中并加热至沸腾一段时间,加热至沸腾的好处是(2)“合成”阶段可在如图所示的装置中完成(加热及夹持装置略)。

 ,否则易出现的不良后果是
,否则易出现的不良后果是②装置
 中有
中有 生成,反应的离子方程式为
生成,反应的离子方程式为 的作用是
的作用是③硫酸亚硝酰合铁(Ⅱ)化学式的确定。
(3)取一定量产品溶于水配制成
 溶液,进行实验:
溶液,进行实验:ⅰ.取
 配制的溶液于试管中,加入足量
配制的溶液于试管中,加入足量 溶液,最终可得到
溶液,最终可得到 干燥纯净的白色沉淀。
干燥纯净的白色沉淀。ⅱ.取
 配制的溶液于试管中,用
配制的溶液于试管中,用 酸性
酸性 溶液滴定,滴定至终点时消耗酸性
溶液滴定,滴定至终点时消耗酸性 溶液
溶液 (最终氮元素全部以
(最终氮元素全部以 形式存在)。
形式存在)。①“步骤ⅱ”滴定终点时的现象为

②若要确定产品化学式,则还需要获得一个数据,该数据是
您最近一年使用:0次
名校
2 . 高一年级小村同学最近通过学习了解到:“肼”( )是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。
)是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。
(1) 属于
属于_______ 化合物(填“离子化合物”或“共价化合物”),所含化学键类型有_______ (填“离子键”或“极性键”或“非极性键”)
(2)已知①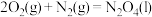
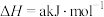
②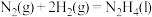
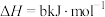
③
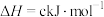
某型号火箭采用液态肼和液态 作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式
作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式________ 。
(3)液态肼可以除去水中的溶解氧,且生成物能参与大气循环。写出该反应的热化学方程式________ ,理论上每消耗64 g肼可除去标准状况下
________ L。
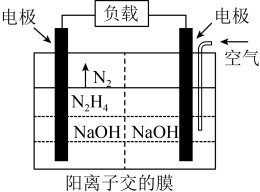
(4)科学家用肼作为燃料电池的燃料,电池结构如图所示,写出负极的电极反应式_________ 。
 )是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。
)是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。(1)
 属于
属于(2)已知①
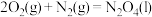
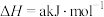
②
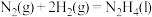
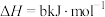
③

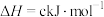
某型号火箭采用液态肼和液态
 作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式
作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式(3)液态肼可以除去水中的溶解氧,且生成物能参与大气循环。写出该反应的热化学方程式

(4)科学家用肼作为燃料电池的燃料,电池结构如图所示,写出负极的电极反应式

您最近一年使用:0次
解题方法
3 . 元素周期表可以用于探寻各种元素间的内在联系。
(1)下列关于元素周期表的说法错误的是______ 。
a.门捷列夫按照原子的核电荷数由小到大排列制出了第一张元素周期表
b.元素周期表由三个短周期,四个长周期构成
c.在金属和非金属的分界线处寻找半导体材料
d.元素周期表中含有主族、副族、第VⅢ族、0族等十八个族
(2)利用元素在周期表中的位置、结构、性质的关系,得出的结论正确的是______ 。
a.原子半径:Li>Na>K b.酸性:H3PO4>H2SO4>HClO4
c.稳定性:H2Se>H2S>H2O d.碱性:NaOH>Mg(OH)2>Al(OH)3
(3)碳族元素包括:C、Si、Ge、Sn、Pb、Fl(放射性元素)
①请完成CO2和KOH溶液恰好反应生成正盐的离子方程式_______ 。
②写出Si在元素周期表中的位置_______ 。由碳族元素结构特点,可推测Pb3O4中Pb的化合价为_____ 。
(4)卤族元素包括:F、Cl、Br、I、At(放射性元素)
①Br与F的原子序数的差值为______ 。
②已知某溶液中只含有Fe2+、Cl﹣、Br﹣、I﹣,且c(Cl﹣):c(Br﹣):c(I﹣)=1:1:2,则c(Fe2+):c(Br﹣)=____ 。向其中通入一定量的氯气发生反应,当c(Fe2+):c(Cl﹣)=1:4时,离子方程式为_____ 。
(1)下列关于元素周期表的说法错误的是
a.门捷列夫按照原子的核电荷数由小到大排列制出了第一张元素周期表
b.元素周期表由三个短周期,四个长周期构成
c.在金属和非金属的分界线处寻找半导体材料
d.元素周期表中含有主族、副族、第VⅢ族、0族等十八个族
(2)利用元素在周期表中的位置、结构、性质的关系,得出的结论正确的是
a.原子半径:Li>Na>K b.酸性:H3PO4>H2SO4>HClO4
c.稳定性:H2Se>H2S>H2O d.碱性:NaOH>Mg(OH)2>Al(OH)3
(3)碳族元素包括:C、Si、Ge、Sn、Pb、Fl(放射性元素)
①请完成CO2和KOH溶液恰好反应生成正盐的离子方程式
②写出Si在元素周期表中的位置
(4)卤族元素包括:F、Cl、Br、I、At(放射性元素)
①Br与F的原子序数的差值为
②已知某溶液中只含有Fe2+、Cl﹣、Br﹣、I﹣,且c(Cl﹣):c(Br﹣):c(I﹣)=1:1:2,则c(Fe2+):c(Br﹣)=
您最近一年使用:0次
解题方法
4 . 某化学兴趣小组为探究 的性质,按下图装置进行实验。回答下列问题:
的性质,按下图装置进行实验。回答下列问题:_______ ,A中发生反应的化学方程式为_______ 。
(2)B中出现淡黄色沉淀,则证明 具有
具有______ 性,发生反应的化学方程式为______ 。
(3)装置B、C、D中能够证明 具有还原性的是
具有还原性的是____ (填字母),观察到的现象为____ 。
(4)当反应进行一段时间后,装置E中最终生成少量红色沉淀,为确定红色沉淀的成分,进行以下实验:_______ (填“只有Cu”“只有 ”或“Cu和
”或“Cu和 的混合物”);E中出现少量红色沉淀的总反应的离子方程式为
的混合物”);E中出现少量红色沉淀的总反应的离子方程式为_______ 。
(5)在三颈烧瓶中加入 溶液和
溶液和 溶液,在加热条件下通入
溶液,在加热条件下通入 充分反应生成
充分反应生成 ,将含
,将含 的溶液进行结晶,可得到
的溶液进行结晶,可得到 晶体样品。用
晶体样品。用 溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取
溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取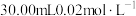 的
的 溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。
溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。
已知实验过程中发生的反应的计算关系式为: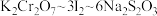 。则该样品的纯度为
。则该样品的纯度为_______ %(保留三位有效数字)。
 的性质,按下图装置进行实验。回答下列问题:
的性质,按下图装置进行实验。回答下列问题: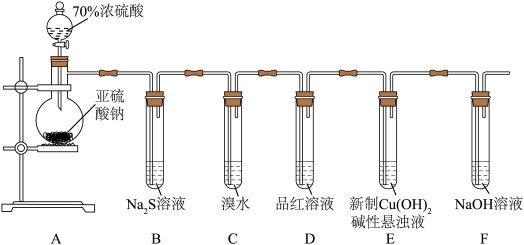
(2)B中出现淡黄色沉淀,则证明
 具有
具有(3)装置B、C、D中能够证明
 具有还原性的是
具有还原性的是(4)当反应进行一段时间后,装置E中最终生成少量红色沉淀,为确定红色沉淀的成分,进行以下实验:

 ”或“Cu和
”或“Cu和 的混合物”);E中出现少量红色沉淀的总反应的离子方程式为
的混合物”);E中出现少量红色沉淀的总反应的离子方程式为(5)在三颈烧瓶中加入
 溶液和
溶液和 溶液,在加热条件下通入
溶液,在加热条件下通入 充分反应生成
充分反应生成 ,将含
,将含 的溶液进行结晶,可得到
的溶液进行结晶,可得到 晶体样品。用
晶体样品。用 溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取
溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取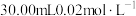 的
的 溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。
溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。已知实验过程中发生的反应的计算关系式为:
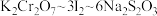 。则该样品的纯度为
。则该样品的纯度为
您最近一年使用:0次
解题方法
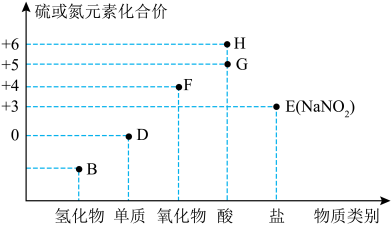
5 . “价—类”二维图是学习元素化合物的一种好方法。硫或氮及其化合物的部分“价—类”二维图如图所示,回答下列问题: ,写出F和G的稀溶液反应生成H的化学方程式(还原产物为+2价氧化物):
,写出F和G的稀溶液反应生成H的化学方程式(还原产物为+2价氧化物):_______ 。
(2)若B为 ,则下列关于氨气的性质和用途描述正确的是_______(填字母)。
,则下列关于氨气的性质和用途描述正确的是_______(填字母)。
(3)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸( ),该反应的化学方程式为
),该反应的化学方程式为_______ ;某厂废液中含有2%~5%的 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为
转化为 的是
的是_______ (填字母)。
A.NaOH B. C.
C. D.浓硫酸
D.浓硫酸
(4)D可以是 ,已知同温同压下,同体积的
,已知同温同压下,同体积的 与
与 (蒸气)的质量比为7:64,则x=
(蒸气)的质量比为7:64,则x=_____ 。
(5) 在空气中易变质,写出检验
在空气中易变质,写出检验 发生变质的实验方法:
发生变质的实验方法:_______ 。
(6)常温下,G的浓溶液可以用干燥的铁或铝制容器盛装,原因是_______ 。
 ,写出F和G的稀溶液反应生成H的化学方程式(还原产物为+2价氧化物):
,写出F和G的稀溶液反应生成H的化学方程式(还原产物为+2价氧化物):(2)若B为
 ,则下列关于氨气的性质和用途描述正确的是_______(填字母)。
,则下列关于氨气的性质和用途描述正确的是_______(填字母)。| A.氨气易液化;液氨可用作制冷剂 | B.可用排水法收集氨气 |
| C.氨气是一种无色、无味的气体 | D.向氨水中滴加酚酞,溶液变红 |
(3)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(
 ),该反应的化学方程式为
),该反应的化学方程式为 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为
转化为 的是
的是A.NaOH B.
 C.
C. D.浓硫酸
D.浓硫酸(4)D可以是
 ,已知同温同压下,同体积的
,已知同温同压下,同体积的 与
与 (蒸气)的质量比为7:64,则x=
(蒸气)的质量比为7:64,则x=(5)
 在空气中易变质,写出检验
在空气中易变质,写出检验 发生变质的实验方法:
发生变质的实验方法:(6)常温下,G的浓溶液可以用干燥的铁或铝制容器盛装,原因是
您最近一年使用:0次
6 . 氢化铝锂( )是有机合成的重要还原剂,实验中利用氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到
)是有机合成的重要还原剂,实验中利用氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到 晶体。
晶体。
(一)制备无水
已知 的沸点为178℃,在潮湿的空气中易水解。某实验小组利用纯净的
的沸点为178℃,在潮湿的空气中易水解。某实验小组利用纯净的 与铝粉反应制备无水
与铝粉反应制备无水 (夹持装置略去)。
(夹持装置略去)。___________ 。
(2)装置的连接顺序(从左至右)为A→___________ 。
(3)装置D的作用是___________ 。
(二)制备
①LiH、 均溶于乙醚,产品
均溶于乙醚,产品 难溶于苯,可溶于乙醚、四氢呋喃;
难溶于苯,可溶于乙醚、四氢呋喃;
②LiH、 在潮湿的空气中均会发生剧烈水解,释放大量
在潮湿的空气中均会发生剧烈水解,释放大量 ;
;
③乙醚,沸点34.5℃,易燃,易溶于苯等有机溶剂,一般不与金属单质反应。
(4)制取 的实验原理
的实验原理___________ (用化学方程式表示)。
(5)下列说法中正确的是___________。
(三)产品的纯度测定(不含LiH)
(6)实际生产中 的纯度是关键指标,常温常压下,称取a g
的纯度是关键指标,常温常压下,称取a g 样品,按图所示装置测定纯度,反应前量气管读数为
样品,按图所示装置测定纯度,反应前量气管读数为 mL,倾斜Y形管,将足量蒸馏水(掺有四氢呋喃可减缓反应)注入样品中,反应完毕冷却后,量气管读数为
mL,倾斜Y形管,将足量蒸馏水(掺有四氢呋喃可减缓反应)注入样品中,反应完毕冷却后,量气管读数为 mL。该装置中的量气管由
mL。该装置中的量气管由___________ (填“酸式”或“碱式”)滴定管改装,该样品纯度为___________ (用含a、 、
、 的代数式表示)。(注:常温常压下气体摩尔体积约为24.5L/mol)
的代数式表示)。(注:常温常压下气体摩尔体积约为24.5L/mol)
 )是有机合成的重要还原剂,实验中利用氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到
)是有机合成的重要还原剂,实验中利用氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到 晶体。
晶体。(一)制备无水

已知
 的沸点为178℃,在潮湿的空气中易水解。某实验小组利用纯净的
的沸点为178℃,在潮湿的空气中易水解。某实验小组利用纯净的 与铝粉反应制备无水
与铝粉反应制备无水 (夹持装置略去)。
(夹持装置略去)。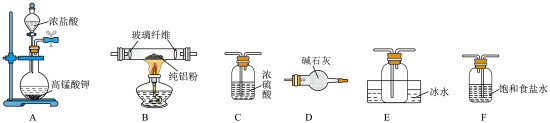
(2)装置的连接顺序(从左至右)为A→
(3)装置D的作用是
(二)制备


①LiH、
 均溶于乙醚,产品
均溶于乙醚,产品 难溶于苯,可溶于乙醚、四氢呋喃;
难溶于苯,可溶于乙醚、四氢呋喃;②LiH、
 在潮湿的空气中均会发生剧烈水解,释放大量
在潮湿的空气中均会发生剧烈水解,释放大量 ;
;③乙醚,沸点34.5℃,易燃,易溶于苯等有机溶剂,一般不与金属单质反应。
(4)制取
 的实验原理
的实验原理(5)下列说法中正确的是___________。
| A.市售乙醚中含少量水,可以利用金属钠或五氧化二磷除去 |
| B.滤渣A的主要成分是LiCl |
C.为提高合成 的速率,可将反应温度提高至40℃ 的速率,可将反应温度提高至40℃ |
| D.操作B可以在分液漏斗中进行,乙醚经回收提纯后可循环使用 |
(三)产品的纯度测定(不含LiH)
(6)实际生产中
 的纯度是关键指标,常温常压下,称取a g
的纯度是关键指标,常温常压下,称取a g 样品,按图所示装置测定纯度,反应前量气管读数为
样品,按图所示装置测定纯度,反应前量气管读数为 mL,倾斜Y形管,将足量蒸馏水(掺有四氢呋喃可减缓反应)注入样品中,反应完毕冷却后,量气管读数为
mL,倾斜Y形管,将足量蒸馏水(掺有四氢呋喃可减缓反应)注入样品中,反应完毕冷却后,量气管读数为 mL。该装置中的量气管由
mL。该装置中的量气管由 、
、 的代数式表示)。(注:常温常压下气体摩尔体积约为24.5L/mol)
的代数式表示)。(注:常温常压下气体摩尔体积约为24.5L/mol)
您最近一年使用:0次
名校
7 . 羟基氧化铁 为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
 .产品制备及产率计算
.产品制备及产率计算
①制备晶种:称取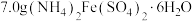 放入三颈烧瓶中,加入
放入三颈烧瓶中,加入 去离子水,恒温水浴加热至
去离子水,恒温水浴加热至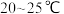 ,搅拌溶解,慢慢滴加
,搅拌溶解,慢慢滴加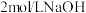 溶液,用
溶液,用 试纸检验至溶液
试纸检验至溶液 为
为 ,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
②氧化过程:称取足量 ,加入上述溶液,于
,加入上述溶液,于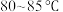 恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加
恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加 溶液至
溶液至 为
为 时,停止加热。
时,停止加热。
③洗涤、干燥:用去离子水洗涤生成的固体,抽滤,弃去母液,得到淡黄色固体。将其转入蒸发皿中,在水浴加热条件下烘干,称量,计算产率。
回答下列问题:
(1)用 试纸检验溶液
试纸检验溶液 的操作为
的操作为___________ 。
(2)①中观察到沉淀的颜色变为___________ 色时,证明已经成功制备晶种。
(3)②氧化过程中,发生反应的离子方程式为___________ 。
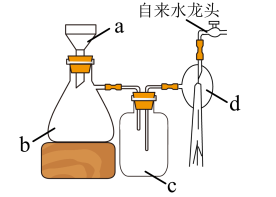
(4)抽滤装置如图,仪器c的作用为___________ ,和普通过滤相比,抽滤的优点有过滤速度更快和___________ 。 .产品纯度测定
.产品纯度测定
铁黄纯度可以通过产品的耗酸量确定。 ,
,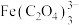 不与稀
不与稀 溶液反应。
溶液反应。
(5)铁黄溶于 标准液的离子方程式为
标准液的离子方程式为___________ 。
(6) 标准液和
标准液和 标准液浓度均为
标准液浓度均为 ,消耗两溶液的体积依次为
,消耗两溶液的体积依次为 ,计算铁黄的纯度为
,计算铁黄的纯度为___________ (列出计算式,不需化简)。
(7)若 溶液过量,会使测定结果
溶液过量,会使测定结果___________ (填“偏大”、“偏小”或“无影响”)。(已知草酸的电离平衡常数: )
)
 为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下: .产品制备及产率计算
.产品制备及产率计算①制备晶种:称取
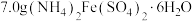 放入三颈烧瓶中,加入
放入三颈烧瓶中,加入 去离子水,恒温水浴加热至
去离子水,恒温水浴加热至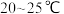 ,搅拌溶解,慢慢滴加
,搅拌溶解,慢慢滴加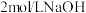 溶液,用
溶液,用 试纸检验至溶液
试纸检验至溶液 为
为 ,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。②氧化过程:称取足量
 ,加入上述溶液,于
,加入上述溶液,于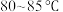 恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加
恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加 溶液至
溶液至 为
为 时,停止加热。
时,停止加热。③洗涤、干燥:用去离子水洗涤生成的固体,抽滤,弃去母液,得到淡黄色固体。将其转入蒸发皿中,在水浴加热条件下烘干,称量,计算产率。
回答下列问题:
(1)用
 试纸检验溶液
试纸检验溶液 的操作为
的操作为(2)①中观察到沉淀的颜色变为
(3)②氧化过程中,发生反应的离子方程式为
(4)抽滤装置如图,仪器c的作用为
 .产品纯度测定
.产品纯度测定铁黄纯度可以通过产品的耗酸量确定。

 ,
,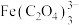 不与稀
不与稀 溶液反应。
溶液反应。(5)铁黄溶于
 标准液的离子方程式为
标准液的离子方程式为(6)
 标准液和
标准液和 标准液浓度均为
标准液浓度均为 ,消耗两溶液的体积依次为
,消耗两溶液的体积依次为 ,计算铁黄的纯度为
,计算铁黄的纯度为(7)若
 溶液过量,会使测定结果
溶液过量,会使测定结果 )
)
您最近一年使用:0次
2024-05-26更新
|
394次组卷
|
3卷引用:2024届黑龙江省哈尔滨师范大学附属中学高三下学期三模化学试题
解题方法
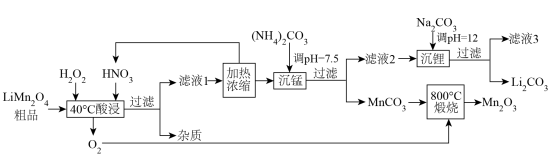
8 . 利用硝酸、过氧化氢对废弃锂电池中的正极材料LiMn2O4进行处理,回收Li、Mn元素,工艺流程如下:
(1)通过仪器分析可知LiMn2O4晶体中锰元素由 、
、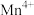 构成,它们的个数比为
构成,它们的个数比为___________ 。
(2)为了提高“酸浸”的效率,可采取的方法有___________ (答出2条)。“滤液1”的主要溶质有LiNO3、 ,写出“酸浸”时发生反应的离子方程式
,写出“酸浸”时发生反应的离子方程式___________ 。
(3)在“酸浸”时,若用盐酸替代硝酸,可能产生的不良影响是___________ ,请评价若流程中缺少“加热浓缩”步骤后工艺的优缺点___________ (优点和缺点各写一条)。
(4)“沉锂”试剂不选用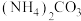 的原因可能是
的原因可能是___________ (写出一条)。
(5)写出“800℃煅烧” 时发生反应的化学方程式
时发生反应的化学方程式___________ 。
(6)若“沉锂”前“滤液2”中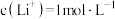 ,取1L该溶液加入等体积Na2CO3溶液充分反应后溶液中
,取1L该溶液加入等体积Na2CO3溶液充分反应后溶液中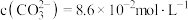 ,则该实验中锂离子的沉淀率为
,则该实验中锂离子的沉淀率为___________ %(已知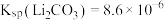 ,混合后溶液体积变化忽略不计)。
,混合后溶液体积变化忽略不计)。
(1)通过仪器分析可知LiMn2O4晶体中锰元素由
 、
、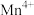 构成,它们的个数比为
构成,它们的个数比为(2)为了提高“酸浸”的效率,可采取的方法有
 ,写出“酸浸”时发生反应的离子方程式
,写出“酸浸”时发生反应的离子方程式(3)在“酸浸”时,若用盐酸替代硝酸,可能产生的不良影响是
(4)“沉锂”试剂不选用
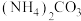 的原因可能是
的原因可能是(5)写出“800℃煅烧”
 时发生反应的化学方程式
时发生反应的化学方程式(6)若“沉锂”前“滤液2”中
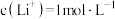 ,取1L该溶液加入等体积Na2CO3溶液充分反应后溶液中
,取1L该溶液加入等体积Na2CO3溶液充分反应后溶液中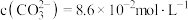 ,则该实验中锂离子的沉淀率为
,则该实验中锂离子的沉淀率为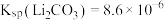 ,混合后溶液体积变化忽略不计)。
,混合后溶液体积变化忽略不计)。
您最近一年使用:0次
名校
解题方法
9 .  纳米材料是一种很有发展前景的储能材料,用菱锰矿(主要成分为
纳米材料是一种很有发展前景的储能材料,用菱锰矿(主要成分为 ,含有少量CaO、MgO、FeO、
,含有少量CaO、MgO、FeO、 、
、 等)制备
等)制备 纳米材料的工艺流程如图所示。
纳米材料的工艺流程如图所示。 如表所示。
如表所示。
回答下列问题:
(1)“酸浸”中提高反应速率的可行措施有___________ (任答一条);酸浸渣的主要成分是___________ (填化学式)。
(2)加入 的目的是氧化
的目的是氧化___________ (填离子符号),写出该离子被氧化生成沉淀的离子方程式:___________ 。
(3)回收的沉淀可与浓硫酸反应生成能腐蚀玻璃的气体, 与浓硫酸在加热的条件下反应的化学方程式为
与浓硫酸在加热的条件下反应的化学方程式为___________ ;25℃时,沉淀后的滤液中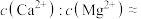
___________ (写最简整数比)。
(4)用去离子水多次洗涤 纳米材料,检验沉淀是否洗涤干净的操作为
纳米材料,检验沉淀是否洗涤干净的操作为___________ 。
(5)“高压釜水热反应”溶液pH应调节为中性,而不能过高的原因是___________ 。
 纳米材料是一种很有发展前景的储能材料,用菱锰矿(主要成分为
纳米材料是一种很有发展前景的储能材料,用菱锰矿(主要成分为 ,含有少量CaO、MgO、FeO、
,含有少量CaO、MgO、FeO、 、
、 等)制备
等)制备 纳米材料的工艺流程如图所示。
纳米材料的工艺流程如图所示。
 如表所示。
如表所示。| 物质 |  |  |  |  |
 | 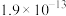 |  | 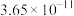 | 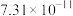 |
| 物质 |  |  |  | |
 | 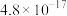 | 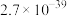 |  |
(1)“酸浸”中提高反应速率的可行措施有
(2)加入
 的目的是氧化
的目的是氧化(3)回收的沉淀可与浓硫酸反应生成能腐蚀玻璃的气体,
 与浓硫酸在加热的条件下反应的化学方程式为
与浓硫酸在加热的条件下反应的化学方程式为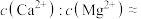
(4)用去离子水多次洗涤
 纳米材料,检验沉淀是否洗涤干净的操作为
纳米材料,检验沉淀是否洗涤干净的操作为(5)“高压釜水热反应”溶液pH应调节为中性,而不能过高的原因是
您最近一年使用:0次
2024-05-26更新
|
165次组卷
|
2卷引用:2024届重庆市渝西中学高三下学期模拟预测化学试题
名校
10 . 硫酸亚铁铵[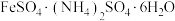 ,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
第一步:在圆底烧瓶中称取mg铁屑,再用量筒量取15mL 的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。
的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。 溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
第三步:冷却至室温,待有大量晶体析出时,减压过滤,用试剂N少量多次洗涤,干燥后,称得晶体质量为11.8g。计算产率。
回答下列问题:
(1)硫酸亚铁铵中组成元素的原子半径由大到小的顺序为___________ 。
(2)已知:Cr的3d比4p能量低得多,重铬酸钾具有二聚结构,它由两个通过氧原子键合在一起的铬原子组成,中心Cr为正四面体形,结构为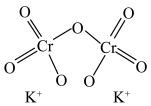 ,其中Cr原子的杂化方式为___________(填标号)。
,其中Cr原子的杂化方式为___________(填标号)。
(3)圆底烧瓶中生成 的离子方程式为
的离子方程式为___________ 。
(4)第二步中需要称量剩余铁屑质量的原因为___________ ,写出制备硫酸亚铁铵晶体的化学方程式:___________ 。
(5)试剂N是___________ 。
(6)准确称取0.8g硫酸亚铁铵晶体三份,分别放入三个250mL锥形瓶中,加入100mL水,20mL 的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用
的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用 重铬酸钾标准液进行滴定。
重铬酸钾标准液进行滴定。
①重铬酸钾在酸性条件下的还原产物为 ,写出该滴定反应的离子方程式:
,写出该滴定反应的离子方程式:___________ 。
②三次实验消耗标准液的体积分别是16.75mL、16.80mL、16.85mL,则硫酸亚铁铵晶体的纯度为___________ (写出含M的表达式)。
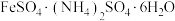 ,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:第一步:在圆底烧瓶中称取mg铁屑,再用量筒量取15mL
 的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。
的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。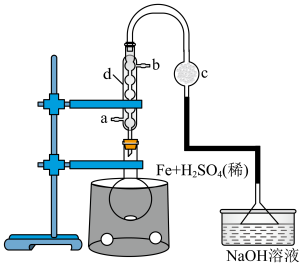
 溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。第三步:冷却至室温,待有大量晶体析出时,减压过滤,用试剂N少量多次洗涤,干燥后,称得晶体质量为11.8g。计算产率。
回答下列问题:
(1)硫酸亚铁铵中组成元素的原子半径由大到小的顺序为
(2)已知:Cr的3d比4p能量低得多,重铬酸钾具有二聚结构,它由两个通过氧原子键合在一起的铬原子组成,中心Cr为正四面体形,结构为
 ,其中Cr原子的杂化方式为___________(填标号)。
,其中Cr原子的杂化方式为___________(填标号)。A. | B. | C. | D.sp |
(3)圆底烧瓶中生成
 的离子方程式为
的离子方程式为(4)第二步中需要称量剩余铁屑质量的原因为
(5)试剂N是
(6)准确称取0.8g硫酸亚铁铵晶体三份,分别放入三个250mL锥形瓶中,加入100mL水,20mL
 的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用
的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用 重铬酸钾标准液进行滴定。
重铬酸钾标准液进行滴定。①重铬酸钾在酸性条件下的还原产物为
 ,写出该滴定反应的离子方程式:
,写出该滴定反应的离子方程式:②三次实验消耗标准液的体积分别是16.75mL、16.80mL、16.85mL,则硫酸亚铁铵晶体的纯度为
您最近一年使用:0次
2024-05-26更新
|
127次组卷
|
2卷引用:2024届重庆市渝西中学高三下学期模拟预测化学试题



