 纳米材料是一种很有发展前景的储能材料,用菱锰矿(主要成分为
纳米材料是一种很有发展前景的储能材料,用菱锰矿(主要成分为 ,含有少量CaO、MgO、FeO、
,含有少量CaO、MgO、FeO、 、
、 等)制备
等)制备 纳米材料的工艺流程如图所示。
纳米材料的工艺流程如图所示。
 如表所示。
如表所示。| 物质 |  |  |  |  |
 | 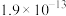 |  | 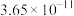 | 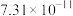 |
| 物质 |  |  |  | |
 | 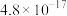 | 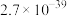 |  |
(1)“酸浸”中提高反应速率的可行措施有
(2)加入
 的目的是氧化
的目的是氧化(3)回收的沉淀可与浓硫酸反应生成能腐蚀玻璃的气体,
 与浓硫酸在加热的条件下反应的化学方程式为
与浓硫酸在加热的条件下反应的化学方程式为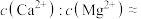
(4)用去离子水多次洗涤
 纳米材料,检验沉淀是否洗涤干净的操作为
纳米材料,检验沉淀是否洗涤干净的操作为(5)“高压釜水热反应”溶液pH应调节为中性,而不能过高的原因是
更新时间:2024-05-26 09:36:31
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】活性炭载钯(Pd/C)催化剂被广泛应用于医药和化工行业,某废钯催化剂(钯碳)的杂质主要含炭、有机物及少量Fe等。如图是利用钯碳制备氯化钯(PdCl2)和Pd的流程。

回答下列问题:
(1)“钯灰”中的主要成分有PdO,加入甲酸(HCOOH),可以将PdO还原成金属单质,请写出HCOOH还原PdO的化学方程式___________ 。
(2)“焚烧”的目的是____ ;实验室中可在___________ (填仪器名称)中模拟该过程。
(3)王水是将浓盐酸和浓硝酸混合而得到的强氧化性溶液,加热条件下钯在王水中发生反应生成H2[PdCl4]和一种有毒的无色气体A,该气体遇空气变红棕色,该反应中消耗的HCl与HNO3的物质的量之比为___________ 。
(4)加入浓氨水,调节溶液pH至9.0,并控制温度在70 ~75℃,Pd元素以 的形式存在:
的形式存在:
①若温度大于75℃,则不利于除铁,原因是___________
②已知:黄色晶体的成分为 ,在合并液中加盐酸时,发生反应的离子方程式为
,在合并液中加盐酸时,发生反应的离子方程式为___________ 。
(5)洗涤滤渣并将洗涤液与滤液合并,其意义是___________ 。
(6)Pd是优良的储氢金属,假设海绵状金属钯密度为,ρg·cm-3标准状况下其吸附的氢气是其体积的n倍,则此条件下海绵钯的储氢容量R=___________ mL·g-1(储氢容量R即1g钯吸附氢气的体积)。

回答下列问题:
(1)“钯灰”中的主要成分有PdO,加入甲酸(HCOOH),可以将PdO还原成金属单质,请写出HCOOH还原PdO的化学方程式
(2)“焚烧”的目的是
(3)王水是将浓盐酸和浓硝酸混合而得到的强氧化性溶液,加热条件下钯在王水中发生反应生成H2[PdCl4]和一种有毒的无色气体A,该气体遇空气变红棕色,该反应中消耗的HCl与HNO3的物质的量之比为
(4)加入浓氨水,调节溶液pH至9.0,并控制温度在70 ~75℃,Pd元素以
 的形式存在:
的形式存在:①若温度大于75℃,则不利于除铁,原因是
②已知:黄色晶体的成分为
 ,在合并液中加盐酸时,发生反应的离子方程式为
,在合并液中加盐酸时,发生反应的离子方程式为(5)洗涤滤渣并将洗涤液与滤液合并,其意义是
(6)Pd是优良的储氢金属,假设海绵状金属钯密度为,ρg·cm-3标准状况下其吸附的氢气是其体积的n倍,则此条件下海绵钯的储氢容量R=
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】二氧化钒(VO2)是一种新型热敏材料。实验室以V2O5为原料合成用于制备VO2的氧钒(IV)碱式碳酸铵晶体,过程如下:
V2O5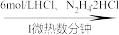 VOCl2溶液
VOCl2溶液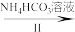 (NH4)5[(VO)6(CO3)4(OH)9]·10H2O
(NH4)5[(VO)6(CO3)4(OH)9]·10H2O
回答下列问题:
(1)步骤I中生成VOCl2的同时生成一种无色无污染的气体,该反应的化学方程式为_______ 。已知:氧化性:V2O5>Cl2,则加入N2H4·2HCl的作用是_______ 。
(2)步骤II可在如图装置(气密性良好)中进行。已知:VO2+能被O2氧化。
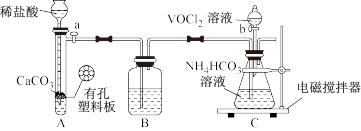
装置B中盛装的试剂是_______ ;向C中通入是CO2的作用是_______ 。
(3)加完VOCl2溶液后继续搅拌数分钟,使反应完全,小心取下分液漏斗,停止通气,立即塞上橡胶塞,将锥形瓶置于CO2保护下的干燥器中,静置过夜,得到紫色晶体,过滤。此时紫色晶体上残留的杂质离子主要为_______ ,接下来的简要操作是_______ ,最后用乙醚洗涤2-3次,干燥后称重。(所用药品为:饱和NH4HCO3溶液,无水乙醇)。
(4)测定氧钒(IV)碱式碳酸铵晶体粗产品中钒的含量。称量5.1000g样品于锥形瓶中,用硫酸溶液溶解后得到含VO2+的溶液,加稍过量的0.0200 mol/L的KMnO4溶液将VO2+氧化为VO ,充分反应后加入特定的还原剂X除去过量的KMnO4,最后用0.0800 mol/L的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为30.00mL。(滴定反应:
,充分反应后加入特定的还原剂X除去过量的KMnO4,最后用0.0800 mol/L的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为30.00mL。(滴定反应: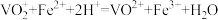 )
)
①在该实验条件下,还原剂X与Mn2+、VO2+的还原性由大到小为_______ 。
②粗产品中钒元素的质量分数为_______ 。(保留四位有效数字)
V2O5
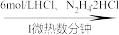 VOCl2溶液
VOCl2溶液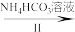 (NH4)5[(VO)6(CO3)4(OH)9]·10H2O
(NH4)5[(VO)6(CO3)4(OH)9]·10H2O回答下列问题:
(1)步骤I中生成VOCl2的同时生成一种无色无污染的气体,该反应的化学方程式为
(2)步骤II可在如图装置(气密性良好)中进行。已知:VO2+能被O2氧化。

装置B中盛装的试剂是
(3)加完VOCl2溶液后继续搅拌数分钟,使反应完全,小心取下分液漏斗,停止通气,立即塞上橡胶塞,将锥形瓶置于CO2保护下的干燥器中,静置过夜,得到紫色晶体,过滤。此时紫色晶体上残留的杂质离子主要为
(4)测定氧钒(IV)碱式碳酸铵晶体粗产品中钒的含量。称量5.1000g样品于锥形瓶中,用硫酸溶液溶解后得到含VO2+的溶液,加稍过量的0.0200 mol/L的KMnO4溶液将VO2+氧化为VO
 ,充分反应后加入特定的还原剂X除去过量的KMnO4,最后用0.0800 mol/L的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为30.00mL。(滴定反应:
,充分反应后加入特定的还原剂X除去过量的KMnO4,最后用0.0800 mol/L的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为30.00mL。(滴定反应: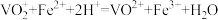 )
)①在该实验条件下,还原剂X与Mn2+、VO2+的还原性由大到小为
②粗产品中钒元素的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】氟化镨(PrF3)常用于电弧碳棒添加剂。利用方镨矿精矿(Pr2S3,难溶于水)制备氟化镨的流程如下:
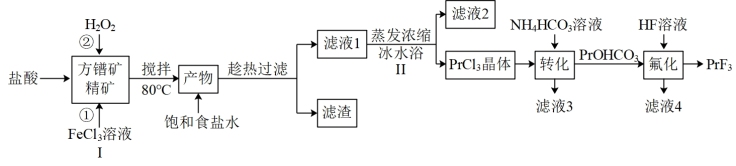
已知:① ;
;
② 、
、 以氢氧化物的形式完全沉淀时,溶液的pH分别为3.2、10.1。
以氢氧化物的形式完全沉淀时,溶液的pH分别为3.2、10.1。
(1)步骤I中加入 溶液后生成
溶液后生成 和S,该反应中氧化剂与还原剂的物质的量之比为
和S,该反应中氧化剂与还原剂的物质的量之比为_______ ,加入盐酸的另一个目的是控制pH在0.5~1.0,原因是_______ 。
(2)请用离子方程式解释反应②中加入 的作用:
的作用:_______ 。
(3)请用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因:_______ 。
(4)完成 溶液转化为
溶液转化为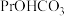 沉淀的离子方程式:□
沉淀的离子方程式:□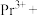 □
□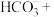 □
□ □
□ □
□ 。
。_______
(5)滤液3可用作_______ 。
(6)镨蓄电池具有稳定性高等有点,充电后两个电极上沉积的 分别转化为
分别转化为 和Pr,充电时阴极的电极反应式为
和Pr,充电时阴极的电极反应式为_______ 。

已知:①
 ;
;②
 、
、 以氢氧化物的形式完全沉淀时,溶液的pH分别为3.2、10.1。
以氢氧化物的形式完全沉淀时,溶液的pH分别为3.2、10.1。(1)步骤I中加入
 溶液后生成
溶液后生成 和S,该反应中氧化剂与还原剂的物质的量之比为
和S,该反应中氧化剂与还原剂的物质的量之比为(2)请用离子方程式解释反应②中加入
 的作用:
的作用:(3)请用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因:
(4)完成
 溶液转化为
溶液转化为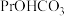 沉淀的离子方程式:□
沉淀的离子方程式:□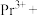 □
□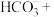 □
□ □
□ □
□ 。
。(5)滤液3可用作
(6)镨蓄电池具有稳定性高等有点,充电后两个电极上沉积的
 分别转化为
分别转化为 和Pr,充电时阴极的电极反应式为
和Pr,充电时阴极的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】榴石矿石可以看作由CaO、FeO、Fe2O3、Al2O3、SiO2组成。工业上对其进行综合利用的流程如下:
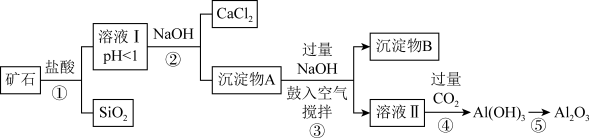
(1)溶液Ⅰ中除了Ca2+外,还可能含有的金属阳离子有__________________ ;
(2)步骤③中NaOH参加反应的离子方程式____________________________ ,鼓入空气并充分搅拌的目的是(用化学方程式表示)____________________ ;
(3)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是_____________________ 。

(1)溶液Ⅰ中除了Ca2+外,还可能含有的金属阳离子有
(2)步骤③中NaOH参加反应的离子方程式
(3)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下, 回答下列问题:_______ 。
(2)Na2B4O7易溶于水,也易发生水解: (硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:
(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:_______ 。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式_______ 。加入MgO的目的是_______ 。
(4)已知MgSO4、CaSO4的溶解度(g/100g)如下表:
“操作A”是除去MgSO4和CaSO4混合溶液中的CaSO4,根据上表数据,简要说明“操作A”步骤为_______ 。
(5)NaBH4被称为有机化学中的“万能还原剂”,工业上可由硼砂制取,其晶胞结构及晶胞参数如图所示:_______ 。
②若选定A为坐标原点,则B的分数坐标为_______ 。
③NA代表阿伏加德罗常数的值,则NaBH4晶体的密度为_______ g•cm-3(用含a、NA的式子表示)。

(2)Na2B4O7易溶于水,也易发生水解:
 (硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:
(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式
(4)已知MgSO4、CaSO4的溶解度(g/100g)如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(5)NaBH4被称为有机化学中的“万能还原剂”,工业上可由硼砂制取,其晶胞结构及晶胞参数如图所示:

②若选定A为坐标原点,则B的分数坐标为
③NA代表阿伏加德罗常数的值,则NaBH4晶体的密度为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】某油脂厂废弃的油脂加氢镍催化剂主要含金属 、
、 、
、 及其氧化物,还有少量其他不溶性物质。采用如下所示工艺流程回收其中的镍制备硫酸镍晶体
及其氧化物,还有少量其他不溶性物质。采用如下所示工艺流程回收其中的镍制备硫酸镍晶体 :
:

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“碱浸”中 的两个作用分别是
的两个作用分别是_______ 。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式:_______ 。
(2)“滤液②”中含有的金属离子是_______ 。
(3)“转化”中可替代 的物质是
的物质是_______ 。若工艺流程改为先“调 ”后“转化”,即
”后“转化”,即

“滤液③”中可能含有的杂质离子为_______ 。
(4)利用上述表格数据,计算 的
的
_______ (列出计算式)。如果“转化”后的溶液中 浓度为
浓度为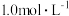 ,则“调
,则“调 ”应控制的
”应控制的 范围是
范围是_______ 。
(5)硫酸镍在强碱溶液中用 氧化,可沉淀出用作镍镉电池正极材料的
氧化,可沉淀出用作镍镉电池正极材料的 。写出该反应的离子方程式:
。写出该反应的离子方程式:_______ 。
 、
、 、
、 及其氧化物,还有少量其他不溶性物质。采用如下所示工艺流程回收其中的镍制备硫酸镍晶体
及其氧化物,还有少量其他不溶性物质。采用如下所示工艺流程回收其中的镍制备硫酸镍晶体 :
:
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
开始沉淀时(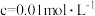 )的 )的 | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时(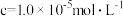 )的 )的 | 8.8 | 4.7 | 3.2 | 9.0 |
(1)“碱浸”中
 的两个作用分别是
的两个作用分别是(2)“滤液②”中含有的金属离子是
(3)“转化”中可替代
 的物质是
的物质是 ”后“转化”,即
”后“转化”,即
“滤液③”中可能含有的杂质离子为
(4)利用上述表格数据,计算
 的
的
 浓度为
浓度为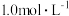 ,则“调
,则“调 ”应控制的
”应控制的 范围是
范围是(5)硫酸镍在强碱溶液中用
 氧化,可沉淀出用作镍镉电池正极材料的
氧化,可沉淀出用作镍镉电池正极材料的 。写出该反应的离子方程式:
。写出该反应的离子方程式:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】含硫化合物在生产、科研中应用广泛。请回答下列问题:
(1)多种多样的盐:
① 在染料工业中用于生产硫化染料,其水溶液显碱性的原因:
在染料工业中用于生产硫化染料,其水溶液显碱性的原因:_____________ (用离子反应方程式表示),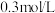 的
的 溶液与
溶液与 的
的 溶液中
溶液中
_____________  (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
② 可应用做医药、照相还原剂、染料中间体等,写出
可应用做医药、照相还原剂、染料中间体等,写出 溶液的质子守恒表达式:
溶液的质子守恒表达式:_____________ [用含离子浓度的关系式表示,用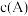 表示粒子A的浓度];③
表示粒子A的浓度];③ 可用作矿物分解助熔剂。已知:
可用作矿物分解助熔剂。已知: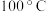 时,
时, 的
的 溶液中水电离的
溶液中水电离的 ,该温度下将
,该温度下将 的
的 溶液
溶液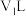 与
与 的
的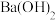 溶液
溶液 混合,所得溶液
混合,所得溶液 ,则
,则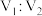 为
为_____________ (忽略溶液混合时的体积变化)。
(2) 可用于金属精制、农药、医药、催化剂再生。常温下,向
可用于金属精制、农药、医药、催化剂再生。常温下,向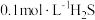 溶液中通入
溶液中通入 气体或加入
气体或加入 固体,测得
固体,测得 与溶液
与溶液 的关系如图所示(忽略体积的变化及)
的关系如图所示(忽略体积的变化及) 挥发)。
挥发)。

①当 时,溶液中
时,溶液中
_____________  ;
;
②当溶液 时,溶液中的
时,溶液中的
_____________  ;
;
③某溶液含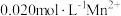 、
、 ,当溶液
,当溶液
_____________ 时, 开始沉淀[已知:
开始沉淀[已知: ]。
]。
(1)多种多样的盐:
①
 在染料工业中用于生产硫化染料,其水溶液显碱性的原因:
在染料工业中用于生产硫化染料,其水溶液显碱性的原因: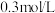 的
的 溶液与
溶液与 的
的 溶液中
溶液中
 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);②
 可应用做医药、照相还原剂、染料中间体等,写出
可应用做医药、照相还原剂、染料中间体等,写出 溶液的质子守恒表达式:
溶液的质子守恒表达式: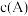 表示粒子A的浓度];③
表示粒子A的浓度];③ 可用作矿物分解助熔剂。已知:
可用作矿物分解助熔剂。已知: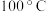 时,
时, 的
的 溶液中水电离的
溶液中水电离的 ,该温度下将
,该温度下将 的
的 溶液
溶液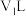 与
与 的
的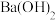 溶液
溶液 混合,所得溶液
混合,所得溶液 ,则
,则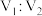 为
为(2)
 可用于金属精制、农药、医药、催化剂再生。常温下,向
可用于金属精制、农药、医药、催化剂再生。常温下,向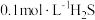 溶液中通入
溶液中通入 气体或加入
气体或加入 固体,测得
固体,测得 与溶液
与溶液 的关系如图所示(忽略体积的变化及)
的关系如图所示(忽略体积的变化及) 挥发)。
挥发)。
①当
 时,溶液中
时,溶液中
 ;
;②当溶液
 时,溶液中的
时,溶液中的
 ;
;③某溶液含
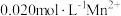 、
、 ,当溶液
,当溶液
 开始沉淀[已知:
开始沉淀[已知: ]。
]。
您最近一年使用:0次
【推荐2】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g),ΔH1=-49.58kJ·mol-1
CH3OH(g)+H2O(g),ΔH1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g),ΔH2
CO(g)+H2O(g),ΔH2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g),ΔH3=-90.77kJ·mol-1
CH3OH(g),ΔH3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的ΔH2=___________ 。
(2)反应Ⅲ能够自发进行的条件是___________ 。(填“较低温度”“较高温度”或“任何温度”)。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是___________。
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是________。

(5)若在1 L密闭容器中充入2.5 molH2和1 molCO2发生反应I,则图中M点时,产物甲醇的体积分数为___________ ,该温度下反应的平衡常数K=___________ 。
(6)已知下列物质在20°C下的Ksp如下,试回答下列问题:
①向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时 =
=___________ 。
②测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是___________ 。
A.KBr B.KI C.K2S D.K2CrO4
反应Ⅰ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),ΔH1=-49.58kJ·mol-1
CH3OH(g)+H2O(g),ΔH1=-49.58kJ·mol-1反应Ⅱ:CO2(g)+H2(g)
 CO(g)+H2O(g),ΔH2
CO(g)+H2O(g),ΔH2反应Ⅲ:CO(g)+2H2(g)
 CH3OH(g),ΔH3=-90.77kJ·mol-1
CH3OH(g),ΔH3=-90.77kJ·mol-1回答下列问题:
(1)反应Ⅱ的ΔH2=
(2)反应Ⅲ能够自发进行的条件是
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是___________。
| A.混合气体的密度不再变化 |
| B.混合气体的平均相对分子质量不再变化 |
| C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1 |
| D.甲醇的百分含量不再变化 |

| A.其他条件不变,若不使用催化剂,则250°C时CO2的平衡转化率可能位于M1 |
| B.温度低于250°C时,随温度升高甲醇的产率增大 |
| C.M点时平衡常数比N点时平衡常数大 |
| D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率 |
(6)已知下列物质在20°C下的Ksp如下,试回答下列问题:
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.4×10-13 | 8.3×10-17 | 6.3×10-50 | 2.0×10-12 |
 =
=②测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是
A.KBr B.KI C.K2S D.K2CrO4
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】镉可用于制造体积小和电容量大的电池,可利用铜镉渣[主要成分为镉,还含有少量锌、铜、铁、钴( )等杂质]来制备,工艺流程如图1。
)等杂质]来制备,工艺流程如图1。
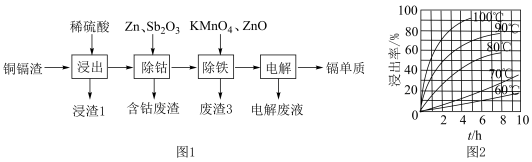
回答下列问题:
(1)酸浸中,镉的浸出率结果如图2所示。由图2可知,当镉的浸出率为80%时,所采用的实验条件为__ 。
(2)滤渣1是____ (填名称),滤渣3的主要成分是____ (填化学式)和 。
。
(3)除钴过程中,含 的浸出液中需要加入
的浸出液中需要加入 、
、 产生合金
产生合金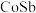 ,该反应的离子方程式为
,该反应的离子方程式为__ ,若设计成原电池,则锌在____ 极发生反应。
(4)除铁时先加入适量的 溶液,其目的是
溶液,其目的是____ ;再加入 ,调节溶液的
,调节溶液的 至
至____ 。
相关金属离子[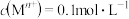 ]形成氢氧化物沉淀的
]形成氢氧化物沉淀的 范围如表。
范围如表。
(5)已知室温下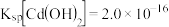 。若采用生石灰处理含镉电解废液,当测得室温下溶液的
。若采用生石灰处理含镉电解废液,当测得室温下溶液的 为10时,溶液中的
为10时,溶液中的 浓度是
浓度是____ 。
 )等杂质]来制备,工艺流程如图1。
)等杂质]来制备,工艺流程如图1。
回答下列问题:
(1)酸浸中,镉的浸出率结果如图2所示。由图2可知,当镉的浸出率为80%时,所采用的实验条件为
(2)滤渣1是
 。
。(3)除钴过程中,含
 的浸出液中需要加入
的浸出液中需要加入 、
、 产生合金
产生合金 ,该反应的离子方程式为
,该反应的离子方程式为(4)除铁时先加入适量的
 溶液,其目的是
溶液,其目的是 ,调节溶液的
,调节溶液的 至
至相关金属离子[
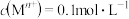 ]形成氢氧化物沉淀的
]形成氢氧化物沉淀的 范围如表。
范围如表。| 金属离子 |  |  |  |
开始沉淀的 | 1.5 | 6.3 | 7.2 |
沉淀完全的 | 2.8 | 8.3 | 9.5 |
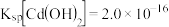 。若采用生石灰处理含镉电解废液,当测得室温下溶液的
。若采用生石灰处理含镉电解废液,当测得室温下溶液的 为10时,溶液中的
为10时,溶液中的 浓度是
浓度是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】以废锰渣(含 及少量KOH、MgO、
及少量KOH、MgO、 )为原料制备
)为原料制备 晶体,其工艺流程可表示为:
晶体,其工艺流程可表示为:

该工艺条件下金属离子开始沉淀和完全沉淀的pH如下表所示:
(1) 的基态核外电子排布式为
的基态核外电子排布式为_______ 。
(2)为提高酸浸过程中元素的浸出率,实验中可采取的措施有_______。(填字母)。
(3)“反应I”中加入硫铁矿(主要成分 )将
)将 还原为
还原为 ,本身变为
,本身变为 。滤渣1的主要成分除
。滤渣1的主要成分除 外,还有一种淡黄色的单质,写出该反应的离子方程式
外,还有一种淡黄色的单质,写出该反应的离子方程式_______ 。
(4)“反应II”中主要反应的离子方程式为_______ 。
(5)“调pH”步骤中,应调节溶液pH的范围是_______ 。
(6)锰的一种氧化物的晶胞如图所示,在该晶体中与一个锰原子等距离且最近的锰原子有_______ 个。

(7)测定产品纯度。取制得的 晶体0.1510g,溶于适量水中,加硫酸酸化;用过量
晶体0.1510g,溶于适量水中,加硫酸酸化;用过量 (难溶于水)将
(难溶于水)将 完全氧化为
完全氧化为 ,过滤洗涤;向滤液中加入
,过滤洗涤;向滤液中加入 固体0.5360g;充分反应后,用0.100
固体0.5360g;充分反应后,用0.100
 溶液滴定,用去8.00mL。
溶液滴定,用去8.00mL。
已知: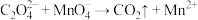 (未配平);
(未配平);
 ,
,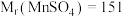 。
。
计算产品中 的质量分数
的质量分数_______ (写出计算过程,保留两位有效数字)。
 及少量KOH、MgO、
及少量KOH、MgO、 )为原料制备
)为原料制备 晶体,其工艺流程可表示为:
晶体,其工艺流程可表示为:
该工艺条件下金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀pH | 2.10 | 7.45 | 9.27 | 9.60 |
| 完全沉淀pH | 3.20 | 8.95 | 10.87 | 11.13 |
 的基态核外电子排布式为
的基态核外电子排布式为(2)为提高酸浸过程中元素的浸出率,实验中可采取的措施有_______。(填字母)。
| A.增加矿渣的投料量 | B.将矿渣粉碎并搅拌 | C.缩短酸浸的时间 | D.适当提高酸浸温度 |
 )将
)将 还原为
还原为 ,本身变为
,本身变为 。滤渣1的主要成分除
。滤渣1的主要成分除 外,还有一种淡黄色的单质,写出该反应的离子方程式
外,还有一种淡黄色的单质,写出该反应的离子方程式(4)“反应II”中主要反应的离子方程式为
(5)“调pH”步骤中,应调节溶液pH的范围是
(6)锰的一种氧化物的晶胞如图所示,在该晶体中与一个锰原子等距离且最近的锰原子有

(7)测定产品纯度。取制得的
 晶体0.1510g,溶于适量水中,加硫酸酸化;用过量
晶体0.1510g,溶于适量水中,加硫酸酸化;用过量 (难溶于水)将
(难溶于水)将 完全氧化为
完全氧化为 ,过滤洗涤;向滤液中加入
,过滤洗涤;向滤液中加入 固体0.5360g;充分反应后,用0.100
固体0.5360g;充分反应后,用0.100
 溶液滴定,用去8.00mL。
溶液滴定,用去8.00mL。已知:
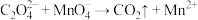 (未配平);
(未配平); ,
,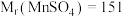 。
。计算产品中
 的质量分数
的质量分数
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】废钼催化剂中钼、钴、镍等有色金属作为二次资源可加以回收利用,一种从废钼催化剂(主要成分为 、
、 ,含少量CoO、CoS、NiO、
,含少量CoO、CoS、NiO、 等)中回收有色金属的一种工艺流程如图所示:
等)中回收有色金属的一种工艺流程如图所示: ;
;
②部分金属阳离子生成氢氧化物沉淀时溶液的pH如表所示:
回答下列问题:
(1)基态Mo原子的价电子排布式为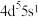 ,则Mo在元素周期表中的位置为
,则Mo在元素周期表中的位置为___________ 。
(2)“焙烧”时,采用“多层逆流焙烧”方法,即混合料与空气逆向而行,该方法的优点是___________ 。
(3)“焙烧”时 转化为
转化为 ,写出“碱浸”时
,写出“碱浸”时 参与反应的离子方程式:
参与反应的离子方程式:___________ 。
(4)“除铁”时,控制pH的范围为___________ 。
(5)“除铁”后所得滤液中 ,“沉镍”后所得滤液中
,“沉镍”后所得滤液中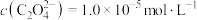 ,则沉镍率=
,则沉镍率=___________ [沉镍率=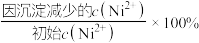 ,计算过程中不考虑溶液体积变化,保留三位有效数字]。
,计算过程中不考虑溶液体积变化,保留三位有效数字]。
(6)在空气中加热18.3g ,其残留固体质量与温度的关系如图所示。图中,a、c两点对应固体的成分分别是
,其残留固体质量与温度的关系如图所示。图中,a、c两点对应固体的成分分别是___________ 、___________ (填化学式,其中c为Co的氧化物)。 表示,则晶体的密度为
表示,则晶体的密度为___________  。
。
 、
、 ,含少量CoO、CoS、NiO、
,含少量CoO、CoS、NiO、 等)中回收有色金属的一种工艺流程如图所示:
等)中回收有色金属的一种工艺流程如图所示:
 ;
;②部分金属阳离子生成氢氧化物沉淀时溶液的pH如表所示:
| 金属阳离子 |  |  |  |
| 开始沉淀 | 7.0 | 2.3 | 7.1 |
| 沉淀完全 | 9.0 | 3.2 | 9.2 |
(1)基态Mo原子的价电子排布式为
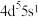 ,则Mo在元素周期表中的位置为
,则Mo在元素周期表中的位置为(2)“焙烧”时,采用“多层逆流焙烧”方法,即混合料与空气逆向而行,该方法的优点是
(3)“焙烧”时
 转化为
转化为 ,写出“碱浸”时
,写出“碱浸”时 参与反应的离子方程式:
参与反应的离子方程式:(4)“除铁”时,控制pH的范围为
(5)“除铁”后所得滤液中
 ,“沉镍”后所得滤液中
,“沉镍”后所得滤液中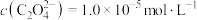 ,则沉镍率=
,则沉镍率=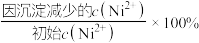 ,计算过程中不考虑溶液体积变化,保留三位有效数字]。
,计算过程中不考虑溶液体积变化,保留三位有效数字]。(6)在空气中加热18.3g
 ,其残留固体质量与温度的关系如图所示。图中,a、c两点对应固体的成分分别是
,其残留固体质量与温度的关系如图所示。图中,a、c两点对应固体的成分分别是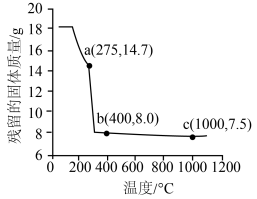
 表示,则晶体的密度为
表示,则晶体的密度为 。
。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】从钒铬锰矿渣(主要成分为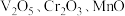 )中提铬的一种工艺流程如下:
)中提铬的一种工艺流程如下:
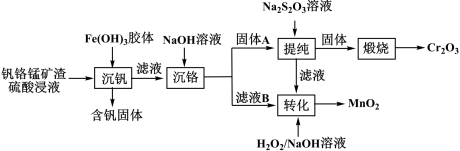
已知: 较大时,二价锰
较大时,二价锰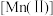 在空气中易被氧化。回答下列问题:
在空气中易被氧化。回答下列问题:
(1) 元素在周期表中的位置是
元素在周期表中的位置是___________ 。
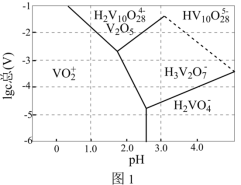
(2)常温下,各种形态五价钒粒子总浓度的对数 与
与 关系如图1,已知钒铬锰矿渣硫酸浸液中
关系如图1,已知钒铬锰矿渣硫酸浸液中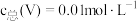 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为___________ (填化学式)。
(3)某温度下,Cr(Ⅲ)、Mn(Ⅱ)的沉淀率与pH关系如图2,“沉铬”过程最佳pH为_____ (填标号);
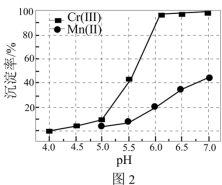
a.4.0 b.5.0 c.6.0
在该条件下滤液B中
______  [
[ 近似为
近似为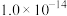 ,
, 的
的 近似为
近似为 ]。
]。
(4)“转化”过程中生成 的离子方程式为
的离子方程式为_________ 。
(5)“提纯”过程中 的作用为
的作用为________ 。
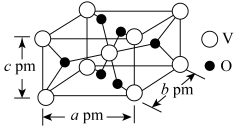
(6)一种含钒的氧化物晶胞结构如图所示,已知NA表示阿伏加德罗常数的值,则该晶体密度为_______ g•cm-3 (列出计算式即可)。
 )中提铬的一种工艺流程如下:
)中提铬的一种工艺流程如下:
已知:
 较大时,二价锰
较大时,二价锰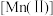 在空气中易被氧化。回答下列问题:
在空气中易被氧化。回答下列问题:(1)
 元素在周期表中的位置是
元素在周期表中的位置是(2)常温下,各种形态五价钒粒子总浓度的对数
 与
与 关系如图1,已知钒铬锰矿渣硫酸浸液中
关系如图1,已知钒铬锰矿渣硫酸浸液中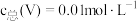 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为
(3)某温度下,Cr(Ⅲ)、Mn(Ⅱ)的沉淀率与pH关系如图2,“沉铬”过程最佳pH为

a.4.0 b.5.0 c.6.0
在该条件下滤液B中

 [
[ 近似为
近似为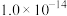 ,
, 的
的 近似为
近似为 ]。
]。(4)“转化”过程中生成
 的离子方程式为
的离子方程式为(5)“提纯”过程中
 的作用为
的作用为(6)一种含钒的氧化物晶胞结构如图所示,已知NA表示阿伏加德罗常数的值,则该晶体密度为

您最近一年使用:0次



