解题方法
1 . I、回答下列问题
(1)以太阳能为热源,利用纳米级 可获得氢气,过程如图所示,整个过程的催化剂为
可获得氢气,过程如图所示,整个过程的催化剂为___________ (填名称);过程I的化学方程式为___________ ;反应中生成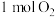 ,则同时生成
,则同时生成
___________ L(标准状况下)。
(2)按如图所示装置进行实验(加持装置已略去),实验证明浓硝酸的氧化性强于稀硝酸,依据为浓硝酸能将NO氧化为NO2,而稀硝酸不能。
①浓硝酸应保存在棕色试剂瓶中,用化学方程式解释其原因为___________ 。
②装置A中发生反应的化学方程式为___________ ;装置B的作用为___________ 。
③装置D中的现象为___________ ;C中盛放的试剂为___________ 。
(3)在碱性条件下, 被氧气氧化为
被氧气氧化为 的总反应的离子方程式为
的总反应的离子方程式为___________ 。
(1)以太阳能为热源,利用纳米级
 可获得氢气,过程如图所示,整个过程的催化剂为
可获得氢气,过程如图所示,整个过程的催化剂为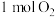 ,则同时生成
,则同时生成

(2)按如图所示装置进行实验(加持装置已略去),实验证明浓硝酸的氧化性强于稀硝酸,依据为浓硝酸能将NO氧化为NO2,而稀硝酸不能。
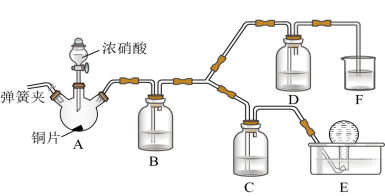
①浓硝酸应保存在棕色试剂瓶中,用化学方程式解释其原因为
②装置A中发生反应的化学方程式为
③装置D中的现象为
(3)在碱性条件下,
 被氧气氧化为
被氧气氧化为 的总反应的离子方程式为
的总反应的离子方程式为
您最近一年使用:0次
2 . 乙二胺四乙酸铁钠(化学式 )是一种重要补铁剂,某小组以铁屑为原料制备
)是一种重要补铁剂,某小组以铁屑为原料制备 并测定其含量。
并测定其含量。
已知:① 是一种配合物,微溶于乙醇,
是一种配合物,微溶于乙醇, 时水中的溶解度为
时水中的溶解度为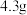 。
。
②乙二胺四乙酸( ,用
,用 表示)是一种弱酸。
表示)是一种弱酸。
Ⅰ.制备
实验室用铁屑制备 的主要流程如下:
的主要流程如下:___________
A.升高温度 B.加快搅拌速率 C.缩短浸取时间
(2)向酸浸所得滤液中通入足量 ,过程中浓度减少的离子有
,过程中浓度减少的离子有___________ (填离子符号)。
(3)“制备”步骤,向氧化所得的 溶液中加入一定量
溶液中加入一定量
 ,控制反应温度为
,控制反应温度为 ,加入
,加入 溶液调节
溶液调节 为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为
为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为 。
。
①从反应后的混合物中获得较高产率的 粗品的实验操作是,
粗品的实验操作是,___________ ,过滤,水洗,干燥。检验 是否洗净的试剂是
是否洗净的试剂是___________
②保持其他条件不变,乙二胺四乙酸铁钠的产率随反应液 的变化如图1所示。
的变化如图1所示。 过低或过高产品产率均减小的主要原因是
过低或过高产品产率均减小的主要原因是___________ 。
样品中乙二胺四乙酸铁钠纯度可用 标准溶液滴定。原理是在
标准溶液滴定。原理是在 为
为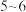 发生反应:
发生反应: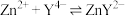 ,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
(4)补充完整实验方案:准确称取 样品,溶于一定量的蒸馏水,加入掩蔽剂排除
样品,溶于一定量的蒸馏水,加入掩蔽剂排除 干扰,得到待测溶液
干扰,得到待测溶液 ,将溶液
,将溶液 完全转移到
完全转移到 容量瓶中定容;按规定操作分别将
容量瓶中定容;按规定操作分别将 标准溶液和待测溶液
标准溶液和待测溶液 装入如图2所示的滴定管中:
装入如图2所示的滴定管中:___________ 。
 )是一种重要补铁剂,某小组以铁屑为原料制备
)是一种重要补铁剂,某小组以铁屑为原料制备 并测定其含量。
并测定其含量。已知:①
 是一种配合物,微溶于乙醇,
是一种配合物,微溶于乙醇, 时水中的溶解度为
时水中的溶解度为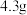 。
。②乙二胺四乙酸(
 ,用
,用 表示)是一种弱酸。
表示)是一种弱酸。Ⅰ.制备

实验室用铁屑制备
 的主要流程如下:
的主要流程如下:
A.升高温度 B.加快搅拌速率 C.缩短浸取时间
(2)向酸浸所得滤液中通入足量
 ,过程中浓度减少的离子有
,过程中浓度减少的离子有(3)“制备”步骤,向氧化所得的
 溶液中加入一定量
溶液中加入一定量
 ,控制反应温度为
,控制反应温度为 ,加入
,加入 溶液调节
溶液调节 为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为
为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为 。
。①从反应后的混合物中获得较高产率的
 粗品的实验操作是,
粗品的实验操作是, 是否洗净的试剂是
是否洗净的试剂是②保持其他条件不变,乙二胺四乙酸铁钠的产率随反应液
 的变化如图1所示。
的变化如图1所示。 过低或过高产品产率均减小的主要原因是
过低或过高产品产率均减小的主要原因是
样品中乙二胺四乙酸铁钠纯度可用
 标准溶液滴定。原理是在
标准溶液滴定。原理是在 为
为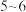 发生反应:
发生反应: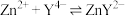 ,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。(4)补充完整实验方案:准确称取
 样品,溶于一定量的蒸馏水,加入掩蔽剂排除
样品,溶于一定量的蒸馏水,加入掩蔽剂排除 干扰,得到待测溶液
干扰,得到待测溶液 ,将溶液
,将溶液 完全转移到
完全转移到 容量瓶中定容;按规定操作分别将
容量瓶中定容;按规定操作分别将 标准溶液和待测溶液
标准溶液和待测溶液 装入如图2所示的滴定管中:
装入如图2所示的滴定管中:
您最近一年使用:0次
解题方法
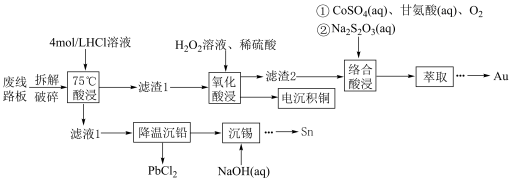
3 . 废旧手机的废线路板中富含Cu、Sn、Ni、Pb等金属和少量Ag、Au,具有较高的回收价值,其中部分金属的回收工艺流程如下: 微溶于水,可与
微溶于水,可与 结合生成
结合生成 配离子:
配离子: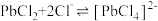 。
。
②25℃时,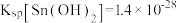 ,
,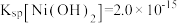 。
。
回答下列问题:
(1)“拆解破碎”的目的是_______ 。
(2)“75℃酸浸”中,金属Sn与盐酸反应的离子方程式为_______ ,选用浓度较大的4 mol·L 盐酸可提高铅元素的浸出率,理由是
盐酸可提高铅元素的浸出率,理由是_______ (从平衡移动角度分析)。
(3)“滤渣1”的主要成分是_______ (填化学式),“氧化酸浸”中,生成Cu²⁺反应的离子方程式为_______ 。
(4) 的排放标准为
的排放标准为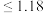 mg·L
mg·L 。“沉锡”残余液排放前应调节溶液的pH范围为
。“沉锡”残余液排放前应调节溶液的pH范围为_____ 。
(5)“络合酸浸”中,Co2+作催化剂,催化Au浸出,化学方程式为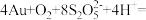
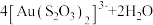 ,其反应过程按如下步骤进行:
,其反应过程按如下步骤进行:
① 先与甘氨酸根(简写为
先与甘氨酸根(简写为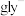 )形成配合物
)形成配合物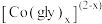 (
(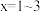 )。
)。
②在氧气作用下,Co(Ⅱ)被氧化成Co(Ⅲ):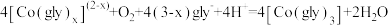 。
。
③Au溶解。
④加入硫代硫酸钠溶液,发生反应: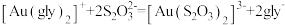 。
。
步骤③Au溶解的离子方程式为_______ 。
(6)锡有白锡和灰锡两种单质。白锡晶体中锡原子的堆积方式如图所示,该六棱柱底边边长为a pm,高为c pm,阿伏加德罗常数的值为 ,白锡晶体的密度为
,白锡晶体的密度为_______  (列出计算式)。
(列出计算式)。
 微溶于水,可与
微溶于水,可与 结合生成
结合生成 配离子:
配离子: 。
。②25℃时,
 ,
, 。
。回答下列问题:
(1)“拆解破碎”的目的是
(2)“75℃酸浸”中,金属Sn与盐酸反应的离子方程式为
 盐酸可提高铅元素的浸出率,理由是
盐酸可提高铅元素的浸出率,理由是(3)“滤渣1”的主要成分是
(4)
 的排放标准为
的排放标准为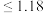 mg·L
mg·L 。“沉锡”残余液排放前应调节溶液的pH范围为
。“沉锡”残余液排放前应调节溶液的pH范围为(5)“络合酸浸”中,Co2+作催化剂,催化Au浸出,化学方程式为
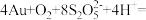
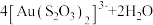 ,其反应过程按如下步骤进行:
,其反应过程按如下步骤进行:①
 先与甘氨酸根(简写为
先与甘氨酸根(简写为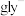 )形成配合物
)形成配合物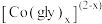 (
(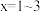 )。
)。②在氧气作用下,Co(Ⅱ)被氧化成Co(Ⅲ):
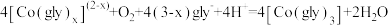 。
。③Au溶解。
④加入硫代硫酸钠溶液,发生反应:
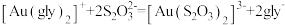 。
。步骤③Au溶解的离子方程式为
(6)锡有白锡和灰锡两种单质。白锡晶体中锡原子的堆积方式如图所示,该六棱柱底边边长为a pm,高为c pm,阿伏加德罗常数的值为
 ,白锡晶体的密度为
,白锡晶体的密度为 (列出计算式)。
(列出计算式)。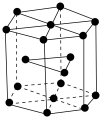
您最近一年使用:0次
2024-05-28更新
|
83次组卷
|
2卷引用:2024届河北省承德市部分示范高中高三下学期三模化学试题
4 . 硒和碲广泛用于玻璃工业、橡胶和半导体工业.实验室中以碲碱渣(主要含 、
、 ,还有微量的
,还有微量的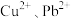 及部分不溶性杂质)为原料分离硒回收碲的工艺流程如图所示.
及部分不溶性杂质)为原料分离硒回收碲的工艺流程如图所示. 与
与 ;
;
② 为两性氧化物;③盐酸“酸浸”后硒以
为两性氧化物;③盐酸“酸浸”后硒以 形式存在.
形式存在.
下列说法错误的是
 、
、 ,还有微量的
,还有微量的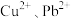 及部分不溶性杂质)为原料分离硒回收碲的工艺流程如图所示.
及部分不溶性杂质)为原料分离硒回收碲的工艺流程如图所示.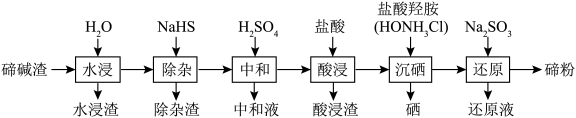
 与
与 ;
;②
 为两性氧化物;③盐酸“酸浸”后硒以
为两性氧化物;③盐酸“酸浸”后硒以 形式存在.
形式存在.下列说法错误的是
| A.流程中涉及的六种工序中,进行物质分离时均需用到烧杯、漏斗和玻璃棒 |
| B.粉碎碲碱渣、延长水浸时间均可以提高硒和碲元素的浸出率 |
C.“中和”时加入过量硫酸,可以提高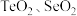 的转化率 的转化率 |
D.“沉硒”时同时生成了 和HCl,则其主要的化学方程式为 和HCl,则其主要的化学方程式为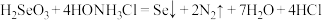 |
您最近一年使用:0次
2024-05-28更新
|
144次组卷
|
2卷引用:河北省衡水市2024届高三下学期高考预测卷化学试题
5 . 铊(Tl)本身是一种剧毒物质,为毒性最大的金属元素之一,但是铊在工业中的用途非常广泛,主要存在于一些矿物和工业废水中,也可以从含铊的合金中提取.从某铅锌厂的富铊灰(主要成分为 、
、 、
、 、
、 、
、 )中回收铊的工艺流程如图所示:
)中回收铊的工艺流程如图所示:
①在氯化物-硫酸水溶液中,铊元素以 形式存在;
形式存在;
(2)萃取过程的反应原理为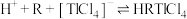 .
.
请回答下列问题:
(1)基态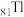 原子核外电子的运动状态有
原子核外电子的运动状态有________ 种.
(2)“浸取I”过程中为提高铊的浸取速率,可采取的措施有________________ (写出两条).
(3)写出“浸取I”中 发生反应的化学方程式:
发生反应的化学方程式:________________ ,“滤渣”的主要成分是________ (填化学式).
(4)请从化学平衡的角度解释“反萃取”过程中加入 溶液的原因:
溶液的原因:________________ .
(5)写出“还原氯化沉淀”中反应的离子方程式:________________ .
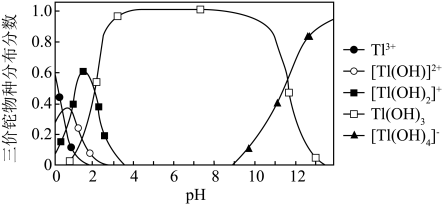
(6)通过沉淀法也可以去除工业废水中的 和
和 .
.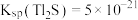 ,某地区规定工业污水中铊的污染物排放限值为
,某地区规定工业污水中铊的污染物排放限值为 ,若铊的含量符合国家排放限值,则处理后的废水中
,若铊的含量符合国家排放限值,则处理后的废水中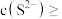
________  (假设污水中铊全部以
(假设污水中铊全部以 形式存在).
形式存在).
②向含铊废水中加入溴水,使 充分氧化成
充分氧化成 ,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是________________ .
 、
、 、
、 、
、 、
、 )中回收铊的工艺流程如图所示:
)中回收铊的工艺流程如图所示: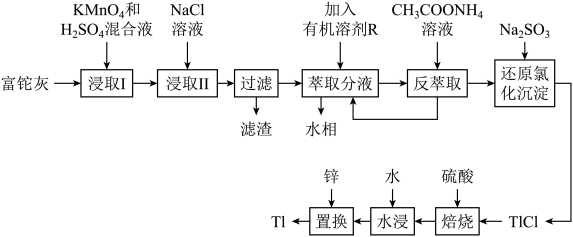
①在氯化物-硫酸水溶液中,铊元素以
 形式存在;
形式存在;(2)萃取过程的反应原理为
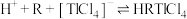 .
.请回答下列问题:
(1)基态
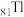 原子核外电子的运动状态有
原子核外电子的运动状态有(2)“浸取I”过程中为提高铊的浸取速率,可采取的措施有
(3)写出“浸取I”中
 发生反应的化学方程式:
发生反应的化学方程式:(4)请从化学平衡的角度解释“反萃取”过程中加入
 溶液的原因:
溶液的原因:(5)写出“还原氯化沉淀”中反应的离子方程式:
(6)通过沉淀法也可以去除工业废水中的
 和
和 .
.
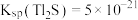 ,某地区规定工业污水中铊的污染物排放限值为
,某地区规定工业污水中铊的污染物排放限值为 ,若铊的含量符合国家排放限值,则处理后的废水中
,若铊的含量符合国家排放限值,则处理后的废水中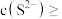
 (假设污水中铊全部以
(假设污水中铊全部以 形式存在).
形式存在).②向含铊废水中加入溴水,使
 充分氧化成
充分氧化成 ,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
您最近一年使用:0次
解题方法
6 . 用软锰矿( ,含
,含 、
、 杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料
杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料 的工艺流程如下:
的工艺流程如下: ,
,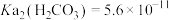 ,
,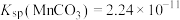
有关离子沉淀时的pH:
回答下列问题:
(1)“滤渣1”除了S、 外,还有
外,还有___________ (填化学式)。
(2)“试剂a”可以选用___________ (填标号),“除杂”应调pH范围是___________ 。
A.NaClO B. C.
C. D.NaOH
D.NaOH
(3)“沉锰”时发生反应的离子方程式为___________ 。
(4)“沉锰”后上层清液中
___________ 。
(5)“焙烧”时发生反应的化学方程式为___________ 。
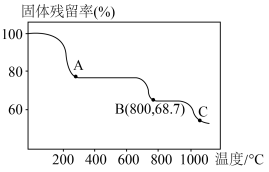
(6)碳酸锰在空气中加热,固体残留率随温度变化如图。碳酸锰在300℃时已完全脱碳,则B点对应的物质的化学式为___________ 。
 ,含
,含 、
、 杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料
杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料 的工艺流程如下:
的工艺流程如下: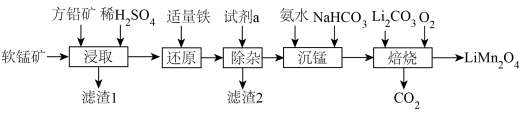
 ,
,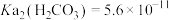 ,
,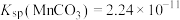
有关离子沉淀时的pH:
 |  |  |  | |
| 开始沉淀时 | 8.3 | 7.6 | 2.7 | 3.0 |
| 沉淀完全时 | 9.8 | 9.6 | 3.7 | 4.7 |
(1)“滤渣1”除了S、
 外,还有
外,还有(2)“试剂a”可以选用
A.NaClO B.
 C.
C. D.NaOH
D.NaOH(3)“沉锰”时发生反应的离子方程式为
(4)“沉锰”后上层清液中

(5)“焙烧”时发生反应的化学方程式为
(6)碳酸锰在空气中加热,固体残留率随温度变化如图。碳酸锰在300℃时已完全脱碳,则B点对应的物质的化学式为
您最近一年使用:0次
2024-05-28更新
|
256次组卷
|
2卷引用:2024届山东省日照市高三下学期二模化学试题
7 . 铵明矾晶体的化学式为 ,以铵明矾为原料可实现如图转化。
,以铵明矾为原料可实现如图转化。 与题中阳离子不形成配合物,固体A为纯净物。
与题中阳离子不形成配合物,固体A为纯净物。
(1)铵明矾晶体“隔绝空气加热”分解产物中含硫化合物有___________ 。
(2)步骤III中生成白色沉淀C反应的化学方程式为___________ 。
(3)合成铵明矾过程中常使用过量的硫酸铵,一个作用是抑制硫酸铝水解,另一个重要作用是___________ 。
(4)设计实验验证固体A含有的金属元素:___________ 。
(5)步骤I中,铵明矾晶体在各温度段内受热“失重计算值”如表所示。(失重计算值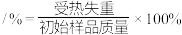 )
)
通过上述数据可判断,在温度区间___________ ℃,铵明矾基本上失去了结晶水。
 ,以铵明矾为原料可实现如图转化。
,以铵明矾为原料可实现如图转化。
 与题中阳离子不形成配合物,固体A为纯净物。
与题中阳离子不形成配合物,固体A为纯净物。(1)铵明矾晶体“隔绝空气加热”分解产物中含硫化合物有
(2)步骤III中生成白色沉淀C反应的化学方程式为
(3)合成铵明矾过程中常使用过量的硫酸铵,一个作用是抑制硫酸铝水解,另一个重要作用是
(4)设计实验验证固体A含有的金属元素:
(5)步骤I中,铵明矾晶体在各温度段内受热“失重计算值”如表所示。(失重计算值
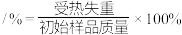 )
)| 温度区间/℃ | 18→190 | 190→430 | 430→505 | 505→900 |
| 失重计算值/% | 39.20 | 7.80 | 13.00 | 26.00 |
您最近一年使用:0次
8 . 在碘水、淀粉、稀 和
和 的混合溶液中加入过量乙酰乙酸烯丙酯(AAA),观察到溶液中蓝色与无色交替出现,主要转化如下:
的混合溶液中加入过量乙酰乙酸烯丙酯(AAA),观察到溶液中蓝色与无色交替出现,主要转化如下: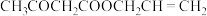
AAAI为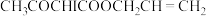
下列说法不正确 的是
 和
和 的混合溶液中加入过量乙酰乙酸烯丙酯(AAA),观察到溶液中蓝色与无色交替出现,主要转化如下:
的混合溶液中加入过量乙酰乙酸烯丙酯(AAA),观察到溶液中蓝色与无色交替出现,主要转化如下: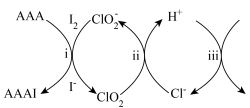
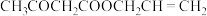
AAAI为
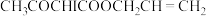
下列说法
| A.i为取代反应 | B.ii的反应为 |
C.iii中,生成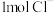 转移 转移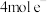 | D.最终溶液呈蓝色 |
您最近一年使用:0次
解题方法
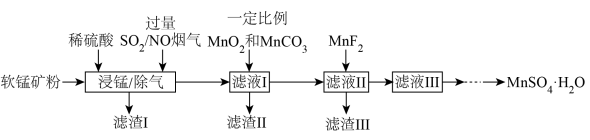
9 . 燃煤烟气中含有大量 和NO。某实验室模拟“软锰矿浆同步脱硫脱硝技术”并制备
和NO。某实验室模拟“软锰矿浆同步脱硫脱硝技术”并制备 ,部分流程如下。
,部分流程如下。
已知:①软锰矿(主要成分为 ,另含有少量
,另含有少量 、CaO、
、CaO、 等杂质)。
等杂质)。
② ;
;
③
 发生的主要化学方程式为
发生的主要化学方程式为________ 。
②滤渣Ⅰ的主要成分为________ 。(写化学式)
(2)“除气”过程,烟气中混入一定量 可提高NO脱除率,其可能的原因是:
可提高NO脱除率,其可能的原因是:________ 。
(3)“滤液Ⅰ”中加入等物质的量 和
和 ,反应的离子方程式为:
,反应的离子方程式为:________ 。
(4)“滤液Ⅱ”中用 可除去
可除去 ,结合反应方程式和定量计算说明原因
,结合反应方程式和定量计算说明原因________ 。(当反应平衡常数大于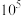 时,可认为反应完全)。
时,可认为反应完全)。
(5)“滤液Ⅲ”可制得 。已知:
。已知:
①在烟气吸收过程中,除生成 外,还容易产生连二硫酸锰(
外,还容易产生连二硫酸锰( ),当温度
),当温度
超过35℃, 会快速分解为
会快速分解为 和
和 。
。
②部分锰盐在不同温度下的溶解度和析出晶体的组成如图。 的实验方案为:
的实验方案为:________ 。(须使用的试剂为: L NaOH溶液,无水乙醇)
L NaOH溶液,无水乙醇)
 和NO。某实验室模拟“软锰矿浆同步脱硫脱硝技术”并制备
和NO。某实验室模拟“软锰矿浆同步脱硫脱硝技术”并制备 ,部分流程如下。
,部分流程如下。已知:①软锰矿(主要成分为
 ,另含有少量
,另含有少量 、CaO、
、CaO、 等杂质)。
等杂质)。②
 ;
;
③

 发生的主要化学方程式为
发生的主要化学方程式为②滤渣Ⅰ的主要成分为
(2)“除气”过程,烟气中混入一定量
 可提高NO脱除率,其可能的原因是:
可提高NO脱除率,其可能的原因是:(3)“滤液Ⅰ”中加入等物质的量
 和
和 ,反应的离子方程式为:
,反应的离子方程式为:(4)“滤液Ⅱ”中用
 可除去
可除去 ,结合反应方程式和定量计算说明原因
,结合反应方程式和定量计算说明原因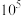 时,可认为反应完全)。
时,可认为反应完全)。(5)“滤液Ⅲ”可制得
 。已知:
。已知:①在烟气吸收过程中,除生成
 外,还容易产生连二硫酸锰(
外,还容易产生连二硫酸锰( ),当温度
),当温度超过35℃,
 会快速分解为
会快速分解为 和
和 。
。②部分锰盐在不同温度下的溶解度和析出晶体的组成如图。

 的实验方案为:
的实验方案为: L NaOH溶液,无水乙醇)
L NaOH溶液,无水乙醇)
您最近一年使用:0次
10 . 碘酸钙[ ]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备
]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备 实验步骤如下:
实验步骤如下:
Ⅰ.将一定质量的 、
、 和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
Ⅱ.步骤Ⅰ反应完毕后,将烧瓶内的混合液倒入烧杯中,滴入KOH溶液调节pH=10,然后用滴管逐滴加入1 的
的 溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
Ⅲ.碘酸钙粗品纯度:准确称取a g碘酸钙粗品于烧杯中,加入10mL 将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL
将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL  、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用
、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用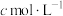 的
的 溶液滴定,平行三次,平均消耗
溶液滴定,平行三次,平均消耗 溶液的体积为V mL(
溶液的体积为V mL( )
)
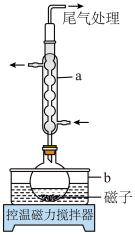
(1)仪器a的名称为___________ ,b中应盛放的最佳传热介质是___________ 。
(2)步骤Ⅰ中反应生成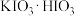 、
、 等,写出反应的化学方程式:
等,写出反应的化学方程式:___________ 。反应过程中,在烧瓶瓶颈或仪器a下口处可能会看到___________ (填物质名称)析出,其原因是___________ 。
(3)步骤Ⅱ“一系列操作”包括静置、___________ 、洗涤、干燥,其中洗涤所用较佳试剂为___________ (填“水”或“乙醇”)。
(4)碘酸钙粗晶纯度为___________ %(用含a、c、V的代数式表示),下列情况导致产品纯度测定结果偏低的是___________ (填字母)。
A.所配待测溶液中含有 少量沉淀 B.定容时俯视读数
少量沉淀 B.定容时俯视读数
C.盛放 溶液的滴定管未润洗 D.滴定后俯视读数
溶液的滴定管未润洗 D.滴定后俯视读数
 ]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备
]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备 实验步骤如下:
实验步骤如下:Ⅰ.将一定质量的
 、
、 和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;Ⅱ.步骤Ⅰ反应完毕后,将烧瓶内的混合液倒入烧杯中,滴入KOH溶液调节pH=10,然后用滴管逐滴加入1
 的
的 溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;Ⅲ.碘酸钙粗品纯度:准确称取a g碘酸钙粗品于烧杯中,加入10mL
 将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL
将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL  、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用
、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用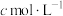 的
的 溶液滴定,平行三次,平均消耗
溶液滴定,平行三次,平均消耗 溶液的体积为V mL(
溶液的体积为V mL( )
)
(1)仪器a的名称为
(2)步骤Ⅰ中反应生成
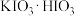 、
、 等,写出反应的化学方程式:
等,写出反应的化学方程式:(3)步骤Ⅱ“一系列操作”包括静置、
(4)碘酸钙粗晶纯度为
A.所配待测溶液中含有
 少量沉淀 B.定容时俯视读数
少量沉淀 B.定容时俯视读数C.盛放
 溶液的滴定管未润洗 D.滴定后俯视读数
溶液的滴定管未润洗 D.滴定后俯视读数
您最近一年使用:0次
2024-05-27更新
|
183次组卷
|
3卷引用:2024届河南省九师联盟2023-2024学年高三下学期4月联考理综试题-高中化学



