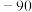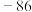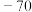解题方法
1 . 碱金属和碱土金属元素分别位于元素周期表的ⅠA族和ⅡA族,它们的化合物应用广泛。历史上曾以NaCl为原料生产NaOH作为化学工业开端的标志。 可由侯氏制碱法获得。
可由侯氏制碱法获得。 是强氧化剂,熔融条件下可将
是强氧化剂,熔融条件下可将 氧化为
氧化为 。格氏试剂(如
。格氏试剂(如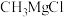 )在有机化学中有重要用途,但易与空气中的
)在有机化学中有重要用途,但易与空气中的 等发生反应。盐卤水中含有
等发生反应。盐卤水中含有 ,常用于豆制品加工。
,常用于豆制品加工。 受热分解最终生成MgO。
受热分解最终生成MgO。
碱金属及碱土金属元素及其化合物的转化具有重要应用。下列说法不正确的是
 可由侯氏制碱法获得。
可由侯氏制碱法获得。 是强氧化剂,熔融条件下可将
是强氧化剂,熔融条件下可将 氧化为
氧化为 。格氏试剂(如
。格氏试剂(如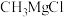 )在有机化学中有重要用途,但易与空气中的
)在有机化学中有重要用途,但易与空气中的 等发生反应。盐卤水中含有
等发生反应。盐卤水中含有 ,常用于豆制品加工。
,常用于豆制品加工。 受热分解最终生成MgO。
受热分解最终生成MgO。碱金属及碱土金属元素及其化合物的转化具有重要应用。下列说法不正确的是
A.侯氏制碱法中的物质转化: |
B.由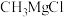 制备乙酸的物质转化: 制备乙酸的物质转化: |
C.电解饱和NaCl溶液的阴极反应: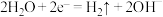 |
D. 与 与 共熔的反应: 共熔的反应: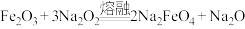 |
您最近一年使用:0次
解题方法
2 . 高效氧化剂亚氯酸钠( )常用于烟气脱硝(
)常用于烟气脱硝( )和废水脱除氨氮。
)和废水脱除氨氮。
(1) 的制备。一种制备
的制备。一种制备 的过程可表示为
的过程可表示为_______ 。
②“反应1”的产物 经净化后常作为饮用水消毒剂替代传统的
经净化后常作为饮用水消毒剂替代传统的 ,从消毒后饮用水水质和消毒效率(单位质量消毒剂被还原时得电子数)的角度考虑,用
,从消毒后饮用水水质和消毒效率(单位质量消毒剂被还原时得电子数)的角度考虑,用 替代
替代 的原因是
的原因是_______ 。
(2) 溶液对烟气脱硝。
溶液对烟气脱硝。
①酸性条件下, 可催化溶液中的
可催化溶液中的 产生氧化性更强的
产生氧化性更强的 气体,总反应可表示为
气体,总反应可表示为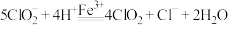 。请补充完整过程Ⅱ的离子方程式:
。请补充完整过程Ⅱ的离子方程式:
I.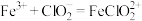 ;
;
Ⅱ._______ ;
Ⅲ.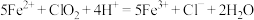 。
。
② 催化
催化 溶液脱硝。其他条件相同时,烟气中NO氧化率随
溶液脱硝。其他条件相同时,烟气中NO氧化率随 、反应温度的变化分别如图所示。
、反应温度的变化分别如图所示。 增大而增大的原因是
增大而增大的原因是_______ 。
ii.温度升高,NO氧化率先增大后减小的可能原因是_______ 。
(3) 溶液处理氨氮废水。向一定量酸性氨氮废水中加入一定体积已知浓度的
溶液处理氨氮废水。向一定量酸性氨氮废水中加入一定体积已知浓度的 溶液,用传感器测得溶液中
溶液,用传感器测得溶液中 与
与 含量随反应时间的变化如图所示。判断该实验中被氧化的
含量随反应时间的变化如图所示。判断该实验中被氧化的 是否全部转化为
是否全部转化为 的依据为
的依据为_______ 。
 )常用于烟气脱硝(
)常用于烟气脱硝( )和废水脱除氨氮。
)和废水脱除氨氮。(1)
 的制备。一种制备
的制备。一种制备 的过程可表示为
的过程可表示为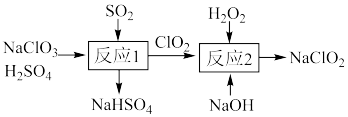
②“反应1”的产物
 经净化后常作为饮用水消毒剂替代传统的
经净化后常作为饮用水消毒剂替代传统的 ,从消毒后饮用水水质和消毒效率(单位质量消毒剂被还原时得电子数)的角度考虑,用
,从消毒后饮用水水质和消毒效率(单位质量消毒剂被还原时得电子数)的角度考虑,用 替代
替代 的原因是
的原因是(2)
 溶液对烟气脱硝。
溶液对烟气脱硝。①酸性条件下,
 可催化溶液中的
可催化溶液中的 产生氧化性更强的
产生氧化性更强的 气体,总反应可表示为
气体,总反应可表示为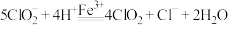 。请补充完整过程Ⅱ的离子方程式:
。请补充完整过程Ⅱ的离子方程式:I.
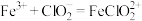 ;
;Ⅱ.
Ⅲ.
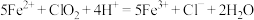 。
。②
 催化
催化 溶液脱硝。其他条件相同时,烟气中NO氧化率随
溶液脱硝。其他条件相同时,烟气中NO氧化率随 、反应温度的变化分别如图所示。
、反应温度的变化分别如图所示。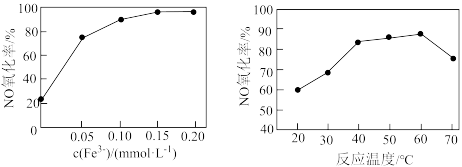
 增大而增大的原因是
增大而增大的原因是ii.温度升高,NO氧化率先增大后减小的可能原因是
(3)
 溶液处理氨氮废水。向一定量酸性氨氮废水中加入一定体积已知浓度的
溶液处理氨氮废水。向一定量酸性氨氮废水中加入一定体积已知浓度的 溶液,用传感器测得溶液中
溶液,用传感器测得溶液中 与
与 含量随反应时间的变化如图所示。判断该实验中被氧化的
含量随反应时间的变化如图所示。判断该实验中被氧化的 是否全部转化为
是否全部转化为 的依据为
的依据为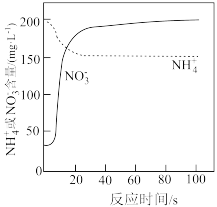
您最近一年使用:0次
解题方法
3 . 选择性催化还原(SCR)脱硝技术可用于减少工业生产中氮氧化物( )的排放量,主要技术原理如下,回答下列问题:
)的排放量,主要技术原理如下,回答下列问题:
Ⅰ.CO―SCR技术
使用某催化剂时,反应机理如下表:
(1)反应

___________ ,副反应化学方程式为___________ 。
(2)将含NO的尾气按一定流速通到不同催化剂表面,不同温度下在气体出口处测得NO的转化率、 的选择性、
的选择性、 的生成量随温度变化关系如下图:
的生成量随温度变化关系如下图:___________ ,应选择的最佳催化剂为___________ ,选用合适的催化剂还能抑制催化剂表面出现铵盐结晶现象,结晶会导致___________ 。
Ⅱ.H2―SCR技术
主反应: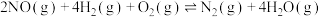
副反应:
(3)恒温下,向容积为1L的容器中充入2mol NO、4mol 、1mol
、1mol ,发生主、副反应,达到平衡后,测得压强为初始压强的
,发生主、副反应,达到平衡后,测得压强为初始压强的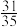 ,且
,且 与
与 的体积分数相等,NO的转化率为
的体积分数相等,NO的转化率为___________ ,主反应的
___________ (列出计算式即可)。
(4)除以上技术外,还可用电解纸化吸收法将工业尾气中的 转变为
转变为 。向
。向 NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:
NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:___________ ,随着电流强度的增大,电解NaCl溶液时NO去除率下降的原因是___________ 。
 )的排放量,主要技术原理如下,回答下列问题:
)的排放量,主要技术原理如下,回答下列问题:Ⅰ.CO―SCR技术
使用某催化剂时,反应机理如下表:
| 反应方程式 | 反应热 | |
| 吸附过程 | 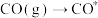 |  |
 |  | |
| 解离过程 |  |  |
| 缔结过程 | 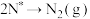 |  |
 |  | |
 |  |
(1)反应


(2)将含NO的尾气按一定流速通到不同催化剂表面,不同温度下在气体出口处测得NO的转化率、
 的选择性、
的选择性、 的生成量随温度变化关系如下图:
的生成量随温度变化关系如下图: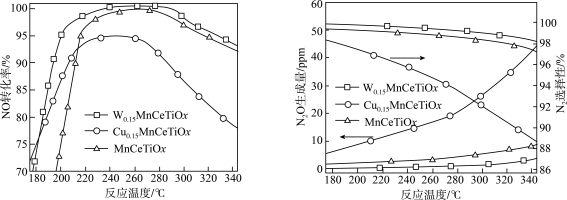
Ⅱ.H2―SCR技术
主反应:
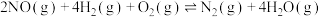
副反应:

(3)恒温下,向容积为1L的容器中充入2mol NO、4mol
 、1mol
、1mol ,发生主、副反应,达到平衡后,测得压强为初始压强的
,发生主、副反应,达到平衡后,测得压强为初始压强的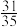 ,且
,且 与
与 的体积分数相等,NO的转化率为
的体积分数相等,NO的转化率为
(4)除以上技术外,还可用电解纸化吸收法将工业尾气中的
 转变为
转变为 。向
。向 NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:
NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:
您最近一年使用:0次
解题方法
4 . 以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备草酸铜(CuC2O4)的流程如图所示:
(1)滤渣中含有单质S和___________ (填化学式),写出“浸取”时反应的化学方程式:___________ 。
(2)“还原”时除生成Cu外,还有N2生成,写出该反应的离子方程式:___________ 。
(3)“氧化溶解”时,也可以直接用稀硝酸溶解Cu,但没有采用此法,考虑的主要原因是___________ 。
(4)向滤液1中加入(或通入)___________(填字母),可得到一种可循环利用的物质。
(5)“制备”时 过多会导致
过多会导致 与
与 生成环状结构的配离子
生成环状结构的配离子 ,该配离子的结构式为
,该配离子的结构式为___________ (不考虑立体异构)。
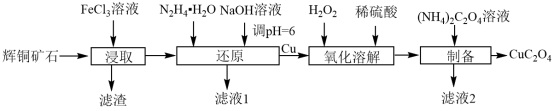
(6)将一定质量的CuC2O4置于Ar气中热解,测得剩余固体的质量与原始固体的质量的比值随温度变化的曲线如图1所示。350~400℃下剩余固体的化学式为___________ 。 为
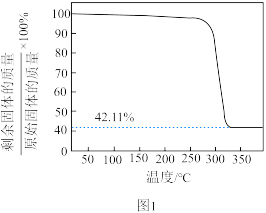
为___________  (已知该晶胞的晶胞参数为anm,阿伏加德罗常数的值为
(已知该晶胞的晶胞参数为anm,阿伏加德罗常数的值为 )。
)。
(1)滤渣中含有单质S和
(2)“还原”时除生成Cu外,还有N2生成,写出该反应的离子方程式:
(3)“氧化溶解”时,也可以直接用稀硝酸溶解Cu,但没有采用此法,考虑的主要原因是
(4)向滤液1中加入(或通入)___________(填字母),可得到一种可循环利用的物质。
| A.铁 | B.氯气 | C.高锰酸钾 | D.氯化氢 |
 过多会导致
过多会导致 与
与 生成环状结构的配离子
生成环状结构的配离子 ,该配离子的结构式为
,该配离子的结构式为(6)将一定质量的CuC2O4置于Ar气中热解,测得剩余固体的质量与原始固体的质量的比值随温度变化的曲线如图1所示。350~400℃下剩余固体的化学式为
 为
为 (已知该晶胞的晶胞参数为anm,阿伏加德罗常数的值为
(已知该晶胞的晶胞参数为anm,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解题方法
5 .  可用于制备镉镍碱性电池。镍废料中含有Ni、Cu、Fe、Ca、Mg等的化合物及难溶性杂质,以镍废料为原料制备高纯
可用于制备镉镍碱性电池。镍废料中含有Ni、Cu、Fe、Ca、Mg等的化合物及难溶性杂质,以镍废料为原料制备高纯 的工艺流程如图所示。
的工艺流程如图所示。 存在;
存在;
②常温下,部分物质溶度积如下:
回答下列问题:
(1)常温下,为提高酸浸效率,通常采用的措施是___________ (举2例)。
(2)加入碳酸钙调pH=4的目的是___________ ,此时 (0.10mol/L)是否会沉淀
(0.10mol/L)是否会沉淀___________ (通过计算说明)。
(3)“沉渣3”的主要成分是___________ (填化学式)。“滤液4”中除含 、
、 、
、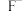 、
、 外,还含有较多的
外,还含有较多的___________ (填离子符号)。
(4)向“酸溶”后的溶液中加入NaOH和NaClO,发生反应的化学方程式是___________ 。
(5)工艺流程中使用 去除
去除 。研究表明,也可在加热条件下使用
。研究表明,也可在加热条件下使用 去除
去除 ,生成等物质的量的
,生成等物质的量的 、S混合沉淀以及
、S混合沉淀以及 ,该反应的离子方程式是
,该反应的离子方程式是___________ 。
 可用于制备镉镍碱性电池。镍废料中含有Ni、Cu、Fe、Ca、Mg等的化合物及难溶性杂质,以镍废料为原料制备高纯
可用于制备镉镍碱性电池。镍废料中含有Ni、Cu、Fe、Ca、Mg等的化合物及难溶性杂质,以镍废料为原料制备高纯 的工艺流程如图所示。
的工艺流程如图所示。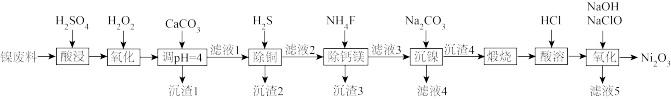
 存在;
存在;②常温下,部分物质溶度积如下:
 |  |  |  | |
 |  |  | 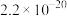 | 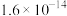 |
(1)常温下,为提高酸浸效率,通常采用的措施是
(2)加入碳酸钙调pH=4的目的是
 (0.10mol/L)是否会沉淀
(0.10mol/L)是否会沉淀(3)“沉渣3”的主要成分是
 、
、 、
、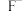 、
、 外,还含有较多的
外,还含有较多的(4)向“酸溶”后的溶液中加入NaOH和NaClO,发生反应的化学方程式是
(5)工艺流程中使用
 去除
去除 。研究表明,也可在加热条件下使用
。研究表明,也可在加热条件下使用 去除
去除 ,生成等物质的量的
,生成等物质的量的 、S混合沉淀以及
、S混合沉淀以及 ,该反应的离子方程式是
,该反应的离子方程式是
您最近一年使用:0次
6 . 磷酸铁锂前驱体磷酸铁是一种重要的化工原料,被广泛用于汽车电池。用浓硫酸浸取钛铁矿(主要成分为 ),得到含
),得到含 的钛白副产物和硫酸亚铁。净化除杂后的硫酸亚铁可用于制备磷酸铁,其工艺流程如下:
的钛白副产物和硫酸亚铁。净化除杂后的硫酸亚铁可用于制备磷酸铁,其工艺流程如下:___________ 。
(2)先加入磷酸,再加入NaOH,调节pH约为2,生成磷酸铁沉淀。若 ,会导致
,会导致___________ ;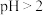 ,会导致
,会导致___________ 。
(3)经陈化、过滤后,所得滤液除少量磷酸铁外还含有的主要成分是___________ 。将滤液收集用于溶解步骤,其目的是___________ (答出两条即可)。
(4)在该流程中,以 、
、 、
、 和NaOH为反应物制得水合磷酸铁
和NaOH为反应物制得水合磷酸铁 总反应的离子方程式为
总反应的离子方程式为___________ 。
(5)煅烧水合磷酸铁过程中的TG(热重)及DSC(反映体系热量变化况,数值已省略)曲线如下图。样品在50~120℃有少量失重,可能是样品吸潮引起的少量游离水的损失(0.7%左右),从120℃开始有明显的失重,到200℃时失重达19.98%,则x值为___________ 。 为正交晶系结构,其晶胞参数为
为正交晶系结构,其晶胞参数为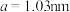 、
、 、
、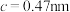 ,
, 。其晶胞结构如图所示,其中O围绕Fe和P分别形成正八面体和正四面体。则该晶体的密度为
。其晶胞结构如图所示,其中O围绕Fe和P分别形成正八面体和正四面体。则该晶体的密度为___________  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 ),得到含
),得到含 的钛白副产物和硫酸亚铁。净化除杂后的硫酸亚铁可用于制备磷酸铁,其工艺流程如下:
的钛白副产物和硫酸亚铁。净化除杂后的硫酸亚铁可用于制备磷酸铁,其工艺流程如下: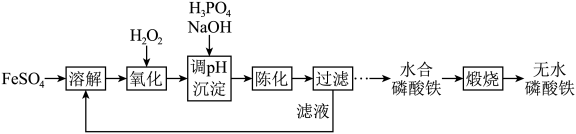
(2)先加入磷酸,再加入NaOH,调节pH约为2,生成磷酸铁沉淀。若
 ,会导致
,会导致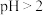 ,会导致
,会导致(3)经陈化、过滤后,所得滤液除少量磷酸铁外还含有的主要成分是
(4)在该流程中,以
 、
、 、
、 和NaOH为反应物制得水合磷酸铁
和NaOH为反应物制得水合磷酸铁 总反应的离子方程式为
总反应的离子方程式为(5)煅烧水合磷酸铁过程中的TG(热重)及DSC(反映体系热量变化况,数值已省略)曲线如下图。样品在50~120℃有少量失重,可能是样品吸潮引起的少量游离水的损失(0.7%左右),从120℃开始有明显的失重,到200℃时失重达19.98%,则x值为

 为正交晶系结构,其晶胞参数为
为正交晶系结构,其晶胞参数为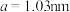 、
、 、
、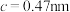 ,
, 。其晶胞结构如图所示,其中O围绕Fe和P分别形成正八面体和正四面体。则该晶体的密度为
。其晶胞结构如图所示,其中O围绕Fe和P分别形成正八面体和正四面体。则该晶体的密度为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。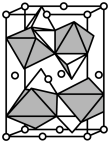
您最近一年使用:0次
2024-05-14更新
|
63次组卷
|
2卷引用:2024届河南省平许济洛四市高三下学期第四次质量检测理科综合试题-高中化学
解题方法
7 . 某实验小组对 溶液和
溶液和 溶液的反应进行探究。
溶液的反应进行探究。
资料: 为白色固体,易溶于水。
为白色固体,易溶于水。
【实验1】
I.探究反应的产物
(1)经检验实验中的黑色固体均为 。实验1-1反应的离子方程式为
。实验1-1反应的离子方程式为_________ 。
【实验2】
①证明实验1-2所得固体洗涤干净的实验操作及现象是_________ 。
②依据实验2,推测S与NaOH反应的离子方程式为_________ 。
③实验2中,加入硝酸的目的是_________ 。
(3)实验证明红色固体为Cu。补全静置后红色固体转化为黑色固体反应的离子方程式:_____ 。
□ □
□ □___+□__
□___+□__ □__+□
□__+□
Ⅱ.探究影响反应产物的因素
【实验3】
说明:本实验中,电压表的读数越大,氧化剂的氧化性(或还原剂的还原性)越强。
(4)资料表明,对于电极反应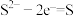 ,
, 对
对 还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是
还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是_________ 。
(5)小组同学用实验3装置补做实验3-5,排除了 的影响。他们所用试剂a为饱和
的影响。他们所用试剂a为饱和 溶液,b为
溶液,b为_________ 。
(6)综合上述实验可以得到的结论有_________ 。
 溶液和
溶液和 溶液的反应进行探究。
溶液的反应进行探究。资料:
 为白色固体,易溶于水。
为白色固体,易溶于水。【实验1】
序号 | 实验操作 | 实验现象 |
| 向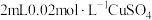 溶液中加入 溶液中加入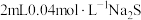 溶液 溶液 | 产生黑色固体 |
| 向 饱和 饱和 溶液(约为 溶液(约为 , , 约为3)中加入 约为3)中加入 饱和 饱和 溶液(约为 溶液(约为 , , 约为13) 约为13) | 迅速产生大量黑色固体、少量红色固体和黄色固体,静置后红色固体减少、黑色固体增多 |
(1)经检验实验中的黑色固体均为
 。实验1-1反应的离子方程式为
。实验1-1反应的离子方程式为【实验2】
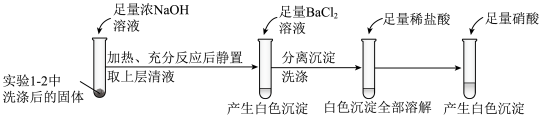
①证明实验1-2所得固体洗涤干净的实验操作及现象是
②依据实验2,推测S与NaOH反应的离子方程式为
③实验2中,加入硝酸的目的是
(3)实验证明红色固体为Cu。补全静置后红色固体转化为黑色固体反应的离子方程式:
□
 □
□ □___+□__
□___+□__ □__+□
□__+□
Ⅱ.探究影响反应产物的因素
【实验3】
序号 | 实验方案 | 实验现象 | |
3-1 |
| a:饱和 溶液 溶液b:饱和  溶液 溶液 | 电压表指针偏转,读数为0.85V |
3-2 | a: 溶液 溶液b: 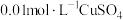 溶液 溶液 | 电压表指针偏转,读数为0.46V | |
3-3 | a: 溶液(pH调至13) 溶液(pH调至13)b: 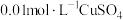 溶液 溶液 | 电压表指针偏转,读数为0.68V | |
3-4 | a: 溶液(pH调至13) 溶液(pH调至13)b: 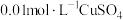 溶液 溶液 | 电压表指针略偏转,读数为0.10V | |
(4)资料表明,对于电极反应
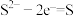 ,
, 对
对 还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是
还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是(5)小组同学用实验3装置补做实验3-5,排除了
 的影响。他们所用试剂a为饱和
的影响。他们所用试剂a为饱和 溶液,b为
溶液,b为(6)综合上述实验可以得到的结论有
您最近一年使用:0次
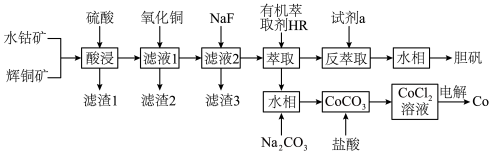
8 . 以水钴矿(Co2O3·H2O,含Fe2O3、MgO、CaO)和辉铜矿(Cu2S,含SiO2、Fe2O3)为原料制取胆矾和单质钴。
①常温下,Ksp(MgF2)=6.25×10-9,Ksp(CaSO4)=7.1×10-7,Ksp(CoCO3)=2.4×10-7;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
③萃取Cu2+的反应原理;Cu2++2HR CuR2+2H+;
CuR2+2H+;
④Mg、Ca、Fe、Co均能与强酸反应产生H2。
回答下列问题:
(1)“酸浸”过程硫元素价态变为+6价,写出“酸浸”过程中主要反应的化学方程式:___________ 。
(2)“滤渣1”的主要成分为___________ 。
(3)常温下,“滤液1”中(Fe元素都以Fe3+形式存在)加“氧化铜”调pH不小于___________ 。
(4)常温下,若“滤液2”中c(Mg2+)=0.015mol/L(忽略溶液中极少量的Ca2+),除去2L“滤液2”中的Mg2+,至少需加入NaF固体的质量为___________ g(忽略溶液体积的变化)。
(5)“反萃取”步骤中加入的“试剂a”为___________ 。
(6)采用惰性电极电解CoCl2溶液﹑在无离子交换膜的条件下,不能用CoSO4溶液代替CoCl2溶液的理由是___________ 。
(7)将制得的胆矾配成溶液,先加入足量氨水,得到深蓝色溶液,再通入SO2至弱酸性,生成白色沉淀。经仪器分析:白色沉淀含H、N,O、S、Cu五种元素,且Cu∶N∶S=1∶4∶l;所含Cu离子中无单电子;晶体的部分组成微粒的空间构型分别为三角锥形和正四面体形。则白色沉淀的化学式为___________ 。
①常温下,Ksp(MgF2)=6.25×10-9,Ksp(CaSO4)=7.1×10-7,Ksp(CoCO3)=2.4×10-7;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 金属离子 | Fe3+ | Fe2+ | Co2+ | Cu2+ |
| 开始沉淀时(c=0.01mol/L)的pH | 2.7 | 7.5 | 7.6 | 4.7 |
| 完全沉淀时(c=10-5mol/L)的pH | 3.7 | 9.0 | 9.1 | 6.2 |
 CuR2+2H+;
CuR2+2H+;④Mg、Ca、Fe、Co均能与强酸反应产生H2。
回答下列问题:
(1)“酸浸”过程硫元素价态变为+6价,写出“酸浸”过程中主要反应的化学方程式:
(2)“滤渣1”的主要成分为
(3)常温下,“滤液1”中(Fe元素都以Fe3+形式存在)加“氧化铜”调pH不小于
(4)常温下,若“滤液2”中c(Mg2+)=0.015mol/L(忽略溶液中极少量的Ca2+),除去2L“滤液2”中的Mg2+,至少需加入NaF固体的质量为
(5)“反萃取”步骤中加入的“试剂a”为
(6)采用惰性电极电解CoCl2溶液﹑在无离子交换膜的条件下,不能用CoSO4溶液代替CoCl2溶液的理由是
(7)将制得的胆矾配成溶液,先加入足量氨水,得到深蓝色溶液,再通入SO2至弱酸性,生成白色沉淀。经仪器分析:白色沉淀含H、N,O、S、Cu五种元素,且Cu∶N∶S=1∶4∶l;所含Cu离子中无单电子;晶体的部分组成微粒的空间构型分别为三角锥形和正四面体形。则白色沉淀的化学式为
您最近一年使用:0次
解题方法
9 . 高纯 具有强的抗反射、抗氧化、抗老化的特性,可用于光学镀膜等对纯度要求较高的领域.以氟硅酸制备高纯
具有强的抗反射、抗氧化、抗老化的特性,可用于光学镀膜等对纯度要求较高的领域.以氟硅酸制备高纯 的工艺流程如下:
的工艺流程如下:
回答下列问题:
(1)纯 不稳定,易分解为
不稳定,易分解为 和
和___________ ,但其水溶液可以较稳定存在,能完全电离成 和
和 中心原子的配位数为
中心原子的配位数为___________ .
(2) 在热水中会发生水解,得到两种弱酸和一种盐,写出其发生的化学方程式为
在热水中会发生水解,得到两种弱酸和一种盐,写出其发生的化学方程式为______________________ .
(3)若没有“干燥”工序,会导致“热分解”产生的 纯度降低,其原因是
纯度降低,其原因是______________________ .
(4)“热分解”工序若采用直接加热分解的方式,会观察到生成的副产品1熔融包裹着未分解的物质,且发现随着时间延长分解效率增加不明显,解释原因______________________ .
(5)“合成”时,为了提升产品纯度,反应温度应该控制在___________  .
.
a.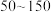 b.
b.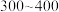 c.
c.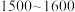
(6)在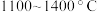 的条件下,将副产品2与
的条件下,将副产品2与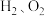 反应,可制得光导纤维的主要成分,反应的化学方程式为
反应,可制得光导纤维的主要成分,反应的化学方程式为______________________ .
 具有强的抗反射、抗氧化、抗老化的特性,可用于光学镀膜等对纯度要求较高的领域.以氟硅酸制备高纯
具有强的抗反射、抗氧化、抗老化的特性,可用于光学镀膜等对纯度要求较高的领域.以氟硅酸制备高纯 的工艺流程如下:
的工艺流程如下: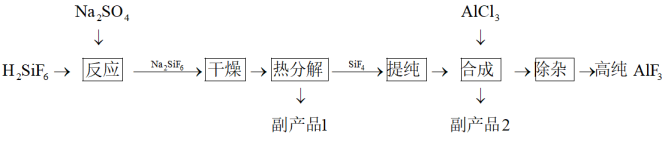
熔点 | 沸点 | 性质 | |
|
|
| 都易水解 |
|
| 57.6 | |
| 1040 | 1537 | |
| 194 | 178(升华) |
(1)纯
 不稳定,易分解为
不稳定,易分解为 和
和 和
和 中心原子的配位数为
中心原子的配位数为(2)
 在热水中会发生水解,得到两种弱酸和一种盐,写出其发生的化学方程式为
在热水中会发生水解,得到两种弱酸和一种盐,写出其发生的化学方程式为(3)若没有“干燥”工序,会导致“热分解”产生的
 纯度降低,其原因是
纯度降低,其原因是(4)“热分解”工序若采用直接加热分解的方式,会观察到生成的副产品1熔融包裹着未分解的物质,且发现随着时间延长分解效率增加不明显,解释原因
(5)“合成”时,为了提升产品纯度,反应温度应该控制在
 .
.a.
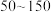 b.
b.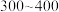 c.
c.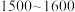
(6)在
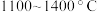 的条件下,将副产品2与
的条件下,将副产品2与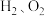 反应,可制得光导纤维的主要成分,反应的化学方程式为
反应,可制得光导纤维的主要成分,反应的化学方程式为
您最近一年使用:0次
解题方法
10 . 钛合金在航空航天领域有着广泛的应用.一种利用废脱硝催化剂(含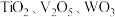 等成分)提取钛的工艺流程如图所示.下列说法错误的是
等成分)提取钛的工艺流程如图所示.下列说法错误的是
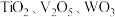 等成分)提取钛的工艺流程如图所示.下列说法错误的是
等成分)提取钛的工艺流程如图所示.下列说法错误的是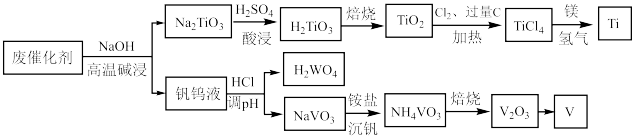
A.基态钛的价层电子排布式为 |
| B.上述流程中共涉及到3个氧化还原反应 |
C.高温碱浸生成 的离子方程式为: 的离子方程式为: |
| D.铝热反应制备钒与上述反应中镁冶炼钛的原理相似 |
您最近一年使用:0次