1 . 某学习小组拟研究FeSO4的分解实验探究,请你帮该小组完成以下实验方案。
[实验目的]探究FeSO4分解产物与温度关系。
[提出假设]
假设1:Fe2O3、SO3、SO2;假设2:FeO、SO3、SO2;假设3:Fe3O4、SO3、SO2。
[查阅资料]已知:
①铁氰化钾K3[Fe(CN)6]溶液遇Fe2+产生蓝色沉淀。
②几种物质的物理性质如表所示。
回答下列问题:
(1)根据所学知识判断,假设2肯定不成立,理由是_______ 。
(2)写出假设1的化学反应方程式:_______ 。
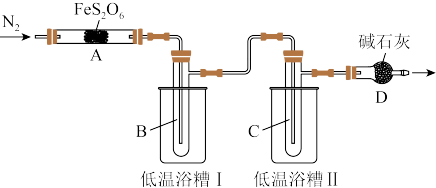
(3)实验过程中,在检查装置气密性之后,向装置中通入N2,其目的是_______ ,当A处固体完全分解后再通入N2。实验室用饱和氯化铵溶液和亚硝酸钠溶液共热制备N2,该反应的离子方程式为_______ 。
(4)低温浴槽Ⅰ收集的物质是_______ (填化学式)。
(5)甲、乙组分别进行实验,实验数据如下(不考虑损失,固体已完全分解且固体产物为纯净物):
甲组实验中A装置得到固体产物是_______ (填化学式)。
(6)为进一步确认固体产物成分,取乙组实验得到的固体溶于稀硫酸,将溶液分成两份,进行如下实验:在一份溶液中滴加铁氰化钾K3[Fe(CN)6]溶液,产生蓝色沉淀。在另一份溶液中滴加NH4SCN溶液,观察到的现象是_______ 。
[实验结论]通过上述实验,FeSO4分解产物与温度有关。
[实验目的]探究FeSO4分解产物与温度关系。
[提出假设]
假设1:Fe2O3、SO3、SO2;假设2:FeO、SO3、SO2;假设3:Fe3O4、SO3、SO2。
[查阅资料]已知:
①铁氰化钾K3[Fe(CN)6]溶液遇Fe2+产生蓝色沉淀。
②几种物质的物理性质如表所示。
| 物质 | SO3 | SO2 | O2 | N2 |
| 熔点/℃ | 16.8 | -72.4 | -218.4 | -209.9 |
| 沸点/℃ | 44.8 | -10 | -182.9 | -195.8 |

回答下列问题:
(1)根据所学知识判断,假设2肯定不成立,理由是
(2)写出假设1的化学反应方程式:
(3)实验过程中,在检查装置气密性之后,向装置中通入N2,其目的是
(4)低温浴槽Ⅰ收集的物质是
(5)甲、乙组分别进行实验,实验数据如下(不考虑损失,固体已完全分解且固体产物为纯净物):
| 实验 | A处温度/℃ | FeSO4质量/g | 低温浴槽Ⅰ净增质量/g | 低温浴槽Ⅱ净增质量/g |
| 甲 | T1 | 3.04 | 0.80 | 0.64 |
| 乙 | T2 | 4.56 | 1.60 | 0.64 |
(6)为进一步确认固体产物成分,取乙组实验得到的固体溶于稀硫酸,将溶液分成两份,进行如下实验:在一份溶液中滴加铁氰化钾K3[Fe(CN)6]溶液,产生蓝色沉淀。在另一份溶液中滴加NH4SCN溶液,观察到的现象是
[实验结论]通过上述实验,FeSO4分解产物与温度有关。
您最近一年使用:0次
2 . 化学为疫情防控提供了强有力的支撑。许多含氯物质既是重要化工原料,又是高效、广谱的灭菌消毒剂。
(1)舍勒用软锰矿(主要成分为二氧化锰)为原料得到氯气,反应的化学方程式为_______ 。
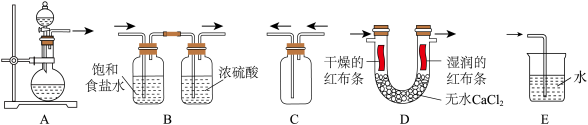
(2)应用以上原理制备、净化、收集氯气并进行性质检验和尾气处理,下列装置(“→”表示气流方向)不能达到实验目的的是_______ 。
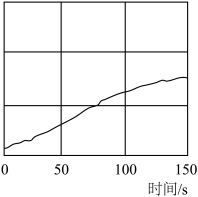
(3)为验证氯水中HClO分解的产物,现用强光照射氯水,并用氯离子浓度传感器、氧气传感器(测体积分数)、pH传感器等仪器进行数据采集,获得相关变化曲线如图。图中纵坐标可表示的物理量是_______ (任写两个)。
(4)下列物质常用于杀菌消毒,其中消毒原理与HClO相同的是_______
(5)84消毒液的主要成分为NaClO和NaCl,不能与酸性清洁剂混合使用,其原因是_______ 。
(6)二氧化氯( )是常用消毒剂,但其稳定性差,通常把它通入
)是常用消毒剂,但其稳定性差,通常把它通入 和NaOH的混合溶液中,使之转化成
和NaOH的混合溶液中,使之转化成 ,便于运输储存。写出对应的离子方程式
,便于运输储存。写出对应的离子方程式_______ 。
(7)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,是指每克含氯消毒剂的氧化能力相当于多少克 的氧化能力,NaClO、
的氧化能力,NaClO、 、
、 作为消毒剂,还原产物相同,这三种消毒剂的有效氯含量由大到小的顺序为
作为消毒剂,还原产物相同,这三种消毒剂的有效氯含量由大到小的顺序为_______ 。
(1)舍勒用软锰矿(主要成分为二氧化锰)为原料得到氯气,反应的化学方程式为
(2)应用以上原理制备、净化、收集氯气并进行性质检验和尾气处理,下列装置(“→”表示气流方向)不能达到实验目的的是

(3)为验证氯水中HClO分解的产物,现用强光照射氯水,并用氯离子浓度传感器、氧气传感器(测体积分数)、pH传感器等仪器进行数据采集,获得相关变化曲线如图。图中纵坐标可表示的物理量是

(4)下列物质常用于杀菌消毒,其中消毒原理与HClO相同的是_______
A. | B.酒精 | C.熟石灰 | D. |
(6)二氧化氯(
 )是常用消毒剂,但其稳定性差,通常把它通入
)是常用消毒剂,但其稳定性差,通常把它通入 和NaOH的混合溶液中,使之转化成
和NaOH的混合溶液中,使之转化成 ,便于运输储存。写出对应的离子方程式
,便于运输储存。写出对应的离子方程式(7)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,是指每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力,NaClO、
的氧化能力,NaClO、 、
、 作为消毒剂,还原产物相同,这三种消毒剂的有效氯含量由大到小的顺序为
作为消毒剂,还原产物相同,这三种消毒剂的有效氯含量由大到小的顺序为
您最近一年使用:0次
名校
3 . 某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2 和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3 制备成Na2CO3。
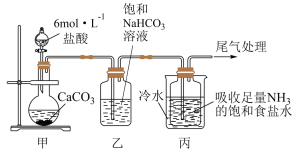
(1)装置甲中反应的离子方程式 为______________ ,装置乙的作用是__________ ,反应的化学方程式为__________________ 。
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3,装置丙中反应的化学方程式为_________________ 。
(3)用装置丙中产生的NaHCO3 制取Na2CO3 时,需要进行的实验操作有__________ 、洗涤、干燥、灼烧固体, 化学方程式为_______________ 。
Ⅱ.测定所得产品的组成和纯度
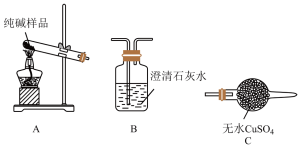
(4)检验纯碱样品中是否混有NaHCO3,请完成下表:
(5)测定该纯碱样品的纯度:称取m1 g 样品,置于试管中,充分加热,得到固体的质量为m2 g。则该纯碱样品的纯度为_______。(填字母代号)
Ⅰ.制备纯碱:先以NaCl、NH3、CO2 和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3 制备成Na2CO3。

(1)装置甲中反应的
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3,装置丙中反应的化学方程式为
(3)用装置丙中产生的NaHCO3 制取Na2CO3 时,需要进行的实验操作有
Ⅱ.测定所得产品的组成和纯度

(4)检验纯碱样品中是否混有NaHCO3,请完成下表:
| 装置的顺序(填编号) | 实验现象 | 实验结论 |
| 样品中含NaHCO3 |
(5)测定该纯碱样品的纯度:称取m1 g 样品,置于试管中,充分加热,得到固体的质量为m2 g。则该纯碱样品的纯度为_______。(填字母代号)
A.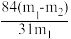 | B.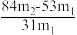 |
C. | D.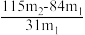 |
您最近一年使用:0次
名校
解题方法
4 . 某小组在实验室用NaClO溶液和NH3反应制备肼(N2H4),并进行相关性质探究实验。
Ⅰ.实验室制备N2H4
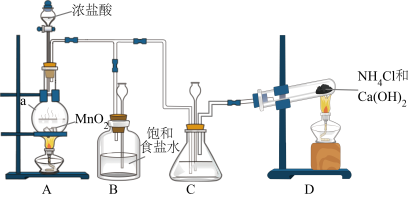
(1)装置D中反应的化学方程式是___________ 。
(2)装置C中盛放的试剂是___________ 。
(3)制备N2H4的离子方程式___________ 。
Ⅱ.测定产品中水合肼(N2H4·H2O)的含量
(4)称取产品6.0g,加入适量NaHCO3固体(调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol/L的碘标准溶液滴定(已知:N2H4·H2O +2I2 = N2↑+ 4HI + H2O)。
①滴定到达终点的现象是___________ 。
②重复上述滴定实验2~3次,测得消耗碘标准溶液的平均值为20.00mL,产品中水合肼的质量分数为___________ 。
Ⅲ.探究肼的化学性质。将制得的肼分离提纯后,进行如下实验。
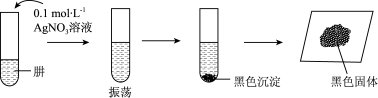
【查阅资料】AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】
(5)设计如下方案,进行实验。
③综合上述实验,肼具有的性质是___________
(6)N2H4是一种二元弱碱,在水中的电离与NH3相似,写出肼的第一步电离方程式___________
Ⅰ.实验室制备N2H4

(1)装置D中反应的化学方程式是
(2)装置C中盛放的试剂是
(3)制备N2H4的离子方程式
Ⅱ.测定产品中水合肼(N2H4·H2O)的含量
(4)称取产品6.0g,加入适量NaHCO3固体(调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol/L的碘标准溶液滴定(已知:N2H4·H2O +2I2 = N2↑+ 4HI + H2O)。
①滴定到达终点的现象是
②重复上述滴定实验2~3次,测得消耗碘标准溶液的平均值为20.00mL,产品中水合肼的质量分数为
Ⅲ.探究肼的化学性质。将制得的肼分离提纯后,进行如下实验。

【查阅资料】AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】
(5)设计如下方案,进行实验。
| 操作 | 现象 | 结论 |
| ⅰ.取少量黑色固体于试管中,加入足量① | 黑色固体部分溶解 | 黑色固体有Ag2O |
| ⅱ.取少量黑色固体于试管中,加入足量稀硝酸,振荡 | ② | 黑色固体是Ag和Ag2O |
(6)N2H4是一种二元弱碱,在水中的电离与NH3相似,写出肼的第一步电离方程式
您最近一年使用:0次
解题方法
5 . Ⅰ.铁及其化合物在生产生活中有极其重要的用途。 可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 ,以利于人体吸收。为了验证这一猜想,设计了如下实验:
,以利于人体吸收。为了验证这一猜想,设计了如下实验:
(1)由上述实验能否得出“维生素C可将 转化为
转化为 ”的结论?请说明理由:
”的结论?请说明理由:______ 。
Ⅱ.高铁酸钾( )是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和
)是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和 胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
(2)熔融法:在苛性碱存在的环境中,铁盐被过氧化钠高温氧化成高铁酸钠: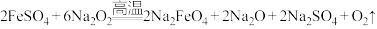 ,再加入适量饱和KOH溶液反应得到
,再加入适量饱和KOH溶液反应得到 。上述反应在熔融状态下进行,而不在水溶液中进行的原因是
。上述反应在熔融状态下进行,而不在水溶液中进行的原因是______ 。
(3)高铁酸钾可通过次氯酸钾氧化 溶液来制备。次氯酸钾的制备装置如图所示。
溶液来制备。次氯酸钾的制备装置如图所示。
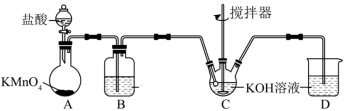
回答下列问题:
①装置A中 与盐酸反应生成
与盐酸反应生成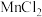 和
和 ,其化学方程式为
,其化学方程式为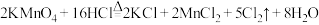 。
。
a.请用双线桥法标出电子转移方向与数目_______ 。
b.上述反应中的HCl体现了什么性质?_______ 。
②将制备的 通过装置B可除去杂质HCl,B中的溶液为
通过装置B可除去杂质HCl,B中的溶液为_____ 。
③ 和KOH溶液在较高温度下反应生成
和KOH溶液在较高温度下反应生成 。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是
。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是______ 。
④若实验制得的次氯酸钾溶液中 (N代表微粒个数),则
(N代表微粒个数),则
_______ 。
⑤装置D的作用是_______ 。
⑥次氯酸盐氧化法是在碱性条件下,KClO饱和溶液可将 转化为
转化为 ,写出反应的离子方程式:
,写出反应的离子方程式:________ 。
 可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 ,以利于人体吸收。为了验证这一猜想,设计了如下实验:
,以利于人体吸收。为了验证这一猜想,设计了如下实验:| 实验方案 | 实验现象 |
取适量 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 | 紫色褪去 |
(1)由上述实验能否得出“维生素C可将
 转化为
转化为 ”的结论?请说明理由:
”的结论?请说明理由:Ⅱ.高铁酸钾(
 )是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和
)是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和 胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。(2)熔融法:在苛性碱存在的环境中,铁盐被过氧化钠高温氧化成高铁酸钠:
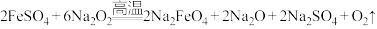 ,再加入适量饱和KOH溶液反应得到
,再加入适量饱和KOH溶液反应得到 。上述反应在熔融状态下进行,而不在水溶液中进行的原因是
。上述反应在熔融状态下进行,而不在水溶液中进行的原因是(3)高铁酸钾可通过次氯酸钾氧化
 溶液来制备。次氯酸钾的制备装置如图所示。
溶液来制备。次氯酸钾的制备装置如图所示。
回答下列问题:
①装置A中
 与盐酸反应生成
与盐酸反应生成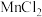 和
和 ,其化学方程式为
,其化学方程式为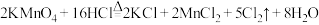 。
。a.请用双线桥法标出电子转移方向与数目
b.上述反应中的HCl体现了什么性质?
②将制备的
 通过装置B可除去杂质HCl,B中的溶液为
通过装置B可除去杂质HCl,B中的溶液为③
 和KOH溶液在较高温度下反应生成
和KOH溶液在较高温度下反应生成 。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是
。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是④若实验制得的次氯酸钾溶液中
 (N代表微粒个数),则
(N代表微粒个数),则
⑤装置D的作用是
⑥次氯酸盐氧化法是在碱性条件下,KClO饱和溶液可将
 转化为
转化为 ,写出反应的离子方程式:
,写出反应的离子方程式:
您最近一年使用:0次
名校
6 . 某小组在实验室用NaClO溶液和NH3反应制备N2H4,并进行相关的性质探究实验。
I.制备N2H4
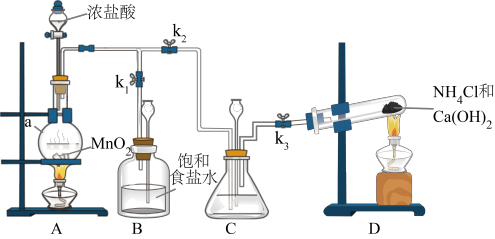
(1)装置C中盛放的试剂是___________ ,其作用是___________ 。(用离子方程式表示)
(2)装置D发生的反应的方程式为___________ 。
(3)制备N2H4的离子方程式为___________ 。
II.探究N2H4的还原性与碱性。将制得的肼分离提纯后,进行如图实验。
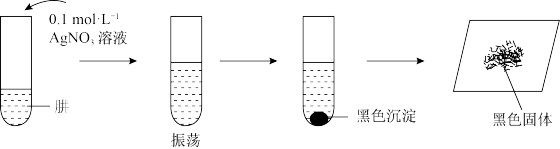
【查阅资料】AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如表方案,进行实验。
(4)请完成表中的空白部分
(5)实验表明,黑色固体主要成分是Ag,还有少量氧化银。请解释原因:___________ 。
I.制备N2H4

(1)装置C中盛放的试剂是
(2)装置D发生的反应的方程式为
(3)制备N2H4的离子方程式为
II.探究N2H4的还原性与碱性。将制得的肼分离提纯后,进行如图实验。

【查阅资料】AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如表方案,进行实验。
(4)请完成表中的空白部分
| 操作 | 现象 | 实验结论 |
| i. 取少量黑色固体于试管中,加入适量 | 黑色固体部分溶解 | 黑色固体有Ag2O |
| ii. 取少量黑色固体于试管中加入足量稀硝酸,振荡。 | 黑色固体是Ag和Ag2O |
您最近一年使用:0次
名校
7 . FeCl3是中学常见的试剂,某实验小组用以下装置制备FeCl3固体,并探究FeCl3溶液与Cu的反应。
已知:FeCl3晶体易升华,FeCl3溶液易水解。
Ⅰ.FeCl3的制备___________ 。
(2)F的名称为___________ ,从D、E、F中选择合适的装置制备纯净的 ,正确的接口顺序为a-
,正确的接口顺序为a-___________ (可选试剂:饱和食盐水、NaOH溶液、浓硫酸、碱石灰,仪器可重复使用)。
(3)写出装置D中制备 的离子方程式
的离子方程式___________ 。
Ⅱ.探究FeCl3溶液与Cu的反应
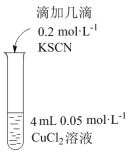
向4mL0.1mol/LFeCl3溶液中滴加几滴0.2mol/LKSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知: 和
和 均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
猜想1: 与过量的Cu粉反应生成
与过量的Cu粉反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。
猜想2: 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。
针对上述猜想,实验小组同学设计了以下实验:
(4)实验结果说明猜想___________ (填“1”或“2”)不合理。
(5)根据实验2中的现象进一步查阅资料发现:
i. 与
与 可发生如下两种反应:
可发生如下两种反应:
反应A: (淡黄色);
(淡黄色);
反应B: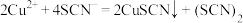 (黄色)。
(黄色)。
ii. 与
与 共存时溶液显绿色。
共存时溶液显绿色。
①由实验2中的现象推测,反应速率:A___________ (填“>”或“<”)B,说明反应B___________ (填“是”或“不是”)产生 的主要原因。
的主要原因。
②进一步查阅资料可知,当反应体系中同时存在 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入
溶液中同时加入 、
、 ,立即生成白色沉淀
,立即生成白色沉淀 ,写出该反应离子方程式
,写出该反应离子方程式___________ 。
(6)若向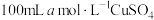 溶液中滴加足量的
溶液中滴加足量的 和
和 的混合溶液,经过一系列操作得到白色沉淀
的混合溶液,经过一系列操作得到白色沉淀 的质量
的质量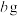 ,则
,则 的产率为
的产率为___________ (写出表达式即可)。
已知:FeCl3晶体易升华,FeCl3溶液易水解。
Ⅰ.FeCl3的制备
(2)F的名称为
 ,正确的接口顺序为a-
,正确的接口顺序为a-(3)写出装置D中制备
 的离子方程式
的离子方程式Ⅱ.探究FeCl3溶液与Cu的反应
向4mL0.1mol/LFeCl3溶液中滴加几滴0.2mol/LKSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知:
 和
和 均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:猜想1:
 与过量的Cu粉反应生成
与过量的Cu粉反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。猜想2:
 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。针对上述猜想,实验小组同学设计了以下实验:
| 实验编号 | 操作 | 现象 |
| 实验1 |
| 加入铜粉后无现象 |
| 实验2 |
| 溶液很快由蓝色变为绿色,未观察到白色沉淀; 2h后溶液为绿色,未观察到白色沉淀;24h后, 溶液绿色变浅,试管底部有白色沉淀 |
(5)根据实验2中的现象进一步查阅资料发现:
i.
 与
与 可发生如下两种反应:
可发生如下两种反应:反应A:
 (淡黄色);
(淡黄色);反应B:
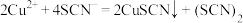 (黄色)。
(黄色)。ii.
 与
与 共存时溶液显绿色。
共存时溶液显绿色。①由实验2中的现象推测,反应速率:A
 的主要原因。
的主要原因。②进一步查阅资料可知,当反应体系中同时存在
 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入
溶液中同时加入 、
、 ,立即生成白色沉淀
,立即生成白色沉淀 ,写出该反应离子方程式
,写出该反应离子方程式(6)若向
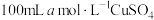 溶液中滴加足量的
溶液中滴加足量的 和
和 的混合溶液,经过一系列操作得到白色沉淀
的混合溶液,经过一系列操作得到白色沉淀 的质量
的质量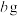 ,则
,则 的产率为
的产率为
您最近一年使用:0次
2023-03-10更新
|
1014次组卷
|
3卷引用:广东省广州大学附属中学2023-2024学年高三上学期开学考试化学试题
名校
8 . 利用 氧化绿色的
氧化绿色的 浓强碱溶液制备
浓强碱溶液制备 的装置如下图所示(加热、夹持装置略):
的装置如下图所示(加热、夹持装置略):_______ 。
(2)如果d中用足量的 溶液吸收多余氯气,写出相应的离子方程式:
溶液吸收多余氯气,写出相应的离子方程式:_______ 。
(3)一段时间后,当仪器C中_______ (填实验现象)即停止通氯气。熄灭 处酒精灯,再
处酒精灯,再_______ ,待冷却后拆除装置。
(4)某同学在实验中发现,若用稀盐酸代替浓盐酸与 混合加热没有氯气生成,欲探究该条件下不能生成氯气的原因,该同学提出下列假设:
混合加热没有氯气生成,欲探究该条件下不能生成氯气的原因,该同学提出下列假设:
假设1: 的浓度不够大;
的浓度不够大;
假设2:_______ ;
假设3: 和
和 的浓度均不够大。
的浓度均不够大。
设计实验方案,进行实验。在下表中写出实验步骤以及预期现象和结论。(限选实验试剂:蒸馏水、浓 、
、 固体、
固体、 固体、稀盐酸、
固体、稀盐酸、 溶液、淀粉-KI溶液)
溶液、淀粉-KI溶液)
(5)医学上常用酸性 溶液和草酸(
溶液和草酸( )溶液反应(实验中会生成
)溶液反应(实验中会生成 )来测血液中血钙的含量。测定方法是取
)来测血液中血钙的含量。测定方法是取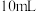 血液用蒸馏水稀释后,向其中加入足量的
血液用蒸馏水稀释后,向其中加入足量的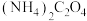 溶液,反应生成
溶液,反应生成 沉淀,将沉淀用稀硫酸溶解并不断搅拌得到
沉淀,将沉淀用稀硫酸溶解并不断搅拌得到 后,再滴入
后,再滴入 溶液进行反应,反应完全时消耗了
溶液进行反应,反应完全时消耗了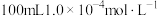 的
的 溶液(相关反应的方程式为:
溶液(相关反应的方程式为: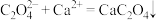 、
、 、
、
 。则
。则 该血液中含钙
该血液中含钙_______ g。
 氧化绿色的
氧化绿色的 浓强碱溶液制备
浓强碱溶液制备 的装置如下图所示(加热、夹持装置略):
的装置如下图所示(加热、夹持装置略):
(2)如果d中用足量的
 溶液吸收多余氯气,写出相应的离子方程式:
溶液吸收多余氯气,写出相应的离子方程式:(3)一段时间后,当仪器C中
 处酒精灯,再
处酒精灯,再(4)某同学在实验中发现,若用稀盐酸代替浓盐酸与
 混合加热没有氯气生成,欲探究该条件下不能生成氯气的原因,该同学提出下列假设:
混合加热没有氯气生成,欲探究该条件下不能生成氯气的原因,该同学提出下列假设:假设1:
 的浓度不够大;
的浓度不够大;假设2:
假设3:
 和
和 的浓度均不够大。
的浓度均不够大。设计实验方案,进行实验。在下表中写出实验步骤以及预期现象和结论。(限选实验试剂:蒸馏水、浓
 、
、 固体、
固体、 固体、稀盐酸、
固体、稀盐酸、 溶液、淀粉-KI溶液)
溶液、淀粉-KI溶液)| 实验步骤 | 预期现象与结论 |
步骤1:取少量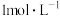 稀盐酸于试管A中,加入少量 稀盐酸于试管A中,加入少量 ,滴加几滴浓硫酸,充分振荡,塞紧带导管的胶塞,导管插入淀粉-KI溶液中,加热 ,滴加几滴浓硫酸,充分振荡,塞紧带导管的胶塞,导管插入淀粉-KI溶液中,加热 | ①若淀粉-KI溶液变蓝,则假设1成立 ②若淀粉-KI溶液不变蓝,则假设2或假设3成立 |
步骤2:取少量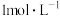 稀盐酸于试管B中,加入少量 稀盐酸于试管B中,加入少量 ,加入少量NaCl固体,充分振荡,塞紧带导管的胶塞,导管插入淀粉-KI溶液中,加热 ,加入少量NaCl固体,充分振荡,塞紧带导管的胶塞,导管插入淀粉-KI溶液中,加热 | ①若淀粉-KI溶液变蓝,则 ②若淀粉-KI溶液不变蓝,结合步骤1中的结论②,则 |
(5)医学上常用酸性
 溶液和草酸(
溶液和草酸( )溶液反应(实验中会生成
)溶液反应(实验中会生成 )来测血液中血钙的含量。测定方法是取
)来测血液中血钙的含量。测定方法是取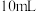 血液用蒸馏水稀释后,向其中加入足量的
血液用蒸馏水稀释后,向其中加入足量的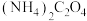 溶液,反应生成
溶液,反应生成 沉淀,将沉淀用稀硫酸溶解并不断搅拌得到
沉淀,将沉淀用稀硫酸溶解并不断搅拌得到 后,再滴入
后,再滴入 溶液进行反应,反应完全时消耗了
溶液进行反应,反应完全时消耗了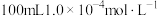 的
的 溶液(相关反应的方程式为:
溶液(相关反应的方程式为: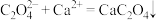 、
、 、
、
 。则
。则 该血液中含钙
该血液中含钙
您最近一年使用:0次
2022-12-14更新
|
78次组卷
|
4卷引用:广东省高州市某校2023-2024学年高一上学期期末模拟化学试题
名校
解题方法
9 . 二氧化硫虽污染环境,但在生活、生产中又有着广泛应用,根据要求回答问题。
Ⅰ.如图所示是酸雨的形成示意图,根据图示回答下列问题。

(1)某实验小组采集硫酸型酸雨样品,随着时间的变化多次测定该样品的pH,得到表中数据:酸雨样品放置时pH变化的主要原因是___________ (用化学方程式表示)。
(2)你认为减少酸雨的产生可采取的措施是___________(填字母)。
①减少用煤作燃料 ②开发新能源 ③化石燃料脱硫 ④在已酸化的土壤中洒石灰 ⑤监测并治理汽车排出的大量尾气 ⑥收集大气中氮氧化物制备硝酸
Ⅱ.某同学根据铜与浓硫酸反应能生成 ,预测锌与浓硫酸反应生成的产物可能为混合气体(水蒸气除外),设计如下装置进行验证(加热和部分夹持装置略):
,预测锌与浓硫酸反应生成的产物可能为混合气体(水蒸气除外),设计如下装置进行验证(加热和部分夹持装置略):

回答下列问题:
(3)A中盛放浓硫酸的仪器名称为___________ 。
(4)该同学预测的混合气体的成分可能为___________ 。
(5)C装置所盛试剂可以是___________ (填一种),实验过程中,理论上可观察到E、F装置的实验现象分别为___________ 、___________ 。
Ⅲ.为测定空气中 的含量,某课外小组的同学将空气样品经过管道通入密闭容器中的
的含量,某课外小组的同学将空气样品经过管道通入密闭容器中的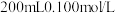 的酸性高锰酸钾溶液。若管道中空气流量为
的酸性高锰酸钾溶液。若管道中空气流量为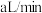 ,经过
,经过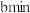 溶液恰好褪色,假定样品中的
溶液恰好褪色,假定样品中的 可以被溶液充分吸收。
可以被溶液充分吸收。
(6)写出上述反应的离子方程式:___________ 。
(7)该样品中的 含量是
含量是___________ 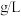 。
。
Ⅰ.如图所示是酸雨的形成示意图,根据图示回答下列问题。

| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
雨水的 | 4.75 | 4.60 | 4.58 | 4.50 | 4.50 |
(2)你认为减少酸雨的产生可采取的措施是___________(填字母)。
①减少用煤作燃料 ②开发新能源 ③化石燃料脱硫 ④在已酸化的土壤中洒石灰 ⑤监测并治理汽车排出的大量尾气 ⑥收集大气中氮氧化物制备硝酸
| A.①②③④⑤⑥ | B.①②③⑤ | C.①②③④⑤ | D.②③⑤⑥ |
Ⅱ.某同学根据铜与浓硫酸反应能生成
 ,预测锌与浓硫酸反应生成的产物可能为混合气体(水蒸气除外),设计如下装置进行验证(加热和部分夹持装置略):
,预测锌与浓硫酸反应生成的产物可能为混合气体(水蒸气除外),设计如下装置进行验证(加热和部分夹持装置略):
回答下列问题:
(3)A中盛放浓硫酸的仪器名称为
(4)该同学预测的混合气体的成分可能为
(5)C装置所盛试剂可以是
Ⅲ.为测定空气中
 的含量,某课外小组的同学将空气样品经过管道通入密闭容器中的
的含量,某课外小组的同学将空气样品经过管道通入密闭容器中的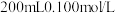 的酸性高锰酸钾溶液。若管道中空气流量为
的酸性高锰酸钾溶液。若管道中空气流量为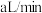 ,经过
,经过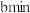 溶液恰好褪色,假定样品中的
溶液恰好褪色,假定样品中的 可以被溶液充分吸收。
可以被溶液充分吸收。(6)写出上述反应的离子方程式:
(7)该样品中的
 含量是
含量是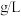 。
。
您最近一年使用:0次
名校
解题方法
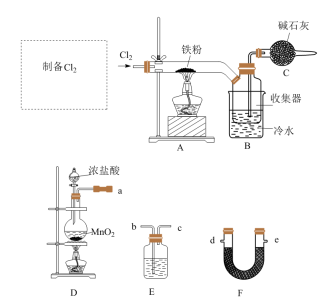
10 . FeCl3(易升华)是常见的化学试剂。某学习小组开展了与FeCl3相关的系列实验,回答下列问题:
I.铁粉制备FeCl3(实验装置如图所示)

(1)仪器a盛装的物质是为_______ (填试剂的名称);装置中F的作用:_______ 。
(2)硬质玻璃管直接接入收集器的优点是_______ 。
II.探究FeCl3溶液与Cu的反应
(3)配制FeCl3溶液时加入少量盐酸的原因是_______ 。
(4)向FeCl3溶液中滴加几滴KSCN溶液,溶液颜色变红,再加入过量Cu粉,发现溶液的红色褪去。用离子方程式解释红色褪去的原因:_______ 。
(5)已知(4)中除了红色褪去,还产生了白色沉淀。小组成员查阅得知CuCl和CuSCN均为白色沉淀。为探究白色沉淀的主要成分,小组成员完成了以下实验:向4mL0.1mol/LFeCl3溶液中加入过量Cu粉,静置,取上层清液于试管中,滴加3滴KSCN溶液,有白色沉淀生成。由此现象可知此白色沉淀为_______ (填化学式)。
小组成员进一步查阅资料发现,Cu2+与SCN-可发生如下两种反应。
反应i:Cu2++4SCN-=[Cu(SCN)4]2-(淡黄色)
反应ii:2Cu2++4SCN-=2CuSCN↓+(SCN)2
设计实验如下:
由此现象可知,反应速率较快的为_______ (填“反应i”或“反应ii”)。小组成员得出结论,反应ii不是CuSCN产生的主要原因。
(6)根据上述分析可知,Cu2+、Fe2+和SCN-可直接发生反应,生成CuSCN和Fe3+,写出反应的离子方程式:_______ 。
I.铁粉制备FeCl3(实验装置如图所示)

(1)仪器a盛装的物质是为
(2)硬质玻璃管直接接入收集器的优点是
II.探究FeCl3溶液与Cu的反应
(3)配制FeCl3溶液时加入少量盐酸的原因是
(4)向FeCl3溶液中滴加几滴KSCN溶液,溶液颜色变红,再加入过量Cu粉,发现溶液的红色褪去。用离子方程式解释红色褪去的原因:
(5)已知(4)中除了红色褪去,还产生了白色沉淀。小组成员查阅得知CuCl和CuSCN均为白色沉淀。为探究白色沉淀的主要成分,小组成员完成了以下实验:向4mL0.1mol/LFeCl3溶液中加入过量Cu粉,静置,取上层清液于试管中,滴加3滴KSCN溶液,有白色沉淀生成。由此现象可知此白色沉淀为
小组成员进一步查阅资料发现,Cu2+与SCN-可发生如下两种反应。
反应i:Cu2++4SCN-=[Cu(SCN)4]2-(淡黄色)
反应ii:2Cu2++4SCN-=2CuSCN↓+(SCN)2
设计实验如下:
| 操作 | 现象 |
| 在盛有2mL0.1mol·L-1CuSO4溶液的试管中滴加KSCN溶液 | 溶液很快由蓝色变为绿色,未观察到白色沉淀; 2h后溶液为绿色,未观察到白色沉淀;24h后,溶液绿色变浅,试管底部有白色沉淀 |
(6)根据上述分析可知,Cu2+、Fe2+和SCN-可直接发生反应,生成CuSCN和Fe3+,写出反应的离子方程式:
您最近一年使用:0次
2022-10-21更新
|
284次组卷
|
3卷引用:广东省深圳市福田区红岭中学2022-2023学年高三下学期第五次模拟化学试题