名校
解题方法
1 . 硫酸亚铁晶体 俗称绿矾,是浅蓝绿色单斜晶体,溶于水后显酸性。在空气中逐渐风化,同时被氧化为黄褐色的
俗称绿矾,是浅蓝绿色单斜晶体,溶于水后显酸性。在空气中逐渐风化,同时被氧化为黄褐色的 。硫酸亚铁的用途广泛,可以制备如下图所示物质。
。硫酸亚铁的用途广泛,可以制备如下图所示物质。
回答下列问题:
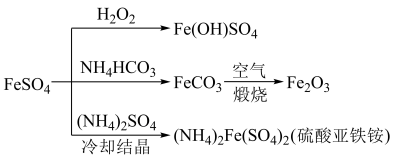
(1)实验室保存硫酸亚铁溶液时,往往加入一定量的铁粉,其目的是___________ ,通过做实验发现,用 氧化硫酸亚铁获得
氧化硫酸亚铁获得 比在空气中被氧化速率快很多,但是
比在空气中被氧化速率快很多,但是 的用量比理论值高很多,其原因是
的用量比理论值高很多,其原因是___________ 。
(2)获取氧化铁过程中,向硫酸亚铁溶液逐滴加入 溶液,控制
溶液,控制 小于6,经过滤、洗涤、干燥获取纯净的
小于6,经过滤、洗涤、干燥获取纯净的 ,在空气中煅烧时,需要采用逆流式投料,增大接触面积,加快反应速率同时使
,在空气中煅烧时,需要采用逆流式投料,增大接触面积,加快反应速率同时使 充分反应,则该反应中氧化剂与还原剂的物质的量之比为
充分反应,则该反应中氧化剂与还原剂的物质的量之比为___________ 。请写出 一种用途是
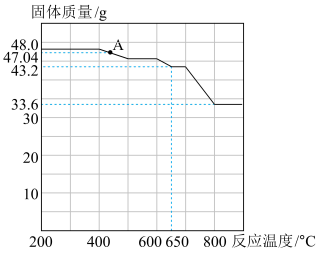
一种用途是___________ 。查阅资料知,在不同温度下 被
被 还原的产物不同。固体质量与反应温度的关系如图所示。则
还原的产物不同。固体质量与反应温度的关系如图所示。则 点时对应固体化学式为
点时对应固体化学式为___________ 。
(3)实验室还可以利用如图所示装置制备并较长时间观察 白色沉淀。
白色沉淀。
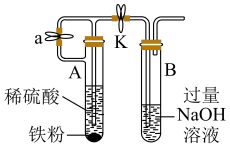
①为了完成实验目的,则装置 中长玻璃管伸到的位置是
中长玻璃管伸到的位置是___________ (填“实线”或“虚线”);
②向装置 先加入铁粉,再加入稀硫酸,在装置
先加入铁粉,再加入稀硫酸,在装置 端收集氢气,并检验纯度,当氢气纯度满足实验要求后,进行的操作是
端收集氢气,并检验纯度,当氢气纯度满足实验要求后,进行的操作是___________ 。
 俗称绿矾,是浅蓝绿色单斜晶体,溶于水后显酸性。在空气中逐渐风化,同时被氧化为黄褐色的
俗称绿矾,是浅蓝绿色单斜晶体,溶于水后显酸性。在空气中逐渐风化,同时被氧化为黄褐色的 。硫酸亚铁的用途广泛,可以制备如下图所示物质。
。硫酸亚铁的用途广泛,可以制备如下图所示物质。回答下列问题:

(1)实验室保存硫酸亚铁溶液时,往往加入一定量的铁粉,其目的是
 氧化硫酸亚铁获得
氧化硫酸亚铁获得 比在空气中被氧化速率快很多,但是
比在空气中被氧化速率快很多,但是 的用量比理论值高很多,其原因是
的用量比理论值高很多,其原因是(2)获取氧化铁过程中,向硫酸亚铁溶液逐滴加入
 溶液,控制
溶液,控制 小于6,经过滤、洗涤、干燥获取纯净的
小于6,经过滤、洗涤、干燥获取纯净的 ,在空气中煅烧时,需要采用逆流式投料,增大接触面积,加快反应速率同时使
,在空气中煅烧时,需要采用逆流式投料,增大接触面积,加快反应速率同时使 充分反应,则该反应中氧化剂与还原剂的物质的量之比为
充分反应,则该反应中氧化剂与还原剂的物质的量之比为 一种用途是
一种用途是 被
被 还原的产物不同。固体质量与反应温度的关系如图所示。则
还原的产物不同。固体质量与反应温度的关系如图所示。则 点时对应固体化学式为
点时对应固体化学式为
(3)实验室还可以利用如图所示装置制备并较长时间观察
 白色沉淀。
白色沉淀。
①为了完成实验目的,则装置
 中长玻璃管伸到的位置是
中长玻璃管伸到的位置是②向装置
 先加入铁粉,再加入稀硫酸,在装置
先加入铁粉,再加入稀硫酸,在装置 端收集氢气,并检验纯度,当氢气纯度满足实验要求后,进行的操作是
端收集氢气,并检验纯度,当氢气纯度满足实验要求后,进行的操作是
您最近一年使用:0次
名校
2 . 某兴趣小组用铬铁矿( ,含
,含 等杂质)为主要原料制备重铬酸钾
等杂质)为主要原料制备重铬酸钾 晶体,流程如下:
晶体,流程如下:

已知: 中
中 元素为
元素为 价;
价; 与
与 高温生成可溶于水的
高温生成可溶于水的 ;
; 酸性条件下能转化为
酸性条件下能转化为 。
。
回答下列问题:
(1)“焙烧”时,除生成 和
和 外,还生成一种无色无味的气体,该反应的化学方程式为
外,还生成一种无色无味的气体,该反应的化学方程式为___________ 。
(2)实验室进行“操作1”用到的玻璃仪器有:烧杯、___________ 。
(3)“晶体X”的化学式为___________ 。
(4)交警查酒驾所用检测仪器的工作原理为:
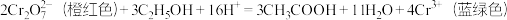
该反应中,还原剂为___________ ;反应消耗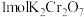 时,转移电子的物质的量为
时,转移电子的物质的量为___________  。
。
(5)“结晶”时,为得到杂质较少的 粗产品,请结合下图从下列选项中选出合理的操作并排序
粗产品,请结合下图从下列选项中选出合理的操作并排序___________ (填字母)。
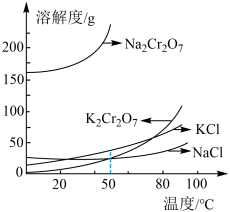
a. 蒸发溶剂 b.
蒸发溶剂 b. 蒸发溶剂 c.过滤 d.冷却至室温
蒸发溶剂 c.过滤 d.冷却至室温
e.蒸发至溶液出现晶膜,停止加热
 ,含
,含 等杂质)为主要原料制备重铬酸钾
等杂质)为主要原料制备重铬酸钾 晶体,流程如下:
晶体,流程如下:
已知:
 中
中 元素为
元素为 价;
价; 与
与 高温生成可溶于水的
高温生成可溶于水的 ;
; 酸性条件下能转化为
酸性条件下能转化为 。
。回答下列问题:
(1)“焙烧”时,除生成
 和
和 外,还生成一种无色无味的气体,该反应的化学方程式为
外,还生成一种无色无味的气体,该反应的化学方程式为(2)实验室进行“操作1”用到的玻璃仪器有:烧杯、
(3)“晶体X”的化学式为
(4)交警查酒驾所用检测仪器的工作原理为:
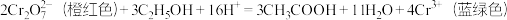
该反应中,还原剂为
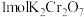 时,转移电子的物质的量为
时,转移电子的物质的量为 。
。(5)“结晶”时,为得到杂质较少的
 粗产品,请结合下图从下列选项中选出合理的操作并排序
粗产品,请结合下图从下列选项中选出合理的操作并排序
a.
 蒸发溶剂 b.
蒸发溶剂 b. 蒸发溶剂 c.过滤 d.冷却至室温
蒸发溶剂 c.过滤 d.冷却至室温e.蒸发至溶液出现晶膜,停止加热
您最近一年使用:0次
2024-02-02更新
|
148次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一上学期期末考试化学试题
名校
解题方法
3 . 硼(B)是冶金、建材、机械领域的重要原料,利用镁还原法生产硼的主要工艺流程如图。

(1)H3BO3中B元素的化合价为___________ ,脱水炉中发生的反应属于基本反应类型中的___________ 反应。
(2)用双线桥法表示还原炉中发生的反应:___________
(3)向酸煮罐加入盐酸目的是除去 MgO,写出该反应的离子方程式:___________
(4)请配平 B单质和 NaOH、NaNO3在高温共融时发生反应的化学方程式:___________
______B+______NaOH+______NaNO3 ______NaBO2+______NaNO2+______H2O
______NaBO2+______NaNO2+______H2O
该反应中还原剂和还原产物的质量之比为___________ 。

(1)H3BO3中B元素的化合价为
(2)用双线桥法表示还原炉中发生的反应:
(3)向酸煮罐加入盐酸目的是除去 MgO,写出该反应的离子方程式:
(4)请配平 B单质和 NaOH、NaNO3在高温共融时发生反应的化学方程式:
______B+______NaOH+______NaNO3
 ______NaBO2+______NaNO2+______H2O
______NaBO2+______NaNO2+______H2O该反应中还原剂和还原产物的质量之比为
您最近一年使用:0次
解题方法
4 . 肼 常用作火箭的燃料,实验室模拟氨和次氯酸钠反应制备肼,装置如图,回答下列问题:
常用作火箭的燃料,实验室模拟氨和次氯酸钠反应制备肼,装置如图,回答下列问题: 中使用的浓氨水、
中使用的浓氨水、 属于电解质的是
属于电解质的是__________________ ,实验中装置B可能会发生倒吸,可使用如图中的__________________ (填标号)代替;__________________ 。
(3)装置C中制备肼的化学方程式为__________________ 。
(4)装置D中发生的反应中氧化剂和还原剂的物质的量之比为__________________ 。
(5)上述装置存在一处缺陷,会导致肼的产率降低,改进方法是__________________ 。
(6)如图是以氨为燃料的固体氧化物(含有 )燃料电池可为潜水艇提供动力。
)燃料电池可为潜水艇提供动力。__________________ 。
 常用作火箭的燃料,实验室模拟氨和次氯酸钠反应制备肼,装置如图,回答下列问题:
常用作火箭的燃料,实验室模拟氨和次氯酸钠反应制备肼,装置如图,回答下列问题: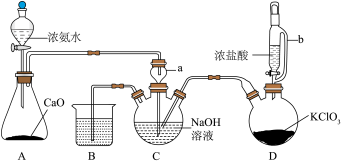
 中使用的浓氨水、
中使用的浓氨水、 属于电解质的是
属于电解质的是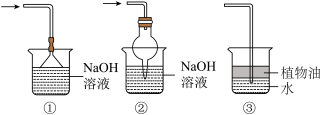
(3)装置C中制备肼的化学方程式为
(4)装置D中发生的反应中氧化剂和还原剂的物质的量之比为
(5)上述装置存在一处缺陷,会导致肼的产率降低,改进方法是
(6)如图是以氨为燃料的固体氧化物(含有
 )燃料电池可为潜水艇提供动力。
)燃料电池可为潜水艇提供动力。
您最近一年使用:0次
2023-07-12更新
|
358次组卷
|
3卷引用:山东省济宁市2022-2023学年高一下学期期末考试化学试题
山东省济宁市2022-2023学年高一下学期期末考试化学试题山东省济宁市2022-2023学年高一下学期期末考试化学试题(已下线)综合02 期末压轴80题之非选择题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)
5 . 亚硝酰氯(NOCl)是有机合成中的重要试剂,熔点为-64.5℃,沸点为-5.5℃,气态呈黄色,液态呈红褐色,遇水易反应生成一种氢化物和两种氮的常见氧化物。NOCl可由NO与Cl2反应制得,相关实验装置如图所示。

回答下列问题:
(1)仪器a的名称是_________ ;装置的连接顺序为A→_________ →D(装置可重复使用);实验开始时先通入干燥纯净的Cl2,当观察到三颈烧瓶中__________________ 时,关闭活塞b,再通入NO。
(2)装置A中发生反应的化学方程式为__________________ ;装置C的作用是__________________ ;装置D吸收NO尾气生成MnO2和 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为_________ 。
(3)取三颈烧瓶中所得产品mg溶于水,配成250mL溶液;取出25.00mL溶液,加入稀硝酸酸化后,与VmLcmol·L-1AgNO3溶液恰好完全反应(杂质不参与反应),则产品中NOCl的质量分数为_________ 。

回答下列问题:
(1)仪器a的名称是
(2)装置A中发生反应的化学方程式为
 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为(3)取三颈烧瓶中所得产品mg溶于水,配成250mL溶液;取出25.00mL溶液,加入稀硝酸酸化后,与VmLcmol·L-1AgNO3溶液恰好完全反应(杂质不参与反应),则产品中NOCl的质量分数为
您最近一年使用:0次
6 . 资源的综合利用越来越受到重视。科研人员综合利用软锰矿(含MnO2,少量SiO2、Al2O3)和闪锌矿(含ZnS,少量FeS、CuS、SiO2)制备ZnSO4∙7H2O、Zn和MnO2的工艺流程如下:
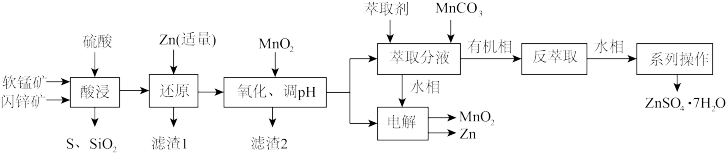
已知:25℃时相关物质的Ksp见下表。
(开始沉淀的金属离子浓度为1.0 mol∙L-1;金属离子浓度≤1.0×10-5 mol∙L-1时,可认为该离子沉淀完全。)
回答下列问题:
(1)“酸浸”时,MnO2和CuS反应生成MnSO4,氧化产物与还原产物物质的量之比为_______ 。
(2)加适量Zn还原的金属阳离子是_______ ,加MnO2氧化Fe2+生成滤渣的离子方程式为_______ ,调节pH的范围是_______ 。
(3)“萃取”过程中,发生如下阳离子交换反应: ,
, (HR代表有机萃取剂,易挥发)。加入MnCO3的作用为
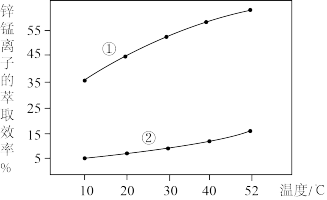
(HR代表有机萃取剂,易挥发)。加入MnCO3的作用为_______ 。实验测定锌锰离子的萃取率与温度的关系如图所示,表示Zn2+的萃取效率的曲线是_______ (填“①”“②”),萃取反应温度一般选择常温,理由为_______ 。
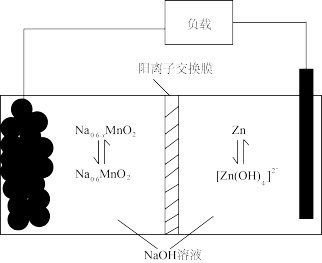
(4)“电解”产物可用于Na-Zn双离子电池中(装置如图)。电池工作时,正极上发生的电极反应为_______ ;每转移0.1mol电子,负极区电解质溶液质量增加_______ g。

已知:25℃时相关物质的Ksp见下表。
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
| Ksp |  | 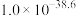 |  |  |  |
回答下列问题:
(1)“酸浸”时,MnO2和CuS反应生成MnSO4,氧化产物与还原产物物质的量之比为
(2)加适量Zn还原的金属阳离子是
(3)“萃取”过程中,发生如下阳离子交换反应:
 ,
, (HR代表有机萃取剂,易挥发)。加入MnCO3的作用为
(HR代表有机萃取剂,易挥发)。加入MnCO3的作用为
(4)“电解”产物可用于Na-Zn双离子电池中(装置如图)。电池工作时,正极上发生的电极反应为

您最近一年使用:0次
解题方法
7 . 铁、氯元素的单质及化合物与生产、生活密切相关,请回答下列问题。
(1)铁元素与人体健康密切相关,工业盐的主要成分是NaNO2,曾多次发生过因误食NaNO2而中毒的事件,原因是NaNO2把人体内血红蛋白中的Fe2+转化为Fe3+而失去与O2结合的能力。上述事实说明NaNO2具有_______ 性,工业盐中毒后,可服用维生素C来缓解中毒状况,说明维生素C具有_______ 性。
(2)含氯消毒剂在生产生活中有着广泛的用途。
①写出实验室实中用二氧化锰与浓盐酸制取氯气的离子方程式_______ ,在制备和收集氯气的实验过程中,下列选项正确的是_______ (填字母)。
a.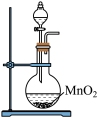 b.
b. 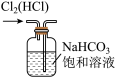 c.
c. 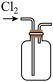 d.
d. 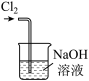
A.用装置a制取氯气 B.用装置b除去氯气中的少量氯化氢
C.用装置c收集氯气 D.用装置d吸收多余的氯气
②实验室也可以用高锰酸钾与浓盐酸制取氯气。已知KMnO4与浓盐酸反应的化学方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。0.1molKMnO4发生上述反应,消耗_______ molHCl,其中有_______ molHCl被氧化。分别利用二氧化锰和高锰酸钾制备等量的氯气,消耗HCl的物质的量之比为_______ 。
③实验室还可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若制取标准状况下6.72L氯气,反应过程中转移电子的数目为_______ 。
④氯气通入石灰乳中可以制得漂白粉,氯气被氧化得到的产物是_______ ,还原剂与氧化剂的质量之比为_______ 。某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO和NaClO3的混合溶液,经测定ClO-与 的个数比为1∶3,则被氧化与被还原的氯气物质的量之比为
的个数比为1∶3,则被氧化与被还原的氯气物质的量之比为_______ 。
(1)铁元素与人体健康密切相关,工业盐的主要成分是NaNO2,曾多次发生过因误食NaNO2而中毒的事件,原因是NaNO2把人体内血红蛋白中的Fe2+转化为Fe3+而失去与O2结合的能力。上述事实说明NaNO2具有
(2)含氯消毒剂在生产生活中有着广泛的用途。
①写出实验室实中用二氧化锰与浓盐酸制取氯气的离子方程式
a.
 b.
b.  c.
c.  d.
d. 
A.用装置a制取氯气 B.用装置b除去氯气中的少量氯化氢
C.用装置c收集氯气 D.用装置d吸收多余的氯气
②实验室也可以用高锰酸钾与浓盐酸制取氯气。已知KMnO4与浓盐酸反应的化学方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。0.1molKMnO4发生上述反应,消耗
③实验室还可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若制取标准状况下6.72L氯气,反应过程中转移电子的数目为
④氯气通入石灰乳中可以制得漂白粉,氯气被氧化得到的产物是
 的个数比为1∶3,则被氧化与被还原的氯气物质的量之比为
的个数比为1∶3,则被氧化与被还原的氯气物质的量之比为
您最近一年使用:0次
8 . 钼系催化剂主要用于石油炼制和化学工业中。从废催化剂(主要成分为MoS、V2O5和Al2O3)中提取比较贵重的金属钒和钼,工艺流程如下:
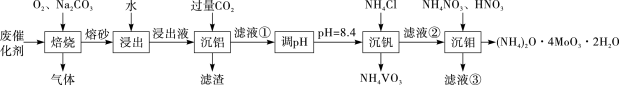
回答下列问题:
(1)“焙烧”时需对废催化剂进行粉碎,目的是_______ 。
(2)“焙烧”过程中MoS、V2O5和Al2O3均转化为对应的钠盐,写出MoS转化为Na2MoO4的化学方程式_______ 。
(3)“滤渣”的化学式为_______ 。滤液①的主要成分为Na2MoO4、_______ 。
(4)“沉钼”的离子方程式为_______ 。
(5)高温用 还原
还原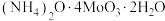 得金属钼,氧化剂与还原剂物质的量之比为
得金属钼,氧化剂与还原剂物质的量之比为_______ 。

回答下列问题:
(1)“焙烧”时需对废催化剂进行粉碎,目的是
(2)“焙烧”过程中MoS、V2O5和Al2O3均转化为对应的钠盐,写出MoS转化为Na2MoO4的化学方程式
(3)“滤渣”的化学式为
(4)“沉钼”的离子方程式为
(5)高温用
 还原
还原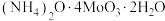 得金属钼,氧化剂与还原剂物质的量之比为
得金属钼,氧化剂与还原剂物质的量之比为
您最近一年使用:0次
2022-04-14更新
|
1667次组卷
|
4卷引用:山东省青岛市2021-2022学年高三下学期第一次模拟考试化学试题
山东省青岛市2021-2022学年高三下学期第一次模拟考试化学试题(已下线)微专题25 化学工艺流程题-----原料的预处理-备战2023年高考化学一轮复习考点微专题(已下线)微专题26 化学工艺流程题-----核心反应与条件控制-备战2023年高考化学一轮复习考点微专题辽宁省铁岭市六校协作体2022-2023学年高三上学期第一次联考化学试题
9 . 钼酸铵[(NH4)2MoO4]是生产高纯度钼制品、钼催化剂、钼颜料等的基本原料。一种以钼精矿(主要含MoS2,还含有少量SiO2、As、Sn、P、Cu、Pb、CaO)为原料制备钼酸铵的工艺流程如图所示:

已知:钼盐溶液中含钼物种之间的平衡关系为: 回答下列问题:
回答下列问题:
(1)(NH4)2MoO4中Mo元素的化合价为_______ 价。
(2)“氧化焙烧”时MoS2转化为MoO3,该反应中氧化剂与还原剂的物质的量之比为_______ ;气体A对环境的主要危害是_______ 。
(3)“除铜”时选择在60~80℃的条件下进行的原因为_______ 。
(4)“沉淀”过程中加入H2SO4调节溶液pH=2.1,则所得沉淀的化学式为_______ ,加入氨水后生成(NH4)2MoO4的化学方程式为_______ 。
(5)(NH4)6Mo7O24·4H2O的热重曲线如图所示:

已知A点失重的原因是生成H2O,则1 mol (NH4)6Mo7O24·4H2O在A点失去H2O的物质的量为_______ ,B点所得的物质为_______ (填化学式)。

已知:钼盐溶液中含钼物种之间的平衡关系为:
 回答下列问题:
回答下列问题:(1)(NH4)2MoO4中Mo元素的化合价为
(2)“氧化焙烧”时MoS2转化为MoO3,该反应中氧化剂与还原剂的物质的量之比为
(3)“除铜”时选择在60~80℃的条件下进行的原因为
(4)“沉淀”过程中加入H2SO4调节溶液pH=2.1,则所得沉淀的化学式为
(5)(NH4)6Mo7O24·4H2O的热重曲线如图所示:

已知A点失重的原因是生成H2O,则1 mol (NH4)6Mo7O24·4H2O在A点失去H2O的物质的量为
您最近一年使用:0次
2022-03-02更新
|
480次组卷
|
3卷引用:山东省菏泽市单县第二中学2022-2023学年高三下学期开学第一次模拟考试化学试题
山东省菏泽市单县第二中学2022-2023学年高三下学期开学第一次模拟考试化学试题广东省茂名市五校联盟2021-2022学年高三下学期第三次联考化学试卷(已下线)二轮专题强化练 大题突破3 无机化工流程题题型研究
名校
解题方法
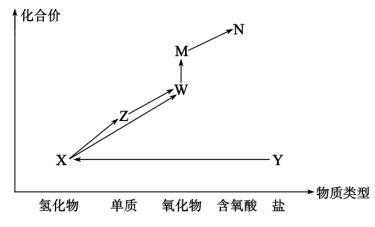
10 . “价一类”二维图是研究物质性质的重要手段,下图是某常见元素的“价—类”二维图,已知Y中加入NaOH溶液,加热可生成X。据此回答下列问题:
(1)实验室制取X的化学方程式为_______ ,其对应的制备装置为_______ 。
A.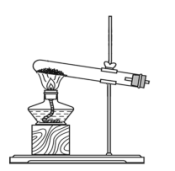 B.
B. C.
C.
(2)下列试剂能用于干燥X的是___________。
(3)X→W反应中,氧化剂与还原剂的物质的量之比为___________ 。
(4)利用如图装置探究不同浓度的N溶液与金属反应的还原产物。
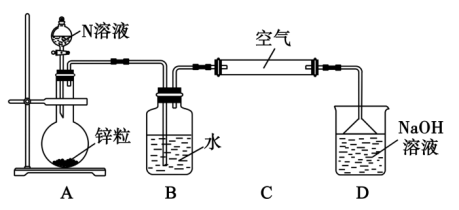
实验一:若N浓度为 时,其还原产物主要是M,则装置B中发生反应的化学方程式为
时,其还原产物主要是M,则装置B中发生反应的化学方程式为_____ 。
实验二:若N浓度为 时,其还原产物主要是W,则实验中能证明还原产物主要是W的现象是
时,其还原产物主要是W,则实验中能证明还原产物主要是W的现象是_______ 。
实验三:若N浓度为 时,过量锌粉与N反应产生H2,充分反应后所得溶液几乎无色。取装置A中上层清液,加入过量NaOH溶液并煮沸,产生的气体能使湿润的红色石蕊试纸变蓝。则装置A中发生反应的离子方程式有:①
时,过量锌粉与N反应产生H2,充分反应后所得溶液几乎无色。取装置A中上层清液,加入过量NaOH溶液并煮沸,产生的气体能使湿润的红色石蕊试纸变蓝。则装置A中发生反应的离子方程式有:①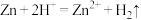 ;②
;②______ 。

(1)实验室制取X的化学方程式为
A.
 B.
B. C.
C.
(2)下列试剂能用于干燥X的是___________。
| A.无水氯化钙 | B.碱石灰 | C.氢氧化钠固体 | D.浓硫酸 |
(4)利用如图装置探究不同浓度的N溶液与金属反应的还原产物。

实验一:若N浓度为
 时,其还原产物主要是M,则装置B中发生反应的化学方程式为
时,其还原产物主要是M,则装置B中发生反应的化学方程式为实验二:若N浓度为
 时,其还原产物主要是W,则实验中能证明还原产物主要是W的现象是
时,其还原产物主要是W,则实验中能证明还原产物主要是W的现象是实验三:若N浓度为
 时,过量锌粉与N反应产生H2,充分反应后所得溶液几乎无色。取装置A中上层清液,加入过量NaOH溶液并煮沸,产生的气体能使湿润的红色石蕊试纸变蓝。则装置A中发生反应的离子方程式有:①
时,过量锌粉与N反应产生H2,充分反应后所得溶液几乎无色。取装置A中上层清液,加入过量NaOH溶液并煮沸,产生的气体能使湿润的红色石蕊试纸变蓝。则装置A中发生反应的离子方程式有:①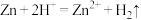 ;②
;②
您最近一年使用:0次
2022-02-20更新
|
587次组卷
|
3卷引用:山东省德州市2021-2022学年高一上学期期末考试化学试题
山东省德州市2021-2022学年高一上学期期末考试化学试题山东省枣庄滕州第第一中学2022-2023学年高一上学期期中(线上)考试化学试题(已下线)【期末复习】必刷题(1)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)



