资源的综合利用越来越受到重视。科研人员综合利用软锰矿(含MnO2,少量SiO2、Al2O3)和闪锌矿(含ZnS,少量FeS、CuS、SiO2)制备ZnSO4∙7H2O、Zn和MnO2的工艺流程如下:
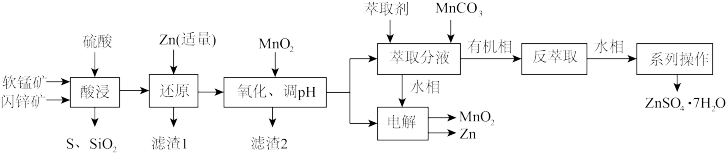
已知:25℃时相关物质的Ksp见下表。
(开始沉淀的金属离子浓度为1.0 mol∙L-1;金属离子浓度≤1.0×10-5 mol∙L-1时,可认为该离子沉淀完全。)
回答下列问题:
(1)“酸浸”时,MnO2和CuS反应生成MnSO4,氧化产物与还原产物物质的量之比为_______ 。
(2)加适量Zn还原的金属阳离子是_______ ,加MnO2氧化Fe2+生成滤渣的离子方程式为_______ ,调节pH的范围是_______ 。
(3)“萃取”过程中,发生如下阳离子交换反应: ,
, (HR代表有机萃取剂,易挥发)。加入MnCO3的作用为
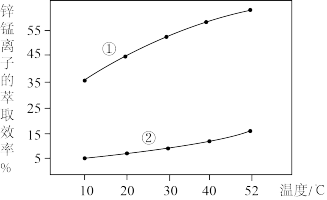
(HR代表有机萃取剂,易挥发)。加入MnCO3的作用为_______ 。实验测定锌锰离子的萃取率与温度的关系如图所示,表示Zn2+的萃取效率的曲线是_______ (填“①”“②”),萃取反应温度一般选择常温,理由为_______ 。
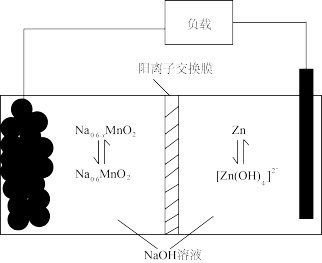
(4)“电解”产物可用于Na-Zn双离子电池中(装置如图)。电池工作时,正极上发生的电极反应为_______ ;每转移0.1mol电子,负极区电解质溶液质量增加_______ g。

已知:25℃时相关物质的Ksp见下表。
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
| Ksp |  | 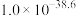 |  |  |  |
回答下列问题:
(1)“酸浸”时,MnO2和CuS反应生成MnSO4,氧化产物与还原产物物质的量之比为
(2)加适量Zn还原的金属阳离子是
(3)“萃取”过程中,发生如下阳离子交换反应:
 ,
, (HR代表有机萃取剂,易挥发)。加入MnCO3的作用为
(HR代表有机萃取剂,易挥发)。加入MnCO3的作用为
(4)“电解”产物可用于Na-Zn双离子电池中(装置如图)。电池工作时,正极上发生的电极反应为

更新时间:2023-05-21 17:27:50
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
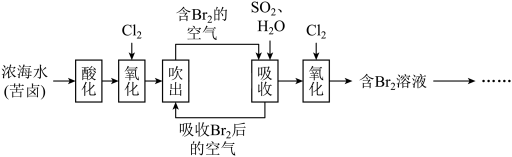
【推荐1】已知海水中溴元素主要以Br形式存在,工业上从海水中提取溴的流程如下:____________ 。
(2)将吹出后的含Br的空气按一定速率通入吸收塔,用SO2和水进行吸收,吸收后的空气进行循环利用。
①写出吸收反应的离子方程式:_____________ 。
②吹出时,Br2吹出率与吸收塔中SO2流量的关系如图所示。如果SO2流量过大,Br2吹出率反而下降,原因是____________ 。
(4)工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,根据下列提示写出化学方程式:_________ 。
_________Br2+__________Na2CO3=__________NaBrO3+___________CO2+__________
当有1.204×1024个电子发生转移时,理论上参加反应Br2的质量为________ 。
(2)将吹出后的含Br的空气按一定速率通入吸收塔,用SO2和水进行吸收,吸收后的空气进行循环利用。
①写出吸收反应的离子方程式:
②吹出时,Br2吹出率与吸收塔中SO2流量的关系如图所示。如果SO2流量过大,Br2吹出率反而下降,原因是

| A.NaOH | B.FeCl2 | C.Na2SO3 | D.H2O |
(4)工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,根据下列提示写出化学方程式:
_________Br2+__________Na2CO3=__________NaBrO3+___________CO2+__________
当有1.204×1024个电子发生转移时,理论上参加反应Br2的质量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】实验室制取Cl2并用Cl2与铜粉反应,制取并收集产物。根据下图回答问题:

(1)写出装置A中发生反应的化学方程式___________ 。
(2)B中最适宜选用的试剂:___________ 。
(3)D中的现象是___________ ;D与E间最好选用粗而短的导管的原因:___________ 。
(4)装置A中若有0.2 mol HCl参加反应,则被氧化的HCl为___________ mol。
(5)若E中盛装蒸馏水,装置F的作用:___________ ;反应的化学方程式为___________ 。
(6)若装置E中装入足量NaOH溶液,则E中的现象:___________ 。反应的离子方程式___________ 。
(7)若无D装置且E中盛有KI -淀粉的混合溶液,E中的现象:___________ ,反应的离子方程式___________ 。

(1)写出装置A中发生反应的化学方程式
(2)B中最适宜选用的试剂:
(3)D中的现象是
(4)装置A中若有0.2 mol HCl参加反应,则被氧化的HCl为
(5)若E中盛装蒸馏水,装置F的作用:
(6)若装置E中装入足量NaOH溶液,则E中的现象:
(7)若无D装置且E中盛有KI -淀粉的混合溶液,E中的现象:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】四川含有非常丰富的矿产资源。以川西铝土矿(主要成分为Al2O3、Fe2O3、SiO2、少量FeS2)为原料,生产Fe3O4的部分工艺流程如下:
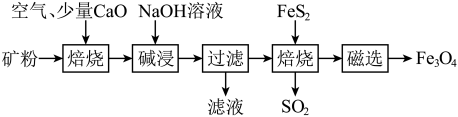
(1)Fe3O4_____ (填“属于”或“不属于”)碱性氧化物。
(2)已知上述流程中两次焙烧均会产生SO2,滤渣中含大量的Fe2O3。
①矿粉焙烧过程中还原剂和氧化剂物质的量之比为_____ ,过程加入少量CaO的目的是_____ ,用NaOH溶液吸收SO2离子方程式为________________
②“过滤”得到的滤液中含有的阴离子有OH-、___________ 。
③Fe2O3与FeS2混合后焙烧(缺氧条件下)反应的化学方程式为_________________ 。

(1)Fe3O4
(2)已知上述流程中两次焙烧均会产生SO2,滤渣中含大量的Fe2O3。
①矿粉焙烧过程中还原剂和氧化剂物质的量之比为
②“过滤”得到的滤液中含有的阴离子有OH-、
③Fe2O3与FeS2混合后焙烧(缺氧条件下)反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】Ⅰ.有一学生在实验室测某溶液的pH,实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
(1)该学生的操作___ (填“正确”或“错误”),其理由是___________ ;
(2)该操作是否一定有误差?______________________ ;
(3)若用此方法分别测定c(OH-)相等的氢氧化钠溶液和氨水的pH,误差较大的是____ ,原因是___ ;
(4)只从下列试剂中选择实验所需的试剂,你能否区分0.1mol·L-1硫酸溶液和0.01mol·L-1硫酸溶液?____ ,简述操作过程:____________________________ 。
试剂:A.紫色石蕊溶液 B.酚酞溶液 C.甲基橙溶液 D.蒸馏水 E.氯化钡溶液 F.pH试纸
Ⅱ.pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图所示。

回答下列问题:
(1)若a=5,则A为___ 酸,B为___ 酸(填“强”或“弱”),若再稀释100倍,则A的pH___ 7(填“<”“>”或“=”)。
(2)若A、B都是弱酸,则a的范围是___ 。
(1)该学生的操作
(2)该操作是否一定有误差?
(3)若用此方法分别测定c(OH-)相等的氢氧化钠溶液和氨水的pH,误差较大的是
(4)只从下列试剂中选择实验所需的试剂,你能否区分0.1mol·L-1硫酸溶液和0.01mol·L-1硫酸溶液?
试剂:A.紫色石蕊溶液 B.酚酞溶液 C.甲基橙溶液 D.蒸馏水 E.氯化钡溶液 F.pH试纸
Ⅱ.pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图所示。

回答下列问题:
(1)若a=5,则A为
(2)若A、B都是弱酸,则a的范围是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】工业上可由氢气、氮气合成氨气,溶于水形成氨水。一定温度下,向2L固定体积的密闭容器中加入N2(g)和H2(g),发生反应:N2(g)+3H2(g) 2NH3(g)+Q(Q>0),NH3物质的量随时间的变化如图所示。
2NH3(g)+Q(Q>0),NH3物质的量随时间的变化如图所示。

(1)0~2min内的平均反应速率v(H2)=___ 。
(2)该温度下,反应的平衡常数表达式K=___ 。
其平衡常数K与温度T的关系如下表:
试判断K1___ K2(填写“>”、“=”或“<”)。
(3)能说明该合成氨反应已达到平衡状态的是___ (选填编号)。
a.3v(N2)=v(H2)
b.容器内压强保持不变
c.混合气体的密度保持不变
d.25℃时,测得容器中c(NH3)=0.2mol·L-1,c(H2)=c(N2)=0.01mol·L-1
常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如表。
请回答:
(4)①中所得混合溶液,pH___ 7(填“>”、“<”或“=”);②中c__ 0.2(填“>”、“<”或“=”),所得混合溶液中各离子浓度大小关系为___ 。
(5)请你设计一个能证明一水合氨是弱电解质的简要方案___ 。
 2NH3(g)+Q(Q>0),NH3物质的量随时间的变化如图所示。
2NH3(g)+Q(Q>0),NH3物质的量随时间的变化如图所示。
(1)0~2min内的平均反应速率v(H2)=
(2)该温度下,反应的平衡常数表达式K=
其平衡常数K与温度T的关系如下表:
| T/℃ | 25 | 125 | 225 |
| 平衡常数K | 4×106 | K1 | K2 |
(3)能说明该合成氨反应已达到平衡状态的是
a.3v(N2)=v(H2)
b.容器内压强保持不变
c.混合气体的密度保持不变
d.25℃时,测得容器中c(NH3)=0.2mol·L-1,c(H2)=c(N2)=0.01mol·L-1
常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如表。
实验编号 | 氨水浓度/mol·L-1 | 盐酸浓度/mol·L-1 | 混合溶液pH |
① | 0. 2 | 0.2 | pH=x |
② | c | 0.2 | pH=7 |
(4)①中所得混合溶液,pH
(5)请你设计一个能证明一水合氨是弱电解质的简要方案
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】六偏磷酸钠[(NaPO3)6]是偏磷酸钠(NaPO3)的一种聚合体,其主要用于水处理、造纸、食品行业。工业上由白磷(P4:易自燃,熔点44℃,沸点280℃,有剧毒,保存在冷水中)制备六偏磷酸钠的方法如下:

(1)“炉渣”的主要成分是___________ (写化学式),该过程中氧化剂与还原剂的物质的量之比是_______________ 。
(2)从混合气体中分离得到P4的最佳方法是_________________ 。
(3)经分析“滤渣”是由白磷中的Pb、As杂质元素所形成的两种盐类,其中一种是Pb3(PO4)2,则另一种是_______________ (写化学式)。
(4)若直接将白磷与足量浓NaOH溶液直接混合加热,则得到的是次磷酸钠(NaH2PO2),但同时会得到一种剧毒气体。写出该化学方程式____________________ 。
(5)已知磷酸中含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液pH的关系如图所示,则“中和”过程中应加入NaOH调节溶液的pH为________________ 。若pH过低,则造成的结果是_________________ 。

(6)经定量分析,每100.00g产品的有效磷(以P2O5计)含量是66.50g (其它杂质为非磷酸盐成分),则该产品的纯度是__________________ 。(已知:NaPO3的相对分子质量为M1,P2O5的相对分子质量为M2,结果不必化简,列出计算式即可)

(1)“炉渣”的主要成分是
(2)从混合气体中分离得到P4的最佳方法是
(3)经分析“滤渣”是由白磷中的Pb、As杂质元素所形成的两种盐类,其中一种是Pb3(PO4)2,则另一种是
(4)若直接将白磷与足量浓NaOH溶液直接混合加热,则得到的是次磷酸钠(NaH2PO2),但同时会得到一种剧毒气体。写出该化学方程式
(5)已知磷酸中含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液pH的关系如图所示,则“中和”过程中应加入NaOH调节溶液的pH为

(6)经定量分析,每100.00g产品的有效磷(以P2O5计)含量是66.50g (其它杂质为非磷酸盐成分),则该产品的纯度是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】能源的开发利用与人类社会的可持续发展息息相关。
(1)已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)ΔH1=a kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH2=b kJ·mol-1
O2(g)=CO2(g) ΔH2=b kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH3=c kJ·mol-1
则C的燃烧热ΔH=_______ kJ·mol-1。
(2)①依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是_______ (填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)=2H2(g)+O2(g)
D.2CO(g)+O2(g)=2CO2(g)
②若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:_______ 。
(3)某实验小组模拟工业合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中
2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中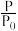 与时间t的关系如图所示。
与时间t的关系如图所示。
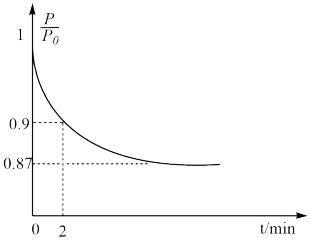
请回答下列问题:
①反应达平衡的标志是_______ (填字母代号,下同)。
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②0~2 min内,以c(N2)变化表示的平均反应速率为_______ 。
③欲提高N2的转化率,可采取的措施有_______ 。
A.向体系中按体积比1∶1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入氦气使压强增大
E.加入一定量的N2
(4)25℃时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c( )=0.2 mol·L-1,如果加入等体积的Na2SO4溶液,若要产生BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是
)=0.2 mol·L-1,如果加入等体积的Na2SO4溶液,若要产生BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是_______ mol·L-1。
(1)已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)ΔH1=a kJ·mol-1
CO(g)+
 O2(g)=CO2(g) ΔH2=b kJ·mol-1
O2(g)=CO2(g) ΔH2=b kJ·mol-14Fe(s)+3O2(g)=2Fe2O3(s) ΔH3=c kJ·mol-1
则C的燃烧热ΔH=
(2)①依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)=2H2(g)+O2(g)
D.2CO(g)+O2(g)=2CO2(g)
②若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:
(3)某实验小组模拟工业合成氨反应N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中
2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中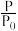 与时间t的关系如图所示。
与时间t的关系如图所示。
请回答下列问题:
①反应达平衡的标志是
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②0~2 min内,以c(N2)变化表示的平均反应速率为
③欲提高N2的转化率,可采取的措施有
A.向体系中按体积比1∶1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入氦气使压强增大
E.加入一定量的N2
(4)25℃时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(
 )=0.2 mol·L-1,如果加入等体积的Na2SO4溶液,若要产生BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是
)=0.2 mol·L-1,如果加入等体积的Na2SO4溶液,若要产生BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】硫酸铅是一种重要的化工粉末材料,被广泛用于涂料和电池等行业。湿化学法从方铅矿(主要成分为 )直接制取硫酸铅粉末的转化流程图如下:
)直接制取硫酸铅粉末的转化流程图如下:

已知:①
②

回答下列问题:
(1)浸出过程中,产物中 以
以 形式存在,同时可观察到黄色沉淀,浸出过程中的反应的离子方程式为
形式存在,同时可观察到黄色沉淀,浸出过程中的反应的离子方程式为________________ 。反应后期,有少量气体产生,产生气体的化学方程式为________________ 。
(2)浓缩结晶过程中是将浸出液静置于冰水混合物中,从平衡角度解释使用冰水混合物的作用为________ 。
(3)氧化过程中通常加入 ,发生反应的离子方程式为
,发生反应的离子方程式为__________ 。
(4)向 固体中加入
固体中加入 ,发生反应的方程式为
,发生反应的方程式为
 ,计算该反应的平衡常数为
,计算该反应的平衡常数为________ 。
(5)单位体积溶液中加入 的质量对方铅矿的浸出率的影响如图,高于
的质量对方铅矿的浸出率的影响如图,高于 之后,浸出率基本不变,可能的原因是
之后,浸出率基本不变,可能的原因是_____________ 。

(6)传统工艺是经火法冶炼得到粗铅,然后电解精炼,再经高温熔融、氧化焙烧制取氧化铅,然后与硫酸反应制得硫酸铅。与传统工艺相比,湿化学法的优点是________ (任写两点)。
 )直接制取硫酸铅粉末的转化流程图如下:
)直接制取硫酸铅粉末的转化流程图如下:
已知:①

②


回答下列问题:
(1)浸出过程中,产物中
 以
以 形式存在,同时可观察到黄色沉淀,浸出过程中的反应的离子方程式为
形式存在,同时可观察到黄色沉淀,浸出过程中的反应的离子方程式为(2)浓缩结晶过程中是将浸出液静置于冰水混合物中,从平衡角度解释使用冰水混合物的作用为
(3)氧化过程中通常加入
 ,发生反应的离子方程式为
,发生反应的离子方程式为(4)向
 固体中加入
固体中加入 ,发生反应的方程式为
,发生反应的方程式为
 ,计算该反应的平衡常数为
,计算该反应的平衡常数为(5)单位体积溶液中加入
 的质量对方铅矿的浸出率的影响如图,高于
的质量对方铅矿的浸出率的影响如图,高于 之后,浸出率基本不变,可能的原因是
之后,浸出率基本不变,可能的原因是
(6)传统工艺是经火法冶炼得到粗铅,然后电解精炼,再经高温熔融、氧化焙烧制取氧化铅,然后与硫酸反应制得硫酸铅。与传统工艺相比,湿化学法的优点是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】三盐基硫酸铅(3PbO·PbSO4·H2O)简称三盐,不溶于水及有机溶剂,可用作聚氯乙烯的热稳定剂。以100.0 t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。

请回答下列问题:
(1)步骤①过程中PbSO4能够转化为PbCO3,过滤得到的滤液1能用来回收Na2SO4·10H2O,提取该晶体的主要步骤有________ 、________ 、过滤、洗涤、干燥。
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是____________________ (任写一条)。其中铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为____________ 。
(3)滤液2中可循环利用的溶质为______________________ (填化学式)。若步骤④沉铅后的滤液中c(Pb2+)=1.82×10−5mol ·L−1,则此时c( )
)________ mol·L−1。[已知Ksp(PbSO4)= 1.82×l0−8]
(4)步骤⑥合成三盐的化学方程式为______________ 。若得到纯净干燥的三盐49.5 t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为__________ (保留两位有效数字)。

请回答下列问题:
(1)步骤①过程中PbSO4能够转化为PbCO3,过滤得到的滤液1能用来回收Na2SO4·10H2O,提取该晶体的主要步骤有
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是
(3)滤液2中可循环利用的溶质为
 )
)(4)步骤⑥合成三盐的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】X、Y、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素,在周期表的短周期主族元素中,X的原子半径最小,X与R的最外层电子数相等;Y的内层电子数是最外层电子数的一半;U的最高化合价和最低化合价的代数和为6;Z和Q形成原子个数之比为1:2的气态化合物的颜色是红棕色;R和Q可形成原子个数之比为1:1和2:1的两种化合物;R、T、U三者的最高价氧化物对应的水化物两两之间能发生化学反应。
请回答下列问题:
(1)T元素在周期表中的位置是_______ 。
(2)X、Y、Q三种元素的原子半径由小到大的顺序为_______ (填元素符号)。
(3)T、U两元素最高价氧化物对应的水化物反应的离子方程式为_______ 。
(4)下列可以判断R和T的金属性强弱的是
(5)某同学用X、R两元素的单质反应生成固体物质RX,RX属于离子化合物,且能与化合物X2Q反应生成的单质。
①RX的电子式为_______ ;RX与X2Q反应的化学方程式为_______ 。
②该用电子式表示RX的形成过程:_______ 。
(6)R2Q2的化学式是_______ ,所含有的化学键类型为_______ ,它与水反应的离子方程式为_______ 。
(7)Z元素对应的最高价氧化物对应的水化物的化学式是_______ ,X与Z元素形成的化合物Z2X4的电子式是_______ ,化合物类型是_______ 。(填“离子化合物”或“共价化合物”)
(8)纳米级Cu2O由于具有优良的催化性能而受到关注,采用Z2X4燃料电池作为制备电源,其装置如图,燃料电池中,A电极是_______ (填“正”或“负”)极,A极发生的电极反应为_______ 。

请回答下列问题:
(1)T元素在周期表中的位置是
(2)X、Y、Q三种元素的原子半径由小到大的顺序为
(3)T、U两元素最高价氧化物对应的水化物反应的离子方程式为
(4)下列可以判断R和T的金属性强弱的是
| A.单质的熔点:R比T低 |
| B.单质与酸反应时,失电子数:R比T少 |
| C.单质与水反应:R比T剧烈 |
| D.最高价氧化物对应水化物的碱性:R比T强 |
①RX的电子式为
②该用电子式表示RX的形成过程:
(6)R2Q2的化学式是
(7)Z元素对应的最高价氧化物对应的水化物的化学式是
(8)纳米级Cu2O由于具有优良的催化性能而受到关注,采用Z2X4燃料电池作为制备电源,其装置如图,燃料电池中,A电极是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:

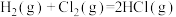


(1) 与
与 反应生成气态水的热化学方程式是
反应生成气态水的热化学方程式是____________________ 。
(2)断开 H—O键所需能量为
H—O键所需能量为______  。
。
Ⅱ. 可转化为
可转化为 ,
, 在空气中加热反应可制得铁系氧化物材料。
在空气中加热反应可制得铁系氧化物材料。
已知 ,
, 时:
时:






 在空气中加热反应生成
在空气中加热反应生成 的热化学方程式是
的热化学方程式是____________________ 。
Ⅲ.由 和
和 反应生成
反应生成 和
和 的能量变化如图所示,若生成
的能量变化如图所示,若生成
 ,其
,其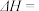
______  。
。

Ⅳ. 在一定条件下可制得
在一定条件下可制得 (二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为
(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为 ,正极反应式
,正极反应式____________________ 。
已知:


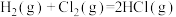


(1)
 与
与 反应生成气态水的热化学方程式是
反应生成气态水的热化学方程式是(2)断开
 H—O键所需能量为
H—O键所需能量为 。
。Ⅱ.
 可转化为
可转化为 ,
, 在空气中加热反应可制得铁系氧化物材料。
在空气中加热反应可制得铁系氧化物材料。已知
 ,
, 时:
时:





 在空气中加热反应生成
在空气中加热反应生成 的热化学方程式是
的热化学方程式是Ⅲ.由
 和
和 反应生成
反应生成 和
和 的能量变化如图所示,若生成
的能量变化如图所示,若生成
 ,其
,其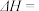
 。
。
Ⅳ.
 在一定条件下可制得
在一定条件下可制得 (二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为
(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为 ,正极反应式
,正极反应式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某化学小组对FeCl3与NaHSO3反应进行探究。
(1)NaHSO3溶液中除水的电离平衡外,还存在另外一个电离平衡,写出其离子方程式_______ 。
(2)配制氯化铁溶液时,先将氯化铁固体溶于_______ ,再稀释到所需的浓度。
(3)该小组同学预测:向FeCl3溶液滴加NaHSO3溶液时,溶液颜色由棕黄色变成浅绿色。他们预测的理论依据为_______ 。
(4)向2mL1mol/LNaHSO3溶液中逐滴加入0.5mL1mol/L的FeCl3溶液,具体操作与实验现象见下表。
①小组同学认为刺激性气味气体的产生原因有两种可能,其中一个为H++HSO =SO2↑+H2O,用离子方程式表示另一个可能的原因
=SO2↑+H2O,用离子方程式表示另一个可能的原因_______ 。
②查阅资料:溶液中Fe3+、SO 、OH-三种微粒会形成红色配合物并存在如下转化:
、OH-三种微粒会形成红色配合物并存在如下转化:
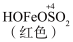


 Fe2++SO
Fe2++SO
用化学平衡移动原理解释1~30min内溶液颜色变化的原因_______ 。
(5)实验小组又通过原电池实验探究FeCl3溶液与Na2SO3溶液的反应。
①用离子方程式表示Na2SO3溶液呈碱性的原因_______ 。
②探究上述实验中的电极产物,取少量Y电极附近的溶液,加入_______ ,产生白色沉淀,证明产生了SO 。
。
③正极的电极反应式为_______ 。
(1)NaHSO3溶液中除水的电离平衡外,还存在另外一个电离平衡,写出其离子方程式
(2)配制氯化铁溶液时,先将氯化铁固体溶于
(3)该小组同学预测:向FeCl3溶液滴加NaHSO3溶液时,溶液颜色由棕黄色变成浅绿色。他们预测的理论依据为
(4)向2mL1mol/LNaHSO3溶液中逐滴加入0.5mL1mol/L的FeCl3溶液,具体操作与实验现象见下表。
| 装置 | 反应时间 | 实验现象 |
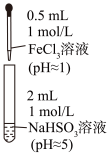 | 0~1min | 产生红褐色沉淀,有刺激性气味气体逸出 |
| 1~30min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 | |
| 30min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
 =SO2↑+H2O,用离子方程式表示另一个可能的原因
=SO2↑+H2O,用离子方程式表示另一个可能的原因②查阅资料:溶液中Fe3+、SO
 、OH-三种微粒会形成红色配合物并存在如下转化:
、OH-三种微粒会形成红色配合物并存在如下转化: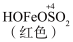


 Fe2++SO
Fe2++SO
用化学平衡移动原理解释1~30min内溶液颜色变化的原因
(5)实验小组又通过原电池实验探究FeCl3溶液与Na2SO3溶液的反应。
| 装置 | 实验现象 |
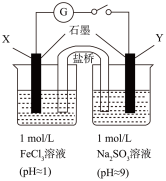 | 闭合开关后灵敏电流计指针发生偏转 |
②探究上述实验中的电极产物,取少量Y电极附近的溶液,加入
 。
。③正极的电极反应式为
您最近一年使用:0次



