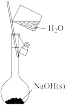名校
1 . 每年10月23日上午6:02到晚上6:02被誉为“摩尔日”(MoleDay),这个时间的一种写法为6:0210/23,形式与阿伏加德罗常数近似值 相似.设
相似.设 为阿伏加德罗常数,下列说法正确的是
为阿伏加德罗常数,下列说法正确的是
 相似.设
相似.设 为阿伏加德罗常数,下列说法正确的是
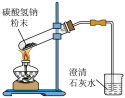
为阿伏加德罗常数,下列说法正确的是A. 中阴离子的数目为 中阴离子的数目为 |
B. 与足量的水反应,转移电子的数目为 与足量的水反应,转移电子的数目为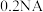 |
C. 和 和 在点燃条件下反应时转移电子数目为 在点燃条件下反应时转移电子数目为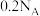 |
D. 的浓盐酸与足量的 的浓盐酸与足量的 加热充分反应,产生 加热充分反应,产生 的数目等于 的数目等于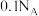 |
您最近一年使用:0次
名校
解题方法
2 . 氨氮废水是造成水体富营养化的原因之一,下图为处理氨氮废水的流程。错误 的是

A.过程①: |
B.过程②总反应式: |
C.过程③: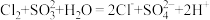 |
D. 溶于水: 溶于水: |
您最近一年使用:0次
2024-03-06更新
|
1054次组卷
|
5卷引用:广东省广州市黄广中学2023-2024学年高一下学期3月月考化学试题
广东省广州市黄广中学2023-2024学年高一下学期3月月考化学试题福建省泉州市2024届高三下学期高中毕业班质量监测(三)化学试卷云南省云南师范大学实验中学2023-2024学年高一下学期三月月考化学试题(已下线)通关练01 化学基本概念再回归-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)压轴题01?离子方程式与离子共存的判断(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
名校
解题方法
3 . 微观探析是认识物质的一种途径。设 为阿伏加德罗常数,下列有关说法正确的是
为阿伏加德罗常数,下列有关说法正确的是
 为阿伏加德罗常数,下列有关说法正确的是
为阿伏加德罗常数,下列有关说法正确的是A.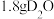 中含有的中子数目为 中含有的中子数目为 |
B.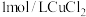 溶液中含有 溶液中含有 的数目小于 的数目小于 |
C.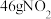 与 与 的混合物中含有的分子数为 的混合物中含有的分子数为 |
D.25℃,101kPa, 与NaOH溶液完全反应,转移电子数目为 与NaOH溶液完全反应,转移电子数目为 |
您最近一年使用:0次
2024-03-06更新
|
886次组卷
|
4卷引用:2024届广东省汕头市高三下学期一模化学试题
名校
4 . 氯碱工业涉及Cl2、H2、NaOH、NaClO等物质。设NA为阿伏加德罗常数的值,下列说法错误的是
| A.1 mol NaOH固体中的离子数目为2NA |
| B.1 L1mol/L的NaClO溶液中,ClO-的数目小于NA |
| C.标况下,22.4L的H2和Cl2混合气体,共价键数目为NA |
| D.1 mol Cl2与足量NaOH溶液反应生成NaClO转移电子数为2NA |
您最近一年使用:0次
2024-03-04更新
|
627次组卷
|
3卷引用:广东省佛山市2024届高三教学质量检测(一)化学试题
名校
解题方法
5 . 氯化亚砜(SOCl2),是一种无色或淡黄色发烟液体,有强烈刺激性气味,其熔点-105℃,沸点79℃,140℃以上时易分解,遇水剧烈反应,常用作脱水剂。某实验小组设计实验制备氯化亚砜并探究其性质。
【资料】①实验室制备原理:在活性炭催化下,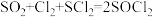
② 。
。
③SCl2是一种重要的化工试剂,遇水易分解。
实验一:制备产品并探究SOCl2的性质
根据下图所示装置设计实验(装置可以重复使用)。_______
a→___________→d、e→___________→h。
(2)实验室用亚硫酸钠固体与70%硫酸制备SO2,不用稀硫酸的原因为___________ 。
(3)A装置中发生反应的离子方程式为___________ 。
(4)SOCl2水解后无残留物,是常用的脱水剂。乙同学设计实验利用SOCl2和ZnCl2·xH2O制取无水ZnCl2。
①解释SOCl2在该实验中的作用有___________ 。
②实验室常用NaOH溶液吸收SOCl2,该反应的离子方程式是___________ 。
(5)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使产品不纯,理由是___________ 。
实验二:测定产品纯度。
利用下图装置测定产品纯度。
(6)VmL产品中含___________ mol SOCl2。(列计算式)
【资料】①实验室制备原理:在活性炭催化下,
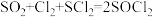
②
 。
。③SCl2是一种重要的化工试剂,遇水易分解。
实验一:制备产品并探究SOCl2的性质
根据下图所示装置设计实验(装置可以重复使用)。
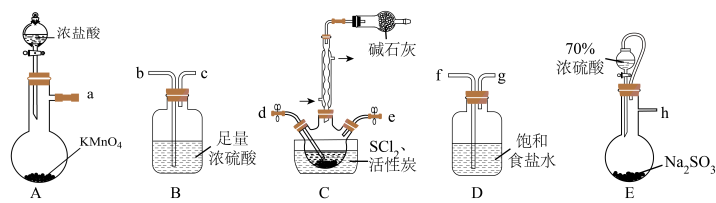
a→___________→d、e→___________→h。
(2)实验室用亚硫酸钠固体与70%硫酸制备SO2,不用稀硫酸的原因为
(3)A装置中发生反应的离子方程式为
(4)SOCl2水解后无残留物,是常用的脱水剂。乙同学设计实验利用SOCl2和ZnCl2·xH2O制取无水ZnCl2。
①解释SOCl2在该实验中的作用有
②实验室常用NaOH溶液吸收SOCl2,该反应的离子方程式是
(5)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使产品不纯,理由是
实验二:测定产品纯度。
利用下图装置测定产品纯度。

(6)VmL产品中含
您最近一年使用:0次
名校
解题方法
6 . 下列气体制备所选用的发生装置不正确的是


A.①用乙醇与浓硫酸制取 | B.②用铜丝与浓硝酸制取 |
C.③用二氧化锰与浓盐酸制取 | D.④用电石与饱和食盐水制取 |
您最近一年使用:0次
2024-02-24更新
|
492次组卷
|
2卷引用:广东省东莞中学、广州二中、惠州一中等六校联考2023-2024学年高三下学期(第六次)开学化学试题
7 . 磺酰氯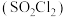 是重要的有机合成试剂,实验室可利用
是重要的有机合成试剂,实验室可利用 与
与 在活性炭作用下反应制取少量
在活性炭作用下反应制取少量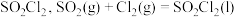 ,该反应放热,装置如图所示(部分夹持装置省略)。已知
,该反应放热,装置如图所示(部分夹持装置省略)。已知 的熔点为
的熔点为 ,沸点为
,沸点为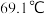 ,遇水能发生剧烈的水解反应,并产生白雾。
,遇水能发生剧烈的水解反应,并产生白雾。
回答下列问题。 ,则下列试剂组合中合适的是___________。
,则下列试剂组合中合适的是___________。
(2)导管a的作用是___________ ;仪器b中的试剂是___________ 。
(3)实验结束时,关闭分液漏斗活塞和止水夹k,此时装置戊的作用是___________ 。
(4) 遇水发生反应生成两种酸,该反应的化学方程式为
遇水发生反应生成两种酸,该反应的化学方程式为___________ 。
(5)若反应中消耗的氯气体积为 (标准状况下),最后经过分离提纯得到
(标准状况下),最后经过分离提纯得到 纯净的磺酰氯,则磺酰氯的产率为
纯净的磺酰氯,则磺酰氯的产率为___________ (产率:实际产量/理论产量 )。
)。
(6)已知酸性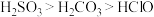 ,借助该酸性排序,使用以下装置设计实验证明
,借助该酸性排序,使用以下装置设计实验证明 的酸性强于
的酸性强于 ,其连接顺序应为
,其连接顺序应为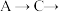
___________ 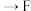 ;能证明
;能证明 的酸性强于
的酸性强于 的实验现象为
的实验现象为___________ 。
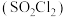 是重要的有机合成试剂,实验室可利用
是重要的有机合成试剂,实验室可利用 与
与 在活性炭作用下反应制取少量
在活性炭作用下反应制取少量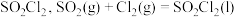 ,该反应放热,装置如图所示(部分夹持装置省略)。已知
,该反应放热,装置如图所示(部分夹持装置省略)。已知 的熔点为
的熔点为 ,沸点为
,沸点为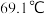 ,遇水能发生剧烈的水解反应,并产生白雾。
,遇水能发生剧烈的水解反应,并产生白雾。回答下列问题。

 ,则下列试剂组合中合适的是___________。
,则下列试剂组合中合适的是___________。A. 的硫酸和 的硫酸和 | B. 的硝酸和 的硝酸和 固体 固体 |
C.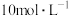 的硫酸和 的硫酸和 固体 固体 | D. 的硫酸和 的硫酸和 固体 固体 |
(2)导管a的作用是
(3)实验结束时,关闭分液漏斗活塞和止水夹k,此时装置戊的作用是
(4)
 遇水发生反应生成两种酸,该反应的化学方程式为
遇水发生反应生成两种酸,该反应的化学方程式为(5)若反应中消耗的氯气体积为
 (标准状况下),最后经过分离提纯得到
(标准状况下),最后经过分离提纯得到 纯净的磺酰氯,则磺酰氯的产率为
纯净的磺酰氯,则磺酰氯的产率为 )。
)。(6)已知酸性
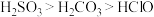 ,借助该酸性排序,使用以下装置设计实验证明
,借助该酸性排序,使用以下装置设计实验证明 的酸性强于
的酸性强于 ,其连接顺序应为
,其连接顺序应为
 ;能证明
;能证明 的酸性强于
的酸性强于 的实验现象为
的实验现象为
您最近一年使用:0次
2024-02-23更新
|
155次组卷
|
2卷引用:广东省深圳实验学校高中部2023-2024学年高一上学期第三阶段考试化学试题
8 . 科学家为化学学科发展做出了巨大的贡献,下列说法错误的是
| A.舍勒用软锰矿和浓盐酸加热制得氯气 |
B.侯德榜通过“联合制碱法”制得的纯碱主要成分是 |
| C.道尔顿提出原子学说为近代化学的发展奠定了坚实的基础 |
| D.门捷列夫按照原子序数由小到大的顺序编制了第一张元素周期表 |
您最近一年使用:0次
2024-02-03更新
|
113次组卷
|
3卷引用:选择题6-10
名校
解题方法
9 . 下列实验操作或装置设计合理的是
|
|
|
|
A.配制 的 的 溶液 溶液 | B.闻气体气味 | C.验证碳酸氢钠受热易分解 | D.尾气 最好用水吸收 最好用水吸收 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-03更新
|
77次组卷
|
3卷引用:广东省阳江市江城区部分学校2023-2024学年高一上学期期末联考化学试题
名校
解题方法
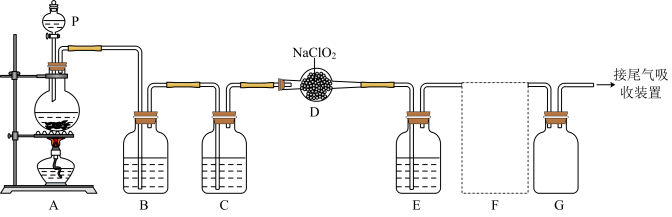
10 . ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2,成为自来水的消毒剂。已知ClO2是一种易溶于水的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应:2NaClO2+Cl2=2C1O2+2NaCl,下图是实验室用于制备和收集一定量纯净的ClO2的装置(某些夹持装置和垫持用品已省略),其中E用于除去ClO2中的未反应的Cl2。___________ 。
(2)写出装置A中烧瓶内发生反应的离子方程式:___________ 。
(3)B装置中所盛试剂是___________ 。
(4)F为ClO2收集装置,应选用的装置是___________ (填序号),其中与E装置导管相连的导管口是___________ (填接口字母)。
①请写出该反应的化学方程式:___________ ,每消耗319.5gNaClO3,生成___________ L氯气(标况下)。(M(NaClO3)=106.5)。
②浓盐酸在该反应中表现出来的性质是___________ (填序号)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)写出装置A中烧瓶内发生反应的离子方程式:
(3)B装置中所盛试剂是
(4)F为ClO2收集装置,应选用的装置是

①请写出该反应的化学方程式:
②浓盐酸在该反应中表现出来的性质是
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
您最近一年使用:0次
2024-02-02更新
|
144次组卷
|
3卷引用:广东省深圳市南头中学2023-2024学年高一上学期期末调研考试(模拟)化学试题