1 . KClO3和浓盐酸在一定温度下反应,还原产物为黄绿色的易爆物二氧化氯。其变化可以表示为:_____ KClO3+________ HCl(浓)→_________ KCl+_______ ClO2↑+______ Cl2↑+__________ H2O
(1)请配平该化学方程式(未知系数填入横线内)。
(2)浓盐酸在反应中显示出来的性质是________ (填编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)5 ℃ 下将产物氯气0.1 mol溶于水配成1 L溶液,请写出氯气溶于水的化学反应方程式____________________ 。
(4)若改变温度至70 ℃,发现KClO3和浓盐酸反应的氧化产物和还原产物均为二氧化氯气体,试写出反应的化学方程式:______________________________________________ 。
(1)请配平该化学方程式(未知系数填入横线内)。
(2)浓盐酸在反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)5 ℃ 下将产物氯气0.1 mol溶于水配成1 L溶液,请写出氯气溶于水的化学反应方程式
(4)若改变温度至70 ℃,发现KClO3和浓盐酸反应的氧化产物和还原产物均为二氧化氯气体,试写出反应的化学方程式:
您最近一年使用:0次
2020-02-19更新
|
241次组卷
|
3卷引用:安徽省六安市第一中学2019-2020学年高一下学期疫情防控延期开学期间辅导测试(二)化学试题
安徽省六安市第一中学2019-2020学年高一下学期疫情防控延期开学期间辅导测试(二)化学试题湖南省长沙市雅礼中学2020-2021学年高一上学期期中考试化学试题(已下线)期中测试卷03-【对点变式题】2021-2022学年高一化学上学期期中期末必考题精准练(人教版2019)
2 . 如图在衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加一滴含有酚酞的澄清石灰水、FeCl2溶液,然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿。提示:实验室中所用的少量氯气可以用下述原理制取:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,此反应在常温下即能进行。

(1)浓盐酸在反应中表现出来的性质是______ (填写编号),氧化剂与还原剂物质的量之比为______ ,氧化产物为______ 。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(2)产生0.1 mol Cl2,则转移电子的物质的量为______ mol。
(3)a处反应的化学方程式是___________________________ ,工业上用此原理制取漂白粉。
(4)b处离子方程式是________________________ 。
(5)高锰酸钾标准溶液经常用来滴定测量物质的含量。用高锰酸钾法间接测定石灰石中CaCO3的含量的方法为: 称取试样0.1250g,用稀盐酸溶解后加入(NH4)2C2O4得CaC2O4沉淀。沉淀经过滤洗涤后溶于稀硫酸中。滴定生成的H2C2O4用去浓度为0.0 16mo/LKMnO4溶液25.00mL。
①写出CaC2O4沉淀溶解的离子方程式:___________________
②配平并完成下列高锰酸钾滴定草酸反应的离子方程式:____ MnO4-+___ H2C2O4+____ =___ Mn2++___ CO2↑+____
③石灰石中CaCO3的百分含量:_______

(1)浓盐酸在反应中表现出来的性质是
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(2)产生0.1 mol Cl2,则转移电子的物质的量为
(3)a处反应的化学方程式是
(4)b处离子方程式是
(5)高锰酸钾标准溶液经常用来滴定测量物质的含量。用高锰酸钾法间接测定石灰石中CaCO3的含量的方法为: 称取试样0.1250g,用稀盐酸溶解后加入(NH4)2C2O4得CaC2O4沉淀。沉淀经过滤洗涤后溶于稀硫酸中。滴定生成的H2C2O4用去浓度为0.0 16mo/LKMnO4溶液25.00mL。
①写出CaC2O4沉淀溶解的离子方程式:
②配平并完成下列高锰酸钾滴定草酸反应的离子方程式:
③石灰石中CaCO3的百分含量:
您最近一年使用:0次
2019-09-30更新
|
133次组卷
|
2卷引用:陕西省渭南市临渭区尚德中学2020届高三上学期第一次月考化学试卷
名校
3 . 高铁酸钾(K2FeO4)是一种绿色、高效的水处理剂。实验室设计如下实验制备K2FeO4并探究其性质。
已知:①K2FeO4为暗紫色固体,可溶于水,微溶于KOH溶液。
② 具有强氧化性,在酸性或者中性溶液中能快速产生O2,在碱性溶液中较稳定。回答下列问题:
具有强氧化性,在酸性或者中性溶液中能快速产生O2,在碱性溶液中较稳定。回答下列问题:
(1)制备K2FeO4(夹持装置略)
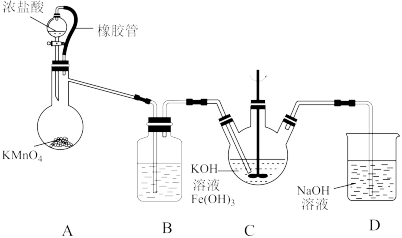
①如图所示,装置A为氯气发生装置,A中盛放KMnO4的仪器名称是__ ,橡胶管的作用是__ 。
②装置B中盛放的溶液是____ 。
③装置C中的KOH溶液需过量,目的是______ 。
④装置C中生成暗紫色固体K2FeO4的化学方程式为____ ,此外,氯气还与过量的KOH溶液反应,反应的离子方程式为____ 。
(2)探究K2FeO4的性质
某同学取装置C中的紫色溶液少许,加入稀硫酸,产生黄绿色气体,经检验气体中含有氯气。该现象________ (填“能”或“不能”)证明“酸性条件下 的氧化性强于Cl2”,理由是
的氧化性强于Cl2”,理由是________ 。
已知:①K2FeO4为暗紫色固体,可溶于水,微溶于KOH溶液。
②
 具有强氧化性,在酸性或者中性溶液中能快速产生O2,在碱性溶液中较稳定。回答下列问题:
具有强氧化性,在酸性或者中性溶液中能快速产生O2,在碱性溶液中较稳定。回答下列问题:(1)制备K2FeO4(夹持装置略)

①如图所示,装置A为氯气发生装置,A中盛放KMnO4的仪器名称是
②装置B中盛放的溶液是
③装置C中的KOH溶液需过量,目的是
④装置C中生成暗紫色固体K2FeO4的化学方程式为
(2)探究K2FeO4的性质
某同学取装置C中的紫色溶液少许,加入稀硫酸,产生黄绿色气体,经检验气体中含有氯气。该现象
 的氧化性强于Cl2”,理由是
的氧化性强于Cl2”,理由是
您最近一年使用:0次
解题方法
4 . 为了“探究铁及其化合物的氧化性或还原性”,某同学甲设计了如下的实验方案。
(1)实验前甲同学预测:Fe2+肯定既有还原性又有氧化性。你认为甲同学预测的依据是______ 。
(2)甲同学欲用实验证明他的预测。实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水。
①若甲同学计划在0.1 mol·L-1 FeCl2溶液中滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应是___________ (写化学方程式),现象是:溶液由浅绿色变__ 色。
②实验中,甲同学发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选上述试剂中的___ 滴入甲同学所得的混合液中,出现_______ 现象,证明甲同学的观点和实验方案都是正确的。
③对于证明Fe2+具有氧化性,甲同学认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果铜片没变化,锌粒逐渐变小,由此说明三种金属的还原性由强至弱的顺序为_____ 。
(1)实验前甲同学预测:Fe2+肯定既有还原性又有氧化性。你认为甲同学预测的依据是
(2)甲同学欲用实验证明他的预测。实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水。
①若甲同学计划在0.1 mol·L-1 FeCl2溶液中滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应是
②实验中,甲同学发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选上述试剂中的
③对于证明Fe2+具有氧化性,甲同学认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果铜片没变化,锌粒逐渐变小,由此说明三种金属的还原性由强至弱的顺序为
您最近一年使用:0次
名校
解题方法
5 . 为了研究非金属元素性质的变化规律,某同学设计如图实验装置。

(1)高锰酸钾在常温下与浓盐酸反应产生氯气,离子方程式为___________ 。
(2)如果A中盛放浓盐酸,B中盛放酸性高锰酸钾溶液,C中盛放饱和氢硫酸,反应开始后观察到C中产生淡黄色沉淀,证明氯的非金属性比硫的非金属性___________ (填“强”或“弱”或“无法判断”)。
(3)若用该装置证明Cl2氧化性强于I2的氧化性。则A中盛放浓盐酸,B中盛放高锰酸钾粉末,C中盛放淀粉KI溶液,则C中的现象为___________ 。
(4)现有浓硝酸、大理石、澄清石灰水、硅酸钠溶液,选择试剂用该装置证明:非金属性:N>C>Si。C中盛放试剂___________ ,实验现象为___________ ,该装置还存在不足之处,改进措施为___________ 。

(1)高锰酸钾在常温下与浓盐酸反应产生氯气,离子方程式为
(2)如果A中盛放浓盐酸,B中盛放酸性高锰酸钾溶液,C中盛放饱和氢硫酸,反应开始后观察到C中产生淡黄色沉淀,证明氯的非金属性比硫的非金属性
(3)若用该装置证明Cl2氧化性强于I2的氧化性。则A中盛放浓盐酸,B中盛放高锰酸钾粉末,C中盛放淀粉KI溶液,则C中的现象为
(4)现有浓硝酸、大理石、澄清石灰水、硅酸钠溶液,选择试剂用该装置证明:非金属性:N>C>Si。C中盛放试剂
您最近一年使用:0次
名校
6 . 高铁酸钾(K2FeO4)为高效净水剂,紫色固体,易溶于水,微溶于KOH溶液;具有强氧化性,在酸性溶液中完全、快速产生O2,在碱性溶液中较稳定。某实验小组制备高铁酸钾并探究其性质。
(1)制备K2FeO4(夹持装置略)
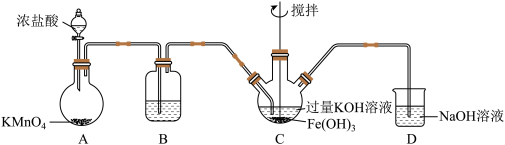
①装置B中所用试剂为_______ 。
②C中得到紫色固体和紫色溶液,C中发生的主要反应为_______ (用化学方程式表示)。
(2)探究K2FeO4的性质
①将K2FeO4溶液滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明酸性条件下 与
与 氧化性的强弱关系,请说明理由:
氧化性的强弱关系,请说明理由:_______ 。
②取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2,为证明是否K2FeO4氧化了Cl-而产生Cl2,某同学设计了以下方案:取少量a,滴加KSCN溶液至过量,溶液呈红色。该方案并不完善,因为溶液变红的原因可能是_______ ,_______ (用离子方程式表示)。重新设计实验方案,证明是K2FeO4氧化了Cl-而产生Cl2:将装置C中混合物过滤,将所得固体用KOH溶液充分洗涤,再用KOH溶液将少量固体溶解,得到紫色溶液,_______ 。[实验中必须使用的试剂:盐酸、淀粉碘化钾试纸]
(1)制备K2FeO4(夹持装置略)

①装置B中所用试剂为
②C中得到紫色固体和紫色溶液,C中发生的主要反应为
(2)探究K2FeO4的性质
①将K2FeO4溶液滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明酸性条件下
 与
与 氧化性的强弱关系,请说明理由:
氧化性的强弱关系,请说明理由:②取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2,为证明是否K2FeO4氧化了Cl-而产生Cl2,某同学设计了以下方案:取少量a,滴加KSCN溶液至过量,溶液呈红色。该方案并不完善,因为溶液变红的原因可能是
您最近一年使用:0次
2021-03-02更新
|
292次组卷
|
2卷引用:江苏省南京市第一中学2021届高三年级上学期10月月考化学试题
7 . 下列实验操作、现象和结论均正确的是
| 选项 | 实验 | 现象 | 结论 |
| A | 用洁净铂丝蘸取某碱性待测液在酒精灯上灼烧,透过蓝色钴玻璃 | 火焰呈紫色 | 待测液可能为KOH溶液 |
| B | 向某无色溶液中滴加稀盐酸 | 溶液变浑浊 | 溶液中一定含有Ag+ |
| C | 向品红溶液中通入氯气或通入SO2气体 | 溶液红色均褪去 | 氯气和SO2均有漂白性,但漂白原理不同 |
| D | 常温下,将铜丝插入到盛有浓硝酸的试管中 | 产生红棕色气体,溶液变为蓝色 | 浓硝酸表现酸性和氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-11-22更新
|
177次组卷
|
2卷引用:陕西省咸阳市三原南郊中学2020届高三第四次月考化学试题
解题方法
8 . 某同学设计实验以探究元素性质的递变规律,实验装置如图所示:
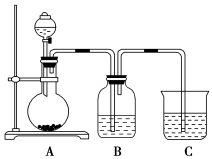
实验Ⅰ:探究同主族元素C和Si非金属性递变规律。
已知A装置的烧瓶里装有大理石,分液漏斗里装有盐酸,B装置中装有饱和碳酸氢钠溶液,C装置中装有足量Na2SiO3溶液,试回答:
(1) 中反应的离子方程式为
中反应的离子方程式为_______ ,B装置的作用是_______ ;
(2)C中发生反应的化学方程式为_______ 可观察到的现象是_______ ;
(3)根据实验现象推知,碳酸、盐酸、硅酸的酸性强弱顺序为_______ ,能否由此得出碳、氯、硅三种元素非金属性的强弱_______  填“能”或“否”
填“能”或“否” 并说明理由
并说明理由_______ 。
实验Ⅱ:探究同周期元素S和Cl的非金属性强弱。已知常温下高锰酸钾与浓盐酸混合可产生氯气,B装置中装有Na2S溶液,试回答:
(4) 装置分液漏斗中所装试剂为
装置分液漏斗中所装试剂为_______ ,B中可观察到的现象是_______ ;
(5)C装置的作用是_______ ,写出C中发生反应的离子方程式_______ 。
(6)验结论:氧化性:_______ ,非金属性:_______ 。

实验Ⅰ:探究同主族元素C和Si非金属性递变规律。
已知A装置的烧瓶里装有大理石,分液漏斗里装有盐酸,B装置中装有饱和碳酸氢钠溶液,C装置中装有足量Na2SiO3溶液,试回答:
(1)
 中反应的离子方程式为
中反应的离子方程式为(2)C中发生反应的化学方程式为
(3)根据实验现象推知,碳酸、盐酸、硅酸的酸性强弱顺序为
 填“能”或“否”
填“能”或“否” 并说明理由
并说明理由实验Ⅱ:探究同周期元素S和Cl的非金属性强弱。已知常温下高锰酸钾与浓盐酸混合可产生氯气,B装置中装有Na2S溶液,试回答:
(4)
 装置分液漏斗中所装试剂为
装置分液漏斗中所装试剂为(5)C装置的作用是
(6)验结论:氧化性:
您最近一年使用:0次
9 . 亚硝酰氯(ClNO)常用作催化剂和合成洗涤剂,其沸点为-5.5℃,易水解生成HNO2和HCl。某学习小组在实验室中用下图所示装置制备ClNO。已知: HNO2既有氧化性又有还原性;AgNO2微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3+HNO2。

回答下列问题
(1)仪器a的名称为_____________ , a在装置C中的作用是____________ 。
(2)装置B的作用是____________ 。
(3)实验开始时,先打开K1、K2,关闭K3,再打开分液漏斗活塞滴入适量稀硝酸,当观察到C中______ 时关闭K1、K2。向装置D三颈瓶中通入干燥纯净Cl2,当瓶中充满黄绿色气体时,再打开K1、K3,制备ClNO。
(4)装置D中干燥管的作用是__________________ 。
(5)实验过程中,若学习小组同学用酒精灯大火加热制取NO,对本实验造成的不利影响除了有反应速率过快,使NO来不及反应即大量逸出外,还可能有:___________ 。
(6)①要验证ClNO与H2O反应后的溶液中存在Cl-和HNO2,合理的操作步骤及正确的顺序是_____ (填序号)。
a.向烧杯中滴加过量KI淀粉溶液,溶液变蓝色
b.取1.0mL 三颈瓶中产品于烧杯中,加入10.0mLH2O充分反应
c.向烧杯中滴加酸性KMnO4溶液,溶液紫色褪去
d.向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,加入稀硝酸,搅拌,仍有白色沉淀
②配制王水的过程中会反应产生ClNO,请写出该反应的化学方程式:__________________ 。

回答下列问题
(1)仪器a的名称为
(2)装置B的作用是
(3)实验开始时,先打开K1、K2,关闭K3,再打开分液漏斗活塞滴入适量稀硝酸,当观察到C中
(4)装置D中干燥管的作用是
(5)实验过程中,若学习小组同学用酒精灯大火加热制取NO,对本实验造成的不利影响除了有反应速率过快,使NO来不及反应即大量逸出外,还可能有:
(6)①要验证ClNO与H2O反应后的溶液中存在Cl-和HNO2,合理的操作步骤及正确的顺序是
a.向烧杯中滴加过量KI淀粉溶液,溶液变蓝色
b.取1.0mL 三颈瓶中产品于烧杯中,加入10.0mLH2O充分反应
c.向烧杯中滴加酸性KMnO4溶液,溶液紫色褪去
d.向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,加入稀硝酸,搅拌,仍有白色沉淀
②配制王水的过程中会反应产生ClNO,请写出该反应的化学方程式:
您最近一年使用:0次
10 . 下列关于氯元素的说法正确的是( )
| A.HCl 具有很强的酸性,且只有氧化性没有还原性 |
| B.3517Cl、 3717Cl为不同的核素,有完全不同的化学性质 |
| C.1.12L Cl2含有 1 .7NA个质子(NA表示阿伏伽德罗常数) |
| D.氯气可从 KI 溶液中置换出 I2,说明氯的非金属性比碘强 |
您最近一年使用:0次



