1 .  是一种高效消毒剂,易与水反应且其水溶性远大于
是一种高效消毒剂,易与水反应且其水溶性远大于 (1体积水能溶解100体积以上的
(1体积水能溶解100体积以上的 )。实验室通过反应
)。实验室通过反应 制取
制取 ,装置如图所示(部分夹持仪器已省略)。
,装置如图所示(部分夹持仪器已省略)。

已知:① 的熔点为
的熔点为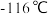 ,沸点为
,沸点为 ;
; 的沸点为
的沸点为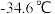 ;②
;② 浓度过大时易分解爆炸,实验中控制
浓度过大时易分解爆炸,实验中控制 和
和 的体积比为
的体积比为 。
。
回答下列问题:
(1)写出A中反应的化学方程式:_______ 。该反应中,浓盐酸表现的性质是_______ (填“氧化性”“还原性”或“酸性”)。
(2)B的作用是_______ 。C的3个作用分别是将两种气体混合均匀、_______ 、_______ 。
(3)D中反应的氧化剂与还原剂的物质的量之比为_______ ,E中冰水的作用是_______ 。
(4)工业上还可将氯气和空气(不参与反应)按体积比 混合通入潮湿的碳酸钠中制备
混合通入潮湿的碳酸钠中制备 ,另外两种产物为
,另外两种产物为 和
和 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_______ 。
 是一种高效消毒剂,易与水反应且其水溶性远大于
是一种高效消毒剂,易与水反应且其水溶性远大于 (1体积水能溶解100体积以上的
(1体积水能溶解100体积以上的 )。实验室通过反应
)。实验室通过反应 制取
制取 ,装置如图所示(部分夹持仪器已省略)。
,装置如图所示(部分夹持仪器已省略)。
已知:①
 的熔点为
的熔点为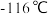 ,沸点为
,沸点为 ;
; 的沸点为
的沸点为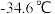 ;②
;② 浓度过大时易分解爆炸,实验中控制
浓度过大时易分解爆炸,实验中控制 和
和 的体积比为
的体积比为 。
。回答下列问题:
(1)写出A中反应的化学方程式:
(2)B的作用是
(3)D中反应的氧化剂与还原剂的物质的量之比为
(4)工业上还可将氯气和空气(不参与反应)按体积比
 混合通入潮湿的碳酸钠中制备
混合通入潮湿的碳酸钠中制备 ,另外两种产物为
,另外两种产物为 和
和 ,写出该反应的化学方程式:
,写出该反应的化学方程式:
您最近一年使用:0次
解题方法
2 . 用如图所示装置(夹持装置已省略)进行下列实验,能得出相应实验结论的是
| 选项 | ① | ② | ③ | 实验结论 | 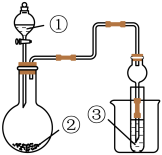 |
| A | 浓盐酸 | 高锰酸钾 | 碘化钾-淀粉溶液 | 氯气具有氧化性 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 稀硫酸 | Na2CO3 | CaCl2溶液 | CO2可与氯化钙反应 | |
| D | 浓硫酸 | 铜片 | 酸性高锰酸钾溶液 | SO2具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-12-25更新
|
221次组卷
|
2卷引用:山东莒县第一中学2022-2023学年高一上学期12月月考化学试题
解题方法
3 . 如图为实验室制取纯净、干燥的Cl2,并用Cl2与铜反应制取纯净的无水CuCl2。

试回答下列问题:
(1)写出A中反应的化学方程式_____ 。
(2)反应中浓盐酸显示出来的性质是_____ 。
(3)为得到干燥纯净的氯气,一般在B瓶中加入____ 试剂,C瓶中加入_____ 试剂。(填试剂名称)
(4)装置E的作用是____ ;E处发生反应的离子方程式为_____ 。
(5)若用200mL10mol•L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化氢挥发),则产生氯气的物质的量_____ 0.5mol(填“大于”、“等于”或“小于”)。

试回答下列问题:
(1)写出A中反应的化学方程式
(2)反应中浓盐酸显示出来的性质是
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
(4)装置E的作用是
(5)若用200mL10mol•L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化氢挥发),则产生氯气的物质的量
您最近一年使用:0次
4 . 氯气与碱溶液反应,在低温和稀碱溶液中主要产物是ClO-和Cl-,在75℃以上和浓碱溶液中主要产物是ClO 和Cl-。研究小组用如科实验装置(部分夹持装置略去)制取氯酸钾(KClO3),并测定其纯度。
和Cl-。研究小组用如科实验装置(部分夹持装置略去)制取氯酸钾(KClO3),并测定其纯度。
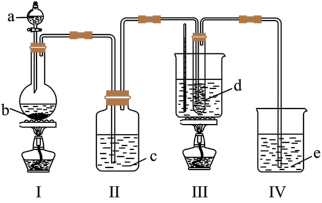
a为浓盐酸,b为MnO2,c为饱和食盐水,d为30%KOH溶液,e为NaOH溶液
回答下列问题:
(1)检查装置气密性后,添加药品,待装置Ⅲ水温升至75℃开始反应。从装置Ⅲ的试管中分离得到KClO3粗产品,其中混有的杂质除KOH外还有___ 和___ 。
(2)已知碱性条件下,ClO-有强氧化性。设计实验证明“碱性条件下,H2O2能够被ClO-氧化”:___ 。
(必须选择的试剂和药品有:次氯酸钠溶液,H2O2溶液,NaOH溶液,木条。请写出实验操作及现象)。
(3)已知碱性条件下,ClO3-氧化性较弱,不能氧化H2O2。为测定产品KClO3的纯度,进行如下实验:
步骤1:取2.45g样品溶于水配成250mL溶液。
步骤2:取25.00mL溶液于锥形瓶中,调至pH=10,滴加足量H2O2溶液充分反应,然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。(发生的反应为:ClO +I-+H+—Cl-+I2+H2O未配平)
+I-+H+—Cl-+I2+H2O未配平)
步骤4:加入指示剂,用0.5000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。(2S2O +I2=S4O
+I2=S4O +2I-)
+2I-)
①步骤2中如果不进行煮沸所测定的KClO3纯度___ (填偏高、偏低或无影响)。
②样品中KClO3的质量分数为___ 。(KClO3相对分子质量:122.5)写出计算过程。
 和Cl-。研究小组用如科实验装置(部分夹持装置略去)制取氯酸钾(KClO3),并测定其纯度。
和Cl-。研究小组用如科实验装置(部分夹持装置略去)制取氯酸钾(KClO3),并测定其纯度。
a为浓盐酸,b为MnO2,c为饱和食盐水,d为30%KOH溶液,e为NaOH溶液
回答下列问题:
(1)检查装置气密性后,添加药品,待装置Ⅲ水温升至75℃开始反应。从装置Ⅲ的试管中分离得到KClO3粗产品,其中混有的杂质除KOH外还有
(2)已知碱性条件下,ClO-有强氧化性。设计实验证明“碱性条件下,H2O2能够被ClO-氧化”:
(必须选择的试剂和药品有:次氯酸钠溶液,H2O2溶液,NaOH溶液,木条。请写出实验操作及现象)。
(3)已知碱性条件下,ClO3-氧化性较弱,不能氧化H2O2。为测定产品KClO3的纯度,进行如下实验:
步骤1:取2.45g样品溶于水配成250mL溶液。
步骤2:取25.00mL溶液于锥形瓶中,调至pH=10,滴加足量H2O2溶液充分反应,然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。(发生的反应为:ClO
 +I-+H+—Cl-+I2+H2O未配平)
+I-+H+—Cl-+I2+H2O未配平)步骤4:加入指示剂,用0.5000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。(2S2O
 +I2=S4O
+I2=S4O +2I-)
+2I-)①步骤2中如果不进行煮沸所测定的KClO3纯度
②样品中KClO3的质量分数为
您最近一年使用:0次
5 . 已知①KClO3 + 6HCl(浓)= KCl + 3Cl2↑ + 3H2O;②Fe3+与KSCN反应溶液变为红色。如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。由实验现象得出的结论完全正确的是


| A.滴有KSCN的FeCl2溶液变红色,说明Cl2具有还原性 |
| B.湿润的有色布条褪色,说明Cl2具有酸性 |
| C.石蕊溶液先变为红色后褪色,说明Cl2具有漂白性 |
| D.KI淀粉溶液变蓝色,说明Cl2的氧化性强于I2 |
您最近一年使用:0次
名校
解题方法
6 .  是一种高效,安全的消毒剂,可用于取代
是一种高效,安全的消毒剂,可用于取代 。实验室制备
。实验室制备 的原理是用亚氯酸钠固体与纯净干燥的氯气反应:
的原理是用亚氯酸钠固体与纯净干燥的氯气反应: 。如图是实验室用于制备和收集一定量纯净
。如图是实验室用于制备和收集一定量纯净 的装置(某些夹持装置省略)。
的装置(某些夹持装置省略)。

(1)圆底烧瓶装有 ,发生反应的化学方程式为:
,发生反应的化学方程式为:_______ ,在该反应中浓盐酸表现的性质是_______ (填序号)。
a.只有还原性 b.还原性和酸性 c.只有氧化性 d.氧化性和酸性
(2)实验中相关气体在不同溶剂中的溶解性如下表所示:
B、E装置中的试剂依次是_______ 、_______ (填序号)。
a.NaOH溶液 b.浓硫酸 c.饱和食盐水 d. e.饱和石灰水
e.饱和石灰水
(3)F处应选用的收集装置是_______ (填序号),其中与E装置导管相连的导管口是_______ (填接口字母)。

(4)装置G的作用_______ 。
(5)家用的二氧化氯 泡腾消毒片由
泡腾消毒片由 、固体酸及辅助剂混合制得,使用时只需将泡腾片放入水中,5~10分钟即可完全溶解,释放出
、固体酸及辅助剂混合制得,使用时只需将泡腾片放入水中,5~10分钟即可完全溶解,释放出 。
。
补全泡腾片在水中发生反应的离子方程式:_______ 。

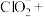



 ↑+
↑+ _______+
_______+ _______
_______
 是一种高效,安全的消毒剂,可用于取代
是一种高效,安全的消毒剂,可用于取代 。实验室制备
。实验室制备 的原理是用亚氯酸钠固体与纯净干燥的氯气反应:
的原理是用亚氯酸钠固体与纯净干燥的氯气反应: 。如图是实验室用于制备和收集一定量纯净
。如图是实验室用于制备和收集一定量纯净 的装置(某些夹持装置省略)。
的装置(某些夹持装置省略)。
(1)圆底烧瓶装有
 ,发生反应的化学方程式为:
,发生反应的化学方程式为:a.只有还原性 b.还原性和酸性 c.只有氧化性 d.氧化性和酸性
(2)实验中相关气体在不同溶剂中的溶解性如下表所示:
 |  | HCl | |
| 水 | 极易溶 | 可溶 | 极易溶 |
 | 难溶 | 易溶 | 难溶 |
a.NaOH溶液 b.浓硫酸 c.饱和食盐水 d.
 e.饱和石灰水
e.饱和石灰水(3)F处应选用的收集装置是

(4)装置G的作用
(5)家用的二氧化氯
 泡腾消毒片由
泡腾消毒片由 、固体酸及辅助剂混合制得,使用时只需将泡腾片放入水中,5~10分钟即可完全溶解,释放出
、固体酸及辅助剂混合制得,使用时只需将泡腾片放入水中,5~10分钟即可完全溶解,释放出 。
。补全泡腾片在水中发生反应的离子方程式:

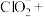



 ↑+
↑+ _______+
_______+ _______
_______
您最近一年使用:0次
名校
解题方法
7 . 回答下列问题:
(1)某同学写出以下三个化学方程式(未配平):
①
②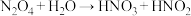
③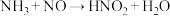
其中你认为一定不可能实现的是_______ (填序号)。
(2)下列三个氧化还原反应中
①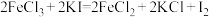
②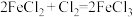
③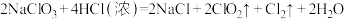
若溶质中Cl-与I-共存,为了氧化I-而Cl-不被氧化,除Cl2单质外,还可以用上述反应中的_______ 做氧化剂。
(3)HNO2是一种弱酸,且不稳定,易分解生成NO和NO2,其中NO难溶于水,NO2易溶于水且能与水反应产生NO;HNO2是一种还原剂,能被常见的强氧化剂氧化,但在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+(还原性I->Fe2+)。AgNO2是一种难溶于水,易溶于酸的化合物。试回答下列问题:
①下列方法中,不能用来区分NaNO2和NaCl的是_______ (填序号)
A.加入稀硫酸,观察是否有气泡产生
B.在酸性条件下加入KI-淀粉溶液,观察溶液颜色
C.加入AgNO3溶液,观察是否有沉淀产生
②某同学把氯气通入到NaNO2溶液中,生成NaNO3和一种无氧酸,请写出反应的化学方程式:_______ 。
(4) Cl2、HClO、Ca(ClO)2、Na2O2等是中学教材中常见强氧化剂,已知+4价的硫既具氧化性又具还原性,以还原性为主。在次氯酸钙溶液中通入过量的SO2,有白色沉淀生成,其离子方程式为_______ 。
(1)某同学写出以下三个化学方程式(未配平):
①

②
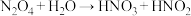
③
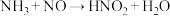
其中你认为一定不可能实现的是
(2)下列三个氧化还原反应中
①
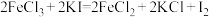
②
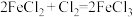
③
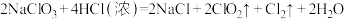
若溶质中Cl-与I-共存,为了氧化I-而Cl-不被氧化,除Cl2单质外,还可以用上述反应中的
(3)HNO2是一种弱酸,且不稳定,易分解生成NO和NO2,其中NO难溶于水,NO2易溶于水且能与水反应产生NO;HNO2是一种还原剂,能被常见的强氧化剂氧化,但在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+(还原性I->Fe2+)。AgNO2是一种难溶于水,易溶于酸的化合物。试回答下列问题:
①下列方法中,不能用来区分NaNO2和NaCl的是
A.加入稀硫酸,观察是否有气泡产生
B.在酸性条件下加入KI-淀粉溶液,观察溶液颜色
C.加入AgNO3溶液,观察是否有沉淀产生
②某同学把氯气通入到NaNO2溶液中,生成NaNO3和一种无氧酸,请写出反应的化学方程式:
(4) Cl2、HClO、Ca(ClO)2、Na2O2等是中学教材中常见强氧化剂,已知+4价的硫既具氧化性又具还原性,以还原性为主。在次氯酸钙溶液中通入过量的SO2,有白色沉淀生成,其离子方程式为
您最近一年使用:0次
8 . 某同学利用以下装置探究非金属元素性质的递变规律,并验证氯气的性质。
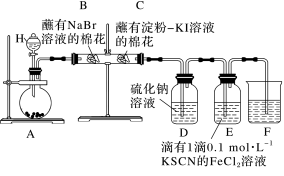
回答下列问题:
(1)仪器H的名称为_______ 。
(2)能说明氯气的氧化性强于溴的实验现象为_______ 。
(3)氯气进入D中,反应的离子方程式为_______ 。
(4)E中溶液先变为红色,后红色褪去,为探究E中溶液褪色的原因,该同学提出两种假设:
a.Fe3+被氧化;
b._______ 。
设计实验方案验证以上假设,向褪色后的溶液中滴加_______ ,若观察到_______ ,可验证假设b成立。
(5)实验结束后,在另一个蘸有淀粉-KI溶液的棉花G上滴加溴水,棉花G变蓝。通过以上实验可以得出的结论正确的是_______(填字母)。

回答下列问题:
(1)仪器H的名称为
(2)能说明氯气的氧化性强于溴的实验现象为
(3)氯气进入D中,反应的离子方程式为
(4)E中溶液先变为红色,后红色褪去,为探究E中溶液褪色的原因,该同学提出两种假设:
a.Fe3+被氧化;
b.
设计实验方案验证以上假设,向褪色后的溶液中滴加
(5)实验结束后,在另一个蘸有淀粉-KI溶液的棉花G上滴加溴水,棉花G变蓝。通过以上实验可以得出的结论正确的是_______(填字母)。
| A.氧化性:Cl2>Br2>I2 |
| B.同主族元素从上到下非金属性减弱 |
| C.同周期元素从左到右非金属性减弱 |
| D.Cl、Br、I对应含氧酸酸性逐渐减弱 |
您最近一年使用:0次
9 . 氯气在工业生产中有重要的用途。某课外活动小组利用下列装置在实验室中制备氯气,并进行有关氯气性质的研究。

(1)该小组同学欲用图1所示仪器及试剂(不一定全用)制备并收集纯净、干燥的氯气。
①写出实验室制氯气的化学方程式:_______ ;已知浓盐酸的质量分数为36.5%,密度为1.15g/mL,则该浓盐酸的物质的量浓度是_______ ;浓盐酸起酸性作用和还原剂作用的物质的量之比为_______ 。
②选择装置,将各仪器按先后顺序连接起来,应该是a→_______ →h(用导管口处的字母表示)。
(2)装置C中饱和食盐水的作用是_______ 。
(3)用E装置吸收多余氯气,写出E中发生反应的离子方程式:_______ ,实验结束后检验E中溶液含有氯离子的实验操作是_______ 。
(4)该小组同学设计并分别利用图2所示装置探究氯气的氧化性,已知碘单质遇淀粉会变蓝。G中的现象是_______ ,原因是_______ (用化学方程式表示)。


(1)该小组同学欲用图1所示仪器及试剂(不一定全用)制备并收集纯净、干燥的氯气。
①写出实验室制氯气的化学方程式:
②选择装置,将各仪器按先后顺序连接起来,应该是a→
(2)装置C中饱和食盐水的作用是
(3)用E装置吸收多余氯气,写出E中发生反应的离子方程式:
(4)该小组同学设计并分别利用图2所示装置探究氯气的氧化性,已知碘单质遇淀粉会变蓝。G中的现象是

您最近一年使用:0次
解题方法
10 . 实验室用MnO2氧化密度为1.19 g·cm-3,溶质质量分数为36.5%的HCl溶液制备并收集干燥纯净 的Cl2.如图装置

(1)装置A中反应的离子方程式为:___________ ,装置E用于吸收尾气,E中反应的离子方程式是___________ 。
(2)装置B的作用是___________ 。装置C中盛放的物质是___________ 。
(3)装置D用于收集Cl2,请将图中装置D的导气管补充完整___________ (在答题卡上画图)。
(4)8.7gMnO2与足量浓盐酸反应能使___________ molHCl被氧化;该盐酸的物质的量浓度为___________ mol/L。
(5)浓盐酸在反应中显示出来的性质是___________(填字母)
(6)下图是一氯气化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条褪色。则D瓶中盛有的溶液是


(1)装置A中反应的离子方程式为:
(2)装置B的作用是
(3)装置D用于收集Cl2,请将图中装置D的导气管补充完整
(4)8.7gMnO2与足量浓盐酸反应能使
(5)浓盐酸在反应中显示出来的性质是___________(填字母)
| A.还原性 | B.酸性 | C.氧化性 | D.挥发性 |

| A.浓硫酸 | B.饱和氯化钠溶液 |
| C.足量浓氢氧化钠溶液 | D.水 |
您最近一年使用:0次



