2024高三·全国·专题练习
1 . 实验室可用MnO2、KMnO4、KClO3等与浓盐酸反应制取氯气,Cl2与消石灰、烧碱等反应可制取漂白粉、消毒液,在光照条件下Cl2可与甲烷发生反应。下列关于Cl2的制备、净化、收集及尾气处理的装置和原理能达到实验目的的是
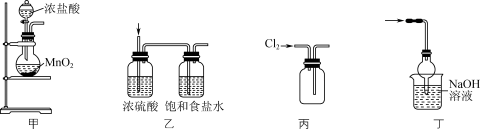
| A.用甲装置制备Cl2 | B.用乙装置除去Cl2中的H2O和HCl |
| C.用丙装置收集Cl2 | D.用丁装置吸收尾气 |
您最近半年使用:0次
2024高三·全国·专题练习
解题方法
2 . 常温下氯气与NaOH溶液反应可得“84”消毒液;在一定条件下,氯气与碘单质以等物质的量进行反应,可得到一种红棕色液体ICl,ICl有很强的氧化性,ICl与Zn、H2O反应的化学方程式分别为2ICl+2Zn=ZnCl2+ZnI2;ICl+H2O=HCl+HIO。某校化学兴趣小组利用如图所示装置在实验室制备“84”消毒液,下列说法正确的是
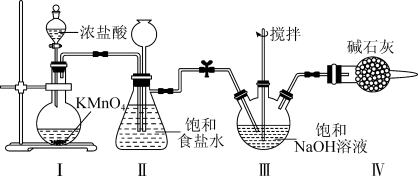
| A.装置Ⅰ中的KMnO4可以替换成MnO2 |
| B.装置Ⅱ可以除去Cl2中HCl杂质,还可以防止倒吸 |
| C.装置Ⅲ中消耗5.6 L Cl2 (标准状况),转移0.5 mol电子 |
| D.装置Ⅳ中发生的反应都是氧化还原反应 |
您最近半年使用:0次
2024·广西·二模
名校
3 . 下列有关物质性质、用途的描述错误的是
A. 易液化,可用于制取漂白液 易液化,可用于制取漂白液 |
B. 有还原性,在葡萄酒中添加适量的 有还原性,在葡萄酒中添加适量的 能防止葡萄酒的氧化变质 能防止葡萄酒的氧化变质 |
C.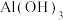 分解生成 分解生成 和 和 是吸热反应,故 是吸热反应,故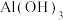 可用作阻燃剂 可用作阻燃剂 |
D.铁粉具有还原性,能够除去污水中的 、 、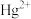 |
您最近半年使用:0次
2024-04-17更新
|
584次组卷
|
5卷引用:题型6 元素及其化合物 化学实验基础(25题)-2024年高考化学常考点必杀300题(新高考通用)
(已下线)题型6 元素及其化合物 化学实验基础(25题)-2024年高考化学常考点必杀300题(新高考通用)广西壮族自治区部分学校2023-2024学年高三下学期教学质量监测联考(二模)化学试题江西省部分地区2023-2024学年高三下学期3月月考化学试题甘肃省酒泉市九师联盟2023-2024学年高三下学期3月月考化学试题湖北省九师联盟2024届高三下学期3月质量检测(W-G)化学试卷
2024·广东深圳·一模
名校
解题方法
4 . 利用下图所示装置进行实验,先向W形管中通入 ,一段时间后,再用注射器向其中加入浓盐酸,当
,一段时间后,再用注射器向其中加入浓盐酸,当 充满整个W形管后点燃酒精灯,下列说法正确的是
充满整个W形管后点燃酒精灯,下列说法正确的是
 ,一段时间后,再用注射器向其中加入浓盐酸,当
,一段时间后,再用注射器向其中加入浓盐酸,当 充满整个W形管后点燃酒精灯,下列说法正确的是
充满整个W形管后点燃酒精灯,下列说法正确的是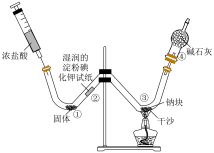
A.①处固体为 |
B.②处试纸变蓝,说明 具有氧化性 具有氧化性 |
| C.③处可观察到钠块剧烈燃烧,且产生大量白雾 |
D.④处碱石灰的主要作用是防止空气中的 、水蒸气与钠反应 、水蒸气与钠反应 |
您最近半年使用:0次
2024-03-22更新
|
609次组卷
|
3卷引用:通关练03 常考化学实验基础知识-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
(已下线)通关练03 常考化学实验基础知识-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)2024届广东省深圳市高三下学期一模考试化学试卷广东省茂名市高州中学2023-2024学年高一下学期期中考试化学试题
2024·江苏南通·一模
5 . 实验室利用下列装置进行实验,不能达到实验目的是
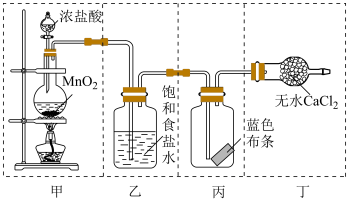
A.用装置甲制取 |
B.用装置乙除去 中混有的 中混有的 气体 气体 |
C.用装置丙验证潮湿的 具有漂白性 具有漂白性 |
D.用装置丁吸收尾气中的 |
您最近半年使用:0次
2024·河南南阳·模拟预测
名校
解题方法
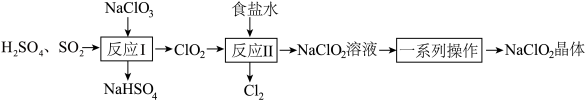
6 . NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等。已知:饱和NaClO2溶液在温度低于38℃时析出NaCO2•3H2O晶体,温度高于38℃时析出NaClO2晶体,温度高于60℃时,NaClO2分解生成NaClO3和NaCl。其生产工艺如图所示。
(1)NaClO2中氯元素的化合价为___________ 。
(2)“反应I”中氧化剂与还原剂的物质的量之比为___________ 。
(3)“反应Ⅱ”的离子方程式为___________ 。
(4)“反应”所用“食盐水”由粗盐水精制而成。精制时,为除去粗盐水中的Ca2+、Mg2+和 ,需要用到试剂:①NaOH溶液②Na2CO3溶液③BaCl2溶液④稀盐酸,所用试剂的加入顺序正确的是___________。(填标号)
,需要用到试剂:①NaOH溶液②Na2CO3溶液③BaCl2溶液④稀盐酸,所用试剂的加入顺序正确的是___________。(填标号)
(5)“一系列操作”为蒸发浓缩、趁热过滤、___________ 、干燥,其中“趁热过滤”应控制的温度范围是___________ 。
(6)“反应Ⅱ”产生的Cl2可用于制备含氯消毒剂。将Cl2通入足量NaOH溶液中,加热后得到NaCl、NaClO、NaClO3的混合液。经测定ClO-与 的物质的量浓度之比为3∶1,则Cl2与NaOH溶液反应时,被氧化的氯元素与被还原的氯元素的物质的量之比为
的物质的量浓度之比为3∶1,则Cl2与NaOH溶液反应时,被氧化的氯元素与被还原的氯元素的物质的量之比为___________ 。
(1)NaClO2中氯元素的化合价为
(2)“反应I”中氧化剂与还原剂的物质的量之比为
(3)“反应Ⅱ”的离子方程式为
(4)“反应”所用“食盐水”由粗盐水精制而成。精制时,为除去粗盐水中的Ca2+、Mg2+和
 ,需要用到试剂:①NaOH溶液②Na2CO3溶液③BaCl2溶液④稀盐酸,所用试剂的加入顺序正确的是___________。(填标号)
,需要用到试剂:①NaOH溶液②Na2CO3溶液③BaCl2溶液④稀盐酸,所用试剂的加入顺序正确的是___________。(填标号)| A.①②③④ | B.②①③④ | C.③①②④ | D.③②①④ |
(5)“一系列操作”为蒸发浓缩、趁热过滤、
(6)“反应Ⅱ”产生的Cl2可用于制备含氯消毒剂。将Cl2通入足量NaOH溶液中,加热后得到NaCl、NaClO、NaClO3的混合液。经测定ClO-与
 的物质的量浓度之比为3∶1,则Cl2与NaOH溶液反应时,被氧化的氯元素与被还原的氯元素的物质的量之比为
的物质的量浓度之比为3∶1,则Cl2与NaOH溶液反应时,被氧化的氯元素与被还原的氯元素的物质的量之比为
您最近半年使用:0次
2024-02-11更新
|
542次组卷
|
5卷引用:通关练04 化工微流程-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
(已下线)通关练04 化工微流程-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)2024届河南省南阳市方城县第一高级中学高一上学期1月期末模拟预测化学试题湖南省宁乡市第一高级中学2021届高三第三次模拟考试化学试卷安徽省六安市叶集皖西当代中学2023-2024学年高一下学期3月月考化学试题湖南省长沙市第一中学2023-2024学年高一下学期第一次阶段性检测(月考)化学试题
23-24高一上·福建泉州·期末
解题方法
7 . 某实验小组利用下图装置制取并探究 的性质。下列说法正确的是
的性质。下列说法正确的是
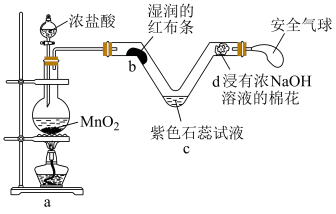
A. 处湿润的红布条褪色,说明 处湿润的红布条褪色,说明 具有漂白性 具有漂白性 |
B. 处的紫色石蕊试液先变红,说明 处的紫色石蕊试液先变红,说明 中混有 中混有 气体 气体 |
C. 处浓 处浓 溶液的作用是除去 溶液的作用是除去 和 和 气体 气体 |
D.用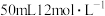 的盐酸与足量 的盐酸与足量 反应,产生 反应,产生 |
您最近半年使用:0次
23-24高三上·河北衡水·期末
名校
解题方法
8 . 某实验小组利用硫渣(主要成分为Sn,含少量Cu2S、Pb、As等)与氯气反应制备四氯化锡,其过程如图所示(夹持、加热及控温装置略)。已知:SnCl4遇水极易水解。
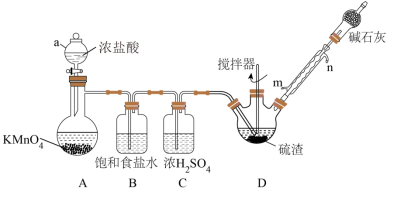
相关产物的熔沸点:
(1)仪器a的名称___________ 。
(2)冷凝管的进水口为___________ (填“m”或“n”),碱石灰的作用为___________ 。
(3)如果缺少B装置,可能造成的影响为___________ 。
(4)实验结束后,将三颈烧瓶中得到的物质冷却至室温,___________ (填操作名称),得到粗产品,粗产品再精馏可得到纯净的SnCl4。
(5)用碘量法测量粗产品的纯度:取10.00g粗产品溶于水,加入0.100mol·L-1标准I2溶液20.00mL,并加入少量的淀粉溶液:用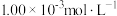 的硫代硫酸钠标准溶液滴定过量的碘。滴定终点时消耗20.00mL硫代硫酸钠标准溶液。测定过程中发生的相关反应:
的硫代硫酸钠标准溶液滴定过量的碘。滴定终点时消耗20.00mL硫代硫酸钠标准溶液。测定过程中发生的相关反应:
①
②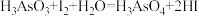
③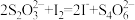
则产品中SnCl4的质量分数___________ (保留三位有效数字)。

相关产物的熔沸点:
| 物质性质 | SnCl4 | SnCl2 | CuCl | PbCl2 | AsCl3 | S |
| 熔点/℃ | -33 | 246 | 426 | 501 | -18 | 112 |
| 沸点/℃ | 114 | 652 | 1490 | 951 | 130 | 444 |
(2)冷凝管的进水口为
(3)如果缺少B装置,可能造成的影响为
(4)实验结束后,将三颈烧瓶中得到的物质冷却至室温,
(5)用碘量法测量粗产品的纯度:取10.00g粗产品溶于水,加入0.100mol·L-1标准I2溶液20.00mL,并加入少量的淀粉溶液:用
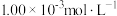 的硫代硫酸钠标准溶液滴定过量的碘。滴定终点时消耗20.00mL硫代硫酸钠标准溶液。测定过程中发生的相关反应:
的硫代硫酸钠标准溶液滴定过量的碘。滴定终点时消耗20.00mL硫代硫酸钠标准溶液。测定过程中发生的相关反应:①

②
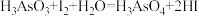
③
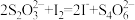
则产品中SnCl4的质量分数
您最近半年使用:0次
2024·贵州·模拟预测
名校
解题方法
9 . 下列生产活动中对应的离子方程式正确的是
A.用 溶液蚀刻覆铜板制作印刷电路板: 溶液蚀刻覆铜板制作印刷电路板: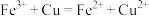 |
B.向冷的石灰乳中通入 制漂白粉: 制漂白粉: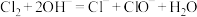 |
C.用 溶液除去锅炉水垢中的 溶液除去锅炉水垢中的 : :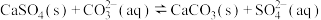 |
D.用丙烯腈电合成己二腈,在阳极发生的电极反应: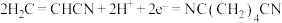 |
您最近半年使用:0次
2024-01-22更新
|
845次组卷
|
6卷引用:2024年1月“九省联考”贵州卷真题完全解读与考后提升
(已下线)2024年1月“九省联考”贵州卷真题完全解读与考后提升(已下线)选择题1-5(已下线)热点03 离子方程式的正误判断、离子共存2024年1月贵州普通高等学校招生考试适应性测试化学试题江苏省扬州中学2023-2024学年高二下学期3月考试化学试题2024届陕西省咸阳市乾县第一中学高三下学期第一次模拟考试理综试题-高中化学
23-24高三上·重庆·阶段练习
名校
解题方法
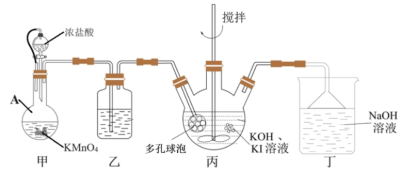
10 .  (碘酸钾)常用的食盐加碘剂,某研究小组在实验室采用如下种方法进行
(碘酸钾)常用的食盐加碘剂,某研究小组在实验室采用如下种方法进行 的制备。
的制备。
已知:① 是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。
是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。
② 在碱性条件下还原产物为一种不溶于水的沉淀。
在碱性条件下还原产物为一种不溶于水的沉淀。
回答下列问题:
(1)甲装置中仪器A的名称是________ ,丙装置中多孔球泡装置的作用是_________ 。
(2)丁装置中发生反应的离子方程式为___________ 。
(3)实验室还可以直接使用 与KI溶液在强碱环境中制备
与KI溶液在强碱环境中制备 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(4)反应结束后,将装置丙中溶液经如下操作可得到较为纯净的 晶体:
晶体:

在获取碘酸钾产品的操作中,下列说法正确的是___________(填序号)。
(5)产品纯度的测定:准确称取ag产品,配制成250mL溶液作为待测液,取25.00mL该溶液于碘量瓶中,加入稍过量的KI,用适量的盐酸酸化,盖紧塞子,置于避光处3min,用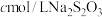 标准溶液滴定,当溶液呈淡黄色时,加入少许淀粉,平行滴定三次,平均消耗标准液
标准溶液滴定,当溶液呈淡黄色时,加入少许淀粉,平行滴定三次,平均消耗标准液 。已知:
。已知: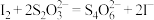 。
。
①配制待测液过程中所需的玻璃仪器有:烧杯、胶头滴管、量筒、玻璃棒、___________ 。
②滴定达到终点的现象为___________ 。
③产品中 的质量分数为
的质量分数为___________ ( 的摩尔质量为
的摩尔质量为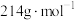 )。
)。
 (碘酸钾)常用的食盐加碘剂,某研究小组在实验室采用如下种方法进行
(碘酸钾)常用的食盐加碘剂,某研究小组在实验室采用如下种方法进行 的制备。
的制备。
已知:①
 是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。
是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。②
 在碱性条件下还原产物为一种不溶于水的沉淀。
在碱性条件下还原产物为一种不溶于水的沉淀。回答下列问题:
(1)甲装置中仪器A的名称是
(2)丁装置中发生反应的离子方程式为
(3)实验室还可以直接使用
 与KI溶液在强碱环境中制备
与KI溶液在强碱环境中制备 ,该反应的化学方程式为
,该反应的化学方程式为(4)反应结束后,将装置丙中溶液经如下操作可得到较为纯净的
 晶体:
晶体:
在获取碘酸钾产品的操作中,下列说法正确的是___________(填序号)。
| A.加热浓缩过程中需要使用三脚架、泥三角和坩埚等仪器 |
| B.在冷却结晶时,温度过低可能会有杂质析出导致产品不纯净 |
| C.采用“抽滤”代替“过滤”可使过滤速率加快 |
| D.为提高洗涤效果,可用热水进行洗涤 |
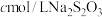 标准溶液滴定,当溶液呈淡黄色时,加入少许淀粉,平行滴定三次,平均消耗标准液
标准溶液滴定,当溶液呈淡黄色时,加入少许淀粉,平行滴定三次,平均消耗标准液 。已知:
。已知: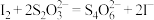 。
。①配制待测液过程中所需的玻璃仪器有:烧杯、胶头滴管、量筒、玻璃棒、
②滴定达到终点的现象为
③产品中
 的质量分数为
的质量分数为 的摩尔质量为
的摩尔质量为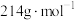 )。
)。
您最近半年使用:0次



