名校
解题方法
1 . 如图是某常见非金属元素的价类二维图。下列说法正确的是
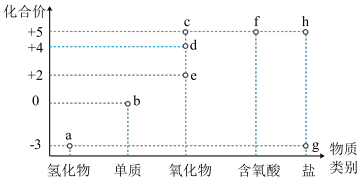

| A.c、d、e中,只有c、d是酸性氧化物 |
| B.一定条件下,a与氧气能一步反应生成d |
| C.g和h不可能是同一种物质 |
| D.一定条件下,a和e能反应生成b |
您最近一年使用:0次
2 . 下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是
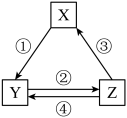

| 选项 | X | Y | Z | 对应过程的反应条件 |
| A | Fe | FeCl3 | FeCl2 | ①氯气,加热 |
| B | NaOH | NaHCO3 | Na2CO3 | ②加热 |
| C | CaO | Ca(OH)2 | CaCO3 | ①常温加水 |
| D | N2 | NO | NO2 | ③NH3、催化剂加热 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 氨气催化氧化是高中化学教学中的一个重要实验,对于氨气性质和硝酸工业生产过程的教学有着非常重要的作用。某化学兴趣小组设计如下实验装置(部分装置省略)探究氨气的催化氧化。
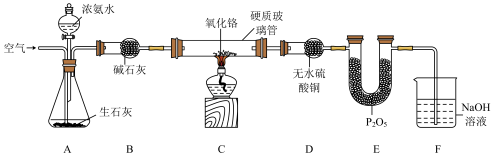
已知:氧化铬(Cr2O3)为催化剂;P2O5为酸性氧化物。
回答下列问题:
(1)在组装好装置,装入药品前,需要进行的操作是_______ ;氨气的电子式为_______ 。
(2)一段时间后无水硫酸铜变蓝,此时硬质玻璃管内氨气与氧气发生反应生成两种氧化物的化学方程式为_______ ,熄灭酒精灯,继续通入空气,此时可看到Cr2O3会持续红热,说明该反应为_______ (填“吸”或“放”)热反应。
(3)无水硫酸铜变蓝一段时间后,硬质玻璃管内会有红棕色气体产生。E装置的作用是_______ ;F装置用于吸收红棕色气体,吸收过程中生成等物质的量的两种可溶性盐,该反应的离子方程式为_______ ;若缺少F装置,排放的尾气可能造成的环境危害为_______ (填一种)。
(4)实验室也可以利用氯化铵和消石灰为原料制备氨气,该反应的化学方程式为_______ ,可以用_______ (填标号)检验有氨气生成。
a.无色酚酞溶液 b.湿润的蓝色石蕊试纸 c.浓盐酸 d.浓硫酸

已知:氧化铬(Cr2O3)为催化剂;P2O5为酸性氧化物。
回答下列问题:
(1)在组装好装置,装入药品前,需要进行的操作是
(2)一段时间后无水硫酸铜变蓝,此时硬质玻璃管内氨气与氧气发生反应生成两种氧化物的化学方程式为
(3)无水硫酸铜变蓝一段时间后,硬质玻璃管内会有红棕色气体产生。E装置的作用是
(4)实验室也可以利用氯化铵和消石灰为原料制备氨气,该反应的化学方程式为
a.无色酚酞溶液 b.湿润的蓝色石蕊试纸 c.浓盐酸 d.浓硫酸
您最近一年使用:0次
2023-08-31更新
|
244次组卷
|
2卷引用:黑龙江哈尔滨第三中学2024届高三上学期期中考试化学试题
4 . 部分含N及Cl物质的分类与相应化合价关系如图所示,下列推断不合理 的是
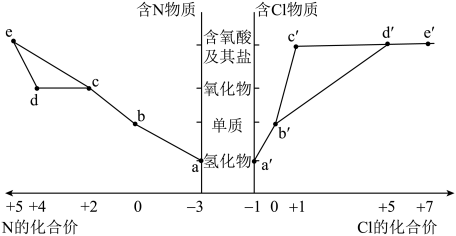

| A.工业上通过a→c→d→e来制备HNO3 |
| B.a→b的过程是氮的固定 |
| C.浓的a′溶液和浓的c′溶液反应可以得到b′ |
| D.加热d′的固态钾盐可以产生O2 |
您最近一年使用:0次
2022-11-25更新
|
99次组卷
|
2卷引用:黑龙江省绥化市第一中学2022-2023学年高三上学期期中考试化学试题
5 . 部分含N及S物质的分类与相应化合价之间的关系如图所示,下列推断合理的是


| A.在催化剂的作用下,a可将c、d氧化为b |
| B.用玻璃棒分别随取浓的a溶液和浓的e溶液,玻璃棒靠近时有白烟产生 |
| C.a分别溶于d'的溶液和e'的溶液所得的盐溶液均显碱性 |
| D.常温下,Fe能溶于浓的e溶液,不能溶于浓的e'溶液 |
您最近一年使用:0次
2022-10-12更新
|
181次组卷
|
3卷引用:黑龙江省齐齐哈尔市八校联合体2022-2023学年高三上学期期中考试化学试题
名校
6 . 下列每步转化不能通过一步反应就实现的是
| A.NH3→NO→NO2→HNO3 | B.Si→SiO2→H2SiO3→Na2SiO3 |
| C.S→SO2→SO3→H2SO4 | D.Fe→FeCl2→Fe(OH)2→Fe(OH)3 |
您最近一年使用:0次
2021-12-13更新
|
556次组卷
|
2卷引用:黑龙江省鸡东县第二中学2021-2022学年高三上学期期中考试化学试题
名校
解题方法
7 . 一种新型的合成氨的方法如图所示.下列说法正确的是
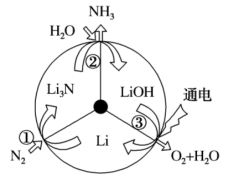

A.反应①中 发生了氧化反应 发生了氧化反应 | B.反应①和②均属于“氮的固定” |
C.反应③为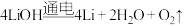 | D.三步循环的总结果为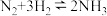 |
您最近一年使用:0次
2021-05-22更新
|
1271次组卷
|
16卷引用:黑龙江省齐齐哈尔普高联谊校2023-2024学年高三上学期11月期中考试化学试题
黑龙江省齐齐哈尔普高联谊校2023-2024学年高三上学期11月期中考试化学试题江西省九校2021-2022学年高三上学期期中联考化学试题贵州省贵阳、铜仁、六盘水市、黔南州2021届高三5月适应性考试(二)理综化学试题(已下线)专题13 氮及其化合物 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练 安徽省皖南八校2022届高三上学期摸底联考化学试题山东省潍坊市临朐县实验中学2022届高三9月摸底考试化学试题宁夏平罗中学2021-2022学年高三上学期第一次月考化学试题辽宁省沈阳市郊联体2022届高三10月月考化学试题河北省安平中学2021-2022学年高三上学期第二次月考化学试题湖南省长沙市雅礼中学2023届高三上学期月考(二)化学试题安徽省亳州市蒙城第一中学东校区2022-2023学年高三上学期第四次月考化学试题安徽省/安庆市怀宁县第二中学2022-2023学年高三第二次化学月考化学试题湖南省常德市第一中学2023届高三第五次月考化学试题湖南省衡阳市第一中学2023届高三下学期第四次月考化学试题安徽省淮北市树人高级中学2020-2021学年高二下学期期末考试化学试题四川省广安友谊中学2021-2022学年上学期高二10月月考化学试题
名校
8 . (1) 20世纪前,黑火药是世界上唯一的火箭推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为:S+2KNO3+3C═K2S+N2↑+3CO2。
①写出N2的电子式 :___________
②已知SO2和氯水反应会生成两种强酸,其离子方程式为___________
③请设计实验检验上述含氧酸根离子:___________
(2)排放二氧化硫、氮氧化物均会危害环境,必须对它们进行处理。。处理氮氧化物的方法很多,以下列举几种常见方法。
①用过量NaOH溶液吸收NO2气体。所得溶液中除含有NaOH和NaNO2,还含有___________ 。
②为避免污染,常给汽车安装尾气净化装置。净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。
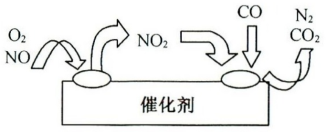
写出净化过程中的总化学反应方程式:___________
③请写出NH3与少量氯气反应的化学方程式:___________
(3)写出过氧化钠与水反应的化学方程式:___________
①写出N2的电子式 :
②已知SO2和氯水反应会生成两种强酸,其离子方程式为
③请设计实验检验上述含氧酸根离子:
(2)排放二氧化硫、氮氧化物均会危害环境,必须对它们进行处理。。处理氮氧化物的方法很多,以下列举几种常见方法。
①用过量NaOH溶液吸收NO2气体。所得溶液中除含有NaOH和NaNO2,还含有
②为避免污染,常给汽车安装尾气净化装置。净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。

写出净化过程中的总化学反应方程式:
③请写出NH3与少量氯气反应的化学方程式:
(3)写出过氧化钠与水反应的化学方程式:
您最近一年使用:0次
名校
9 . 氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是____________ 。
②氨催化氧化生成一氧化氮反应的化学方程式是___________ 。
(2)氨的定量检测。水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:
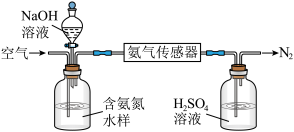
① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:_______________ 。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol,则水样中氨氮(以氨气计)含量为________ mg·L-1。
(3)氨的转化与去除。 微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
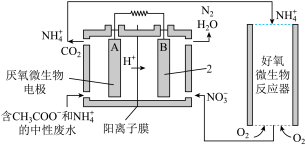
已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式:_______ 。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是
②氨催化氧化生成一氧化氮反应的化学方程式是
(2)氨的定量检测。水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:

① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol,则水样中氨氮(以氨气计)含量为
(3)氨的转化与去除。 微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。

已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式:
您最近一年使用:0次
真题
10 . 右图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是
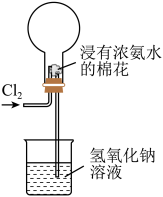

| A.烧瓶中立即出现白烟 |
| B.烧瓶中立即出现红棕色 |
| C.烧瓶中发生的反应表明常温下氨气有还原性 |
| D.烧杯中的溶液是为了吸收有害气体 |
您最近一年使用:0次
2019-01-30更新
|
313次组卷
|
8卷引用:2012届黑龙江省哈师大附中高三上学期期中考试化学试卷



