1 .  是最常见的硫的氧化物,某小组利用如图所示的装置制备并检验其性质。下列说法正确的是
是最常见的硫的氧化物,某小组利用如图所示的装置制备并检验其性质。下列说法正确的是
 是最常见的硫的氧化物,某小组利用如图所示的装置制备并检验其性质。下列说法正确的是
是最常见的硫的氧化物,某小组利用如图所示的装置制备并检验其性质。下列说法正确的是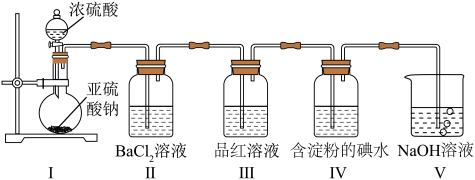
| A.装置Ⅰ中浓硫酸体现强氧化性 |
| B.装置Ⅱ无明显变化,实验结束后向其中通入空气,也无明显变化 |
C.装置Ⅲ中现象证明 具有漂白性,装置Ⅳ中现象证明 具有漂白性,装置Ⅳ中现象证明 具有氧化性 具有氧化性 |
| D.装置V中使用酸性高锰酸钾溶液也可达到实验目的 |
您最近一年使用:0次
2 .  具有氧化性、还原性和漂白性,某同学在实验室利用
具有氧化性、还原性和漂白性,某同学在实验室利用 做相关验证和探究实验。回答下列问题:
做相关验证和探究实验。回答下列问题:
(1)用如图1装置(夹持仪器已省略)验证 具有氧化性。
具有氧化性。 的名称为
的名称为___________ 。
②装置甲试管中反应的离子方程式为___________ 。
③说明 具有氧化性的现象为
具有氧化性的现象为___________ 。
(2)该同学设计如图2所示装置(夹持仪器已省略)制备 (难溶解于水中)。
(难溶解于水中)。 的作用是
的作用是___________ 。
②三颈烧瓶中反应的化学方程式为___________ 。
(3)该实验体现了 的性质是
的性质是___________ 。
(4)实验表明,将纯净的 缓缓地通入到
缓缓地通入到 溶液中,得到
溶液中,得到 沉淀。为了探究该反应中的氧化剂,该同学提出以下假设:
沉淀。为了探究该反应中的氧化剂,该同学提出以下假设:
假设Ⅰ:溶液中的 ;
;
假设Ⅱ:溶解在水中的氧气。
①验证假设Ⅰ(配制溶液前已将蒸馏水煮沸并密封冷却)。
实验i现象为___________ ,实验ii的现象为___________ 。
②验证假设Ⅱ。请完成下列表格:
实验iv的步骤为___________ ,实验目的是___________ 。
 具有氧化性、还原性和漂白性,某同学在实验室利用
具有氧化性、还原性和漂白性,某同学在实验室利用 做相关验证和探究实验。回答下列问题:
做相关验证和探究实验。回答下列问题:(1)用如图1装置(夹持仪器已省略)验证
 具有氧化性。
具有氧化性。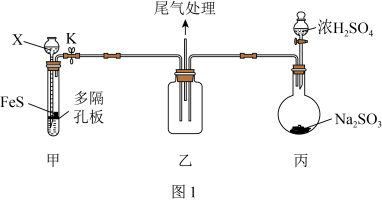
 的名称为
的名称为②装置甲试管中反应的离子方程式为
③说明
 具有氧化性的现象为
具有氧化性的现象为(2)该同学设计如图2所示装置(夹持仪器已省略)制备
 (难溶解于水中)。
(难溶解于水中)。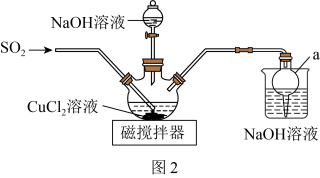
 的作用是
的作用是②三颈烧瓶中反应的化学方程式为
(3)该实验体现了
 的性质是
的性质是(4)实验表明,将纯净的
 缓缓地通入到
缓缓地通入到 溶液中,得到
溶液中,得到 沉淀。为了探究该反应中的氧化剂,该同学提出以下假设:
沉淀。为了探究该反应中的氧化剂,该同学提出以下假设:假设Ⅰ:溶液中的
 ;
;假设Ⅱ:溶解在水中的氧气。
①验证假设Ⅰ(配制溶液前已将蒸馏水煮沸并密封冷却)。
| 实验步骤 | 实验操作 | 实验现象 | 结论 |
实验 | 向 溶液中缓慢通入纯净的 溶液中缓慢通入纯净的 气体 气体 | 假设I成立 | |
实验 | 向 溶液的烧杯中缓慢通入纯净的 溶液的烧杯中缓慢通入纯净的 气体 气体 |
②验证假设Ⅱ。请完成下列表格:
| 实验步骤 | 实验现象 | 实验目的 | |
| 实验iii | 同实验 步骤 步骤 | 同实验 的相关现象 的相关现象 | 作对照实验 |
| 实验iv | 产生白色沉淀 | ||
您最近一年使用:0次
2024-02-23更新
|
648次组卷
|
8卷引用:黑龙江省牡丹江市第一高级中学2023-2024学年高一下学期5月期中考试化学试题
黑龙江省牡丹江市第一高级中学2023-2024学年高一下学期5月期中考试化学试题江西省部分学校2023-2024学年高三上学期2月月考化学试题(已下线)专题03 常见气体的实验室制取(考题猜想)(6大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)四川省绵阳中学2023-2024学年高三下学期2月开学考理科综合-高中化学(已下线)大题02 化学实验综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)2024届内蒙古自治区乌海市第六中学高三下学期第三次模拟考试理综试题-高中化学河南省郑州市第五高级中学2023-2024学年高三2月开学考理综试题-高中化学四川省广元市川师大万达中学2023-2024学年高一下学期3月月考化学试题
3 . 根据实验目的,装置、现象及对应反应的离子方程式或化学方程式均正确的是
| 选项 | 目的 | 装置 | 现象 | 离子方程式或化学方程式 |
| A | 实验室乙酸乙酯制备 |  | ②中试管溶液分层,产生有特殊香味的物质 | CH3COOH+CH3CH2OH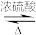 CH3COOCH2CH3+H2O CH3COOCH2CH3+H2O |
| B | 验证SO2的性质 | 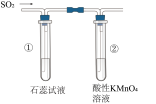 | ①先变红后褪色②中颜色变浅 | 5SO2+2H2O+2MnO =5SO =5SO +2Mn2++4H+ +2Mn2++4H+ |
| C | 实验室快速制取氯气 |  | 产生黄绿色气体 | 10Cl-+16H++2MnO =2Mn2++5Cl2↑+8H2O =2Mn2++5Cl2↑+8H2O |
| D | 检验NH |  | 蓝色石蕊试纸变红 | NH +OH- +OH- NH3↑+H2O NH3↑+H2O |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
20-21高一·浙江·阶段练习
名校
解题方法
4 . 根据要求完成下列各小题实验目的。(a、b为弹簧夹,(加热及固定装置已略去)
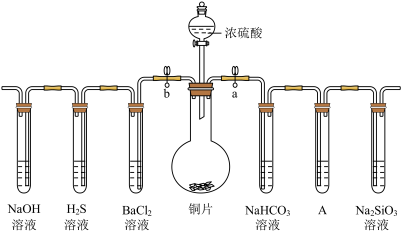
(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
①连接仪器、___________ 、加药品后,打开a关闭b,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是___________ 。装置A中试剂是___________ 。
③能说明碳的非金属性比硅强的实验现象是___________ 。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①在(1)①操作后打开b,关闭a。
②一段时间后,H2S溶液中的现象是___________ ,化学方程式是___________ 。
③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
写出其中SO2显示还原性生成沉淀的离子方程式___________ 。

(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
①连接仪器、
②铜与浓硫酸反应的化学方程式是
③能说明碳的非金属性比硅强的实验现象是
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①在(1)①操作后打开b,关闭a。
②一段时间后,H2S溶液中的现象是
③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
您最近一年使用:0次
2021-03-11更新
|
516次组卷
|
3卷引用:黑龙江省鹤岗市第一中学2020-2021学年高一4月月考化学试题
名校
解题方法
5 . 根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)
① 连接仪器、________ 、加药品后,打开a关闭b,然后滴入浓硫酸,加热。
② 铜与浓硫酸反应的化学方程式是_______ 。装置A中试剂是_______ 。
③ 能说明碳的非金属性比硅强的实验现象是_________ 。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
① 在(1)①操作后打开b,关闭a。
② H2S溶液中有浅黄色浑浊出现,化学方程式是____ 。
③ BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
写出其中SO2显示还原性生成沉淀的离子方程式_________ 。
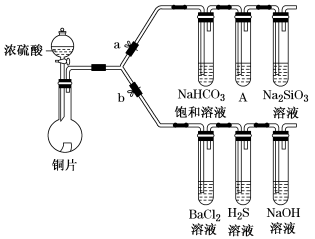
① 连接仪器、
② 铜与浓硫酸反应的化学方程式是
③ 能说明碳的非金属性比硅强的实验现象是
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
① 在(1)①操作后打开b,关闭a。
② H2S溶液中有浅黄色浑浊出现,化学方程式是
③ BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
您最近一年使用:0次
2020-03-06更新
|
148次组卷
|
6卷引用:2014-2015黑龙江省哈尔滨师大附中高一下学期第一次月考化学试卷
名校
6 . 用如图所示的装置进行实验(夹持及尾气处理仪器略去),能达到实验目的的是
| 选项 |  中试剂 中试剂 |  中试剂 中试剂 |  中试剂 中试剂 | 实验目的 | 装置 |
| A | 浓盐酸 |  | 无 | 制取并收集 |  |
| B | 浓氨水 | 生石灰 | 浓硫酸 | 制备纯净的 | |
| C | 稀硫酸 |  | 硅酸钠溶液 | 比较非金属性强弱: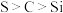 | |
| D | 浓硫酸 |  | 品红溶液 | 验证 具有漂白性 具有漂白性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7 . CuI是有机合成的一种催化剂,受热易氧化。实验室可通过向CuSO4与NaI的混合溶液中通入SO2制备CuI(2CuSO4+2NaI+SO2+2H2O 2CuI↓+2H2SO4+Na2SO4)。下列实验原理和装置不能达到实验目的的是( )
2CuI↓+2H2SO4+Na2SO4)。下列实验原理和装置不能达到实验目的的是( )
 2CuI↓+2H2SO4+Na2SO4)。下列实验原理和装置不能达到实验目的的是( )
2CuI↓+2H2SO4+Na2SO4)。下列实验原理和装置不能达到实验目的的是( )A. 制备SO2 制备SO2 |
B. 制备CuI并制备少量含SO2的溶液 制备CuI并制备少量含SO2的溶液 |
C.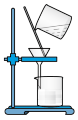 将CuI与母液分离并用装置制得的含SO2的溶液洗涤沉淀 将CuI与母液分离并用装置制得的含SO2的溶液洗涤沉淀 |
D. 加热干燥湿的CuI固体 加热干燥湿的CuI固体 |
您最近一年使用:0次
2019-05-24更新
|
810次组卷
|
6卷引用:【全国百强校】黑龙江省大庆市铁人中学2020届高三上学期开学考试化学试题
名校
8 .  和
和 是主要的大气污染物。某小组认为一定条件下,用
是主要的大气污染物。某小组认为一定条件下,用 与
与 反应转化为无污染物质可进行汽车尾气无害化处理。
反应转化为无污染物质可进行汽车尾气无害化处理。
(1)氨气的制备
①实验室制氨气的化学方程式为___________ 。
②制备和收集纯净、干燥的氨气,可以选择下图装置___________ (填字母),C中试剂为___________ 。
(2)氨气与二氧化氮的反应(已知: )。
)。

①在硬质玻璃管Y中加入少量催化剂,将 气体注入Y管中,Z中应盛装
气体注入Y管中,Z中应盛装___________ 。
②打开 ,将注射器X中的
,将注射器X中的 缓慢注入Y中,发生反应的化学方程式为
缓慢注入Y中,发生反应的化学方程式为___________ 。
③将注射器活塞退回原处并固定,待装置恢复到室温,打开K2,Y中出现倒吸现象,原因
是___________ 。
(3)该小组进一步研究 的性质,探究
的性质,探究 能否与
能否与 发生氧化还原反应。实验室用铜丝和浓硫酸反应生成
发生氧化还原反应。实验室用铜丝和浓硫酸反应生成 的化学方程式为
的化学方程式为___________ 。利用(2)中装置,将Y中的药品更换为少量 ,将注射器X中
,将注射器X中 缓慢推入Y中,Y装置中淡黄色粉末颜色变成白色。设计方案检验生成的白色物质中含有
缓慢推入Y中,Y装置中淡黄色粉末颜色变成白色。设计方案检验生成的白色物质中含有 ,其方案为
,其方案为___________ 。
 和
和 是主要的大气污染物。某小组认为一定条件下,用
是主要的大气污染物。某小组认为一定条件下,用 与
与 反应转化为无污染物质可进行汽车尾气无害化处理。
反应转化为无污染物质可进行汽车尾气无害化处理。(1)氨气的制备
①实验室制氨气的化学方程式为
②制备和收集纯净、干燥的氨气,可以选择下图装置

(2)氨气与二氧化氮的反应(已知:
 )。
)。
①在硬质玻璃管Y中加入少量催化剂,将
 气体注入Y管中,Z中应盛装
气体注入Y管中,Z中应盛装②打开
 ,将注射器X中的
,将注射器X中的 缓慢注入Y中,发生反应的化学方程式为
缓慢注入Y中,发生反应的化学方程式为③将注射器活塞退回原处并固定,待装置恢复到室温,打开K2,Y中出现倒吸现象,原因
是
(3)该小组进一步研究
 的性质,探究
的性质,探究 能否与
能否与 发生氧化还原反应。实验室用铜丝和浓硫酸反应生成
发生氧化还原反应。实验室用铜丝和浓硫酸反应生成 的化学方程式为
的化学方程式为 ,将注射器X中
,将注射器X中 缓慢推入Y中,Y装置中淡黄色粉末颜色变成白色。设计方案检验生成的白色物质中含有
缓慢推入Y中,Y装置中淡黄色粉末颜色变成白色。设计方案检验生成的白色物质中含有 ,其方案为
,其方案为
您最近一年使用:0次
2022-09-14更新
|
238次组卷
|
6卷引用:黑龙江省佳木斯市第十二中学2022-2023学年高二上学期开学考试化学试题
名校
解题方法
9 . 某化学兴趣小组利用铜跟浓硫酸反应,探究 的部分性质,并利用
的部分性质,并利用 制备食品抗氧化剂焦亚硫酸钠(
制备食品抗氧化剂焦亚硫酸钠( )。已知
)。已知 溶于水即生成
溶于水即生成 。
。
I.制取 并探究其性质
并探究其性质

(1)装置A中发生反应的化学方程式为___________ 。
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是___________ (填序号):
①水 ②饱和的 溶液 ③饱和的
溶液 ③饱和的 溶液 ④酸性
溶液 ④酸性
(3)装置C和D中产生的现象相同,但原因却不同。C中是由于 与溶液中的
与溶液中的 反应使碱性减弱,而D中则是由于
反应使碱性减弱,而D中则是由于 具有
具有___________ 性。
(4)若实验中用一定质量的铜片和
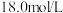 的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为
的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为 ,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾
,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾___________ mol。
Ⅱ.焦亚硫酸钠的应用及含量测定
(5)向某些饮料中添加少量焦亚硫酸钠( ),可降低饮料中溶解氧的含量,发生反应的离子方程式为
),可降低饮料中溶解氧的含量,发生反应的离子方程式为___________ 。
(6)测定某葡萄酒中 残留量的方案为:取葡萄酒样品
残留量的方案为:取葡萄酒样品 ,加入盐酸充分蒸馏,向馏分中用
,加入盐酸充分蒸馏,向馏分中用 标准
标准 溶液进行滴定(反应方程式为
溶液进行滴定(反应方程式为 ),消耗标准
),消耗标准 溶液
溶液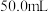 。
。
若需配制
 标准
标准 溶液,需要的玻璃仪器有烧杯、玻璃棒、
溶液,需要的玻璃仪器有烧杯、玻璃棒、___________ 。计算样品中抗氧化剂的残留量(以 计)为
计)为___________  。
。
 的部分性质,并利用
的部分性质,并利用 制备食品抗氧化剂焦亚硫酸钠(
制备食品抗氧化剂焦亚硫酸钠( )。已知
)。已知 溶于水即生成
溶于水即生成 。
。I.制取
 并探究其性质
并探究其性质
(1)装置A中发生反应的化学方程式为
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是
①水 ②饱和的
 溶液 ③饱和的
溶液 ③饱和的 溶液 ④酸性
溶液 ④酸性
(3)装置C和D中产生的现象相同,但原因却不同。C中是由于
 与溶液中的
与溶液中的 反应使碱性减弱,而D中则是由于
反应使碱性减弱,而D中则是由于 具有
具有(4)若实验中用一定质量的铜片和

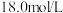 的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为
的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为 ,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾
,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾Ⅱ.焦亚硫酸钠的应用及含量测定
(5)向某些饮料中添加少量焦亚硫酸钠(
 ),可降低饮料中溶解氧的含量,发生反应的离子方程式为
),可降低饮料中溶解氧的含量,发生反应的离子方程式为(6)测定某葡萄酒中
 残留量的方案为:取葡萄酒样品
残留量的方案为:取葡萄酒样品 ,加入盐酸充分蒸馏,向馏分中用
,加入盐酸充分蒸馏,向馏分中用 标准
标准 溶液进行滴定(反应方程式为
溶液进行滴定(反应方程式为 ),消耗标准
),消耗标准 溶液
溶液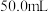 。
。若需配制

 标准
标准 溶液,需要的玻璃仪器有烧杯、玻璃棒、
溶液,需要的玻璃仪器有烧杯、玻璃棒、 计)为
计)为 。
。
您最近一年使用:0次
10 . 已知Na2SO3固体与质量分数为70%的硫酸可用于实验室制备SO2。下图是实验室制备并验证SO2某些性质的装置图。试回答:

(1)实验室制备SO2的化学方程式是_______ ,制备时不能使用稀硫酸的原因是_______ 。
(2)①中的实验现象为石蕊试液_______ 。
(3)②中的实验现象为品红溶液_______ ,证明SO2有_______ 性。
(4)③中发生反应的化学方程式是_______ ,证明SO2有_______ 性。
(5)④中发生反应的离子方程式是_______ ,证明SO2有_______ 性。

(1)实验室制备SO2的化学方程式是
(2)①中的实验现象为石蕊试液
(3)②中的实验现象为品红溶液
(4)③中发生反应的化学方程式是
(5)④中发生反应的离子方程式是
您最近一年使用:0次



