解题方法
1 . 用如图装置检验浓硫酸与木炭在加热条件下反应的产物 和
和 。
。不正确 的是
 和
和 。
。
A.①中现象说明产物中有 |
B.②中利用了 的氧化性 的氧化性 |
| C.将②③对调也能够达到实验目的 |
D.浓硫酸与木炭的反应: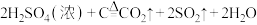 |
您最近一年使用:0次
名校
解题方法
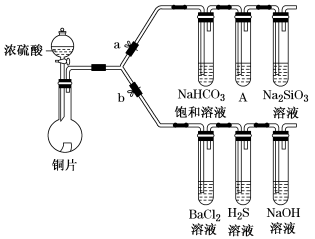
2 . 根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)
① 连接仪器、________ 、加药品后,打开a关闭b,然后滴入浓硫酸,加热。
② 铜与浓硫酸反应的化学方程式是_______ 。装置A中试剂是_______ 。
③ 能说明碳的非金属性比硅强的实验现象是_________ 。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
① 在(1)①操作后打开b,关闭a。
② H2S溶液中有浅黄色浑浊出现,化学方程式是____ 。
③ BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
写出其中SO2显示还原性生成沉淀的离子方程式_________ 。
① 连接仪器、
② 铜与浓硫酸反应的化学方程式是
③ 能说明碳的非金属性比硅强的实验现象是
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
① 在(1)①操作后打开b,关闭a。
② H2S溶液中有浅黄色浑浊出现,化学方程式是
③ BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
您最近一年使用:0次
2020-03-06更新
|
148次组卷
|
6卷引用:北京市第四中学2023-22024学年高一下学期期中考试 化学试题
3 . 实验装置不能达到实验目的的是
| A | B |
 |  |
| 稀释浓硫酸 | 制备并检验 气体 气体 |
| C | D |
 |  |
用该装置制备少量白色的 沉淀 沉淀 | 吸收 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 用如图所示的装置进行实验(夹持及尾气处理仪器略去),能达到实验目的的是
| 选项 | a中试剂 | b中试剂 | c中试剂 | 实验目的 | 装置 |
| A | 氨水 | CaO | 无 | 制取并收集氨气 |  |
| B | 浓盐酸 | MnO2 | 饱和NaCl溶液 | 制备纯净的Cl2 | |
| C | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 比较酸性强弱: H2CO3>H2SiO3 | |
| D | 浓硫酸 | Na2SO3 | KMnO4酸性溶液 | 验证SO2具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-06-13更新
|
1811次组卷
|
12卷引用:北京市朝阳区2020届高三第二次学业水平等级性考试化学试题
北京市朝阳区2020届高三第二次学业水平等级性考试化学试题北京市海淀区中关村中学2022届高三下学期三模化学试题北京市第十二中学2021-2022学年高一下学期6月月考化学试题北京十二中2021-2022学年高一下学期六月月考(等级考)化学试题(已下线)小题必刷17 碳、硅与无机非金属材料——2021年高考化学一轮复习小题必刷(通用版)山东省潍坊第一中学2021届高三上学期开学检测化学试题山东省枣庄滕州一中2021届高三10月月考化学试题山东省德州市2021届高三上学期期中考试化学试题(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记湖南省常德市芷兰实验中学2020-2021学年高一下学期第一次月考化学试题江西省九校2021-2022学年高三上学期期中联考化学试题(已下线)专题23 化学实验基础性选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
5 . 某小组同学探究 与
与 溶液的反应。
溶液的反应。
(1)实验Ⅰ:用如下装置(夹持、加热仪器略)制备 ,将
,将 通入
通入 溶液中。
溶液中。 ;静置9h后,溶液变为浅绿色。
;静置9h后,溶液变为浅绿色。
①浓 与Cu反应的化学方程式是
与Cu反应的化学方程式是_______ 。
②试剂a是_______ 。
(2)分析C中溶液颜色变化的原因。
①溶液颜色由黄色最终变为浅绿色的原因是_______ 。(写离子方程式)。
②针对溶液颜色变为红棕色,提出了两种假设。
假设1:主要与 、
、 有关。
有关。
假设2:主要与 、
、 有关。
有关。
实验Ⅱ证实假设1不成立,假设2成立。
实验Ⅱ:向 溶液中加入
溶液中加入 溶液,
溶液,_______ (填现象),然后滴加_______ (填试剂),溶液变为黄色。
(3)进一步探究 与
与 、
、 显红棕色的原因。
显红棕色的原因。
查阅资料: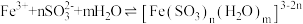 (红棕色)
(红棕色)
实验Ⅲ:向 溶液中滴加
溶液中滴加 溶液,溶液由黄色变成红棕色,析出大量橙黄色沉淀。
溶液,溶液由黄色变成红棕色,析出大量橙黄色沉淀。
甲同学认为橙黄色沉淀中可能含有 、
、 、
、 ,并设计如下检验方案。
,并设计如下检验方案。 溶液褪色不能证明橙黄色沉淀中含有
溶液褪色不能证明橙黄色沉淀中含有 ,理由是
,理由是_______ 。
②实验证实橙黄色沉淀中含有 、不含
、不含 ,试剂b、c分别是
,试剂b、c分别是_______ 、_______ 。
(4)实验反思:实验I静置5min后溶液颜色由红棕色变回黄色可能的原因是_______ 。
 与
与 溶液的反应。
溶液的反应。(1)实验Ⅰ:用如下装置(夹持、加热仪器略)制备
 ,将
,将 通入
通入 溶液中。
溶液中。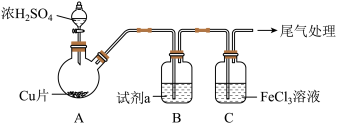
 ;静置9h后,溶液变为浅绿色。
;静置9h后,溶液变为浅绿色。①浓
 与Cu反应的化学方程式是
与Cu反应的化学方程式是②试剂a是
(2)分析C中溶液颜色变化的原因。
①溶液颜色由黄色最终变为浅绿色的原因是
②针对溶液颜色变为红棕色,提出了两种假设。
假设1:主要与
 、
、 有关。
有关。假设2:主要与
 、
、 有关。
有关。实验Ⅱ证实假设1不成立,假设2成立。
实验Ⅱ:向
 溶液中加入
溶液中加入 溶液,
溶液,(3)进一步探究
 与
与 、
、 显红棕色的原因。
显红棕色的原因。查阅资料:
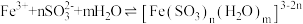 (红棕色)
(红棕色)实验Ⅲ:向
 溶液中滴加
溶液中滴加 溶液,溶液由黄色变成红棕色,析出大量橙黄色沉淀。
溶液,溶液由黄色变成红棕色,析出大量橙黄色沉淀。甲同学认为橙黄色沉淀中可能含有
 、
、 、
、 ,并设计如下检验方案。
,并设计如下检验方案。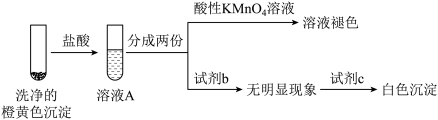
 溶液褪色不能证明橙黄色沉淀中含有
溶液褪色不能证明橙黄色沉淀中含有 ,理由是
,理由是②实验证实橙黄色沉淀中含有
 、不含
、不含 ,试剂b、c分别是
,试剂b、c分别是(4)实验反思:实验I静置5min后溶液颜色由红棕色变回黄色可能的原因是
您最近一年使用:0次
2022-11-04更新
|
684次组卷
|
6卷引用:北京市朝阳区2022-2023学年高三上学期期中考试化学试题
名校
6 . 某校化学兴趣小组拟探究SO2与Ca(NO3)2溶液的反应。
I.实验一:用如图所示装置制备SO2,然后将SO2,通入Ca( NO3)2溶液中,有白色沉淀M产生。
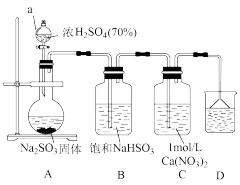
(1)A装置中发生反应的化学方程式为_______ 。仪器a的名称是_______ 。
(2)装置D的作用是_______ 。
(3)配制1mol·L-1Ca(NO3)2溶液时所用蒸馏水必须除去溶解的氧气,除氧方法是____ 。
II.根据所学知识推测:白色沉淀M可能为CaSO3或CaSO4,也可能是二者混合物。(查阅资料得知:CaSO4微溶于水; CaSO3难溶于水)
实验二:探究白色沉淀M的成分。反应后将装置C中物质转移到烧杯中静置,→b→c→得到沉淀M。取沉淀M少许于试管中,加入过量的HCl充分反应,发现沉淀部分溶解。由此可知白色沉淀M含有CaSO3。
(4)操作b, c的名称分别为_______ ,_______ 。
(5)取加入过量稀HCl静置后的上层溶液于试管中,加入一种试剂,可进一步证实沉淀M中含有CaSO3,则所加试剂及现象是_______ 。
实验三:探究 的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2溶液、有氧CaCl2溶液、无氧Ca(NO3)2溶液中,一段时间后,测溶液的pH,结果表明:①无氧CaCl2溶液中无沉淀,其他两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2溶液、有氧CaCl2溶液、无氧Ca(NO3)2溶液中,一段时间后,测溶液的pH,结果表明:①无氧CaCl2溶液中无沉淀,其他两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
(6)有氧CaCl2溶液中通入SO2发生反应的离子方程式为_______ 。
(7)从上述实验现象,你认为对SO2氧化起主要作用的是_______ (填 “O2”或“ ”),其理由是
”),其理由是_______ 。
I.实验一:用如图所示装置制备SO2,然后将SO2,通入Ca( NO3)2溶液中,有白色沉淀M产生。

(1)A装置中发生反应的化学方程式为
(2)装置D的作用是
(3)配制1mol·L-1Ca(NO3)2溶液时所用蒸馏水必须除去溶解的氧气,除氧方法是
II.根据所学知识推测:白色沉淀M可能为CaSO3或CaSO4,也可能是二者混合物。(查阅资料得知:CaSO4微溶于水; CaSO3难溶于水)
实验二:探究白色沉淀M的成分。反应后将装置C中物质转移到烧杯中静置,→b→c→得到沉淀M。取沉淀M少许于试管中,加入过量的HCl充分反应,发现沉淀部分溶解。由此可知白色沉淀M含有CaSO3。
(4)操作b, c的名称分别为
(5)取加入过量稀HCl静置后的上层溶液于试管中,加入一种试剂,可进一步证实沉淀M中含有CaSO3,则所加试剂及现象是
实验三:探究
 的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2溶液、有氧CaCl2溶液、无氧Ca(NO3)2溶液中,一段时间后,测溶液的pH,结果表明:①无氧CaCl2溶液中无沉淀,其他两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2溶液、有氧CaCl2溶液、无氧Ca(NO3)2溶液中,一段时间后,测溶液的pH,结果表明:①无氧CaCl2溶液中无沉淀,其他两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。(6)有氧CaCl2溶液中通入SO2发生反应的离子方程式为
(7)从上述实验现象,你认为对SO2氧化起主要作用的是
 ”),其理由是
”),其理由是
您最近一年使用:0次
2022-08-17更新
|
649次组卷
|
4卷引用:2022年北京高考真题变式题1-14
(已下线)2022年北京高考真题变式题1-14(已下线)2022年北京高考真题化学试题变式题(实验探究题)重庆市巴蜀中学校2021-2022学年高三下学期适应性月考(八)化学试题新疆维吾尔自治区乌鲁木齐市第101中学2023-2024学年高二上学期开学考试化学试题
7 . I.利用下图装置制备 ,并研究
,并研究 的性质。
的性质。
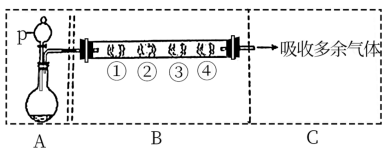
(1)A装置利用亚硫酸钠和硫酸反应制备 ,写出化学方程式
,写出化学方程式_______ 。
(2)填写下表
(3) 和氯气按照体积比
和氯气按照体积比 通入水中,溶液的漂白性
通入水中,溶液的漂白性_______ (填“增强”“减弱”“不变”)原因是_______ (用化学方程式表示)。
II.“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为 )吸收烟气中的
)吸收烟气中的 ,得到亚硫酸钠(Na2SO3)粗品。其流程如下:
,得到亚硫酸钠(Na2SO3)粗品。其流程如下:

(4)上述流程中,加入 后,发生反应的化学方程式为
后,发生反应的化学方程式为_______ 。
(5)亚硫酸钠粗品中含有少量 ,原因是
,原因是_______ 。
 ,并研究
,并研究 的性质。
的性质。
(1)A装置利用亚硫酸钠和硫酸反应制备
 ,写出化学方程式
,写出化学方程式(2)填写下表
| B中棉花的位置 | ① | ② | ③ | ④ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘水混合液 | 氢硫酸 |
| 现象 | 褪色 | 浅黄色 | ||
体现 的性质 的性质 |
(3)
 和氯气按照体积比
和氯气按照体积比 通入水中,溶液的漂白性
通入水中,溶液的漂白性II.“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为
 )吸收烟气中的
)吸收烟气中的 ,得到亚硫酸钠(Na2SO3)粗品。其流程如下:
,得到亚硫酸钠(Na2SO3)粗品。其流程如下:
(4)上述流程中,加入
 后,发生反应的化学方程式为
后,发生反应的化学方程式为(5)亚硫酸钠粗品中含有少量
 ,原因是
,原因是
您最近一年使用:0次
8 . 某小组同学在实验室设计实验验证物质的性质及其相互转化。
I.设计了下图所示的实验装置(图中固定装置已略去),进行SO2性质的研究。
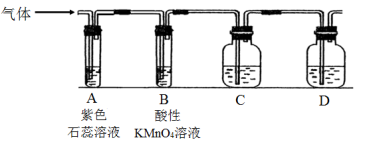
(1)从物质分类的角度,SO2属于___________ (填“酸性”或“碱性”)氧化物。
①当通入SO2时,A中紫色石蕊溶液变红,用化学用语解释其原因___________ 。
②图中C装置也可用来验证SO2具有该性质,如果可以看到明显的现象,其中所加入的试剂是___________ 。
(2)从元素化合价的角度分析,SO2具有___________ 性。
①当通入SO2一段时间后,可观察B中溶液褪色,说明SO2具有___________ 性,补充完整反应的离子方程式:___________SO2+___________MnO +___________=___________SO
+___________=___________SO +___________Mn2++___________,
+___________Mn2++___________,___________
②如验证SO2还具有另一方面的性质,可选择的药品是___________ (填字母)。
A.氯化铁溶液 B.浓硫酸 C.氯水 D.硫化钠溶液
II.设计了下图所示的实验装置模拟工业生产制备少量硝酸。
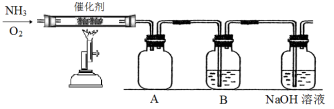
(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上,由此可知该反应是___________ 反应(填“吸热”或“放热”),反应的化学方程式是___________ 。
(4)B中试剂为___________ ,NaOH溶液的作用是___________ 。
(5)控制氨气和氧气的比例是制备硝酸的关键。
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。红棕色气体的化学式是___________ ,白烟的化学式是___________ 。
②欲使氨气尽可能完全转化为硝酸,理论上n(NH3):n(O2)的最佳比例为___________ 。
I.设计了下图所示的实验装置(图中固定装置已略去),进行SO2性质的研究。

(1)从物质分类的角度,SO2属于
①当通入SO2时,A中紫色石蕊溶液变红,用化学用语解释其原因
②图中C装置也可用来验证SO2具有该性质,如果可以看到明显的现象,其中所加入的试剂是
(2)从元素化合价的角度分析,SO2具有
①当通入SO2一段时间后,可观察B中溶液褪色,说明SO2具有
 +___________=___________SO
+___________=___________SO +___________Mn2++___________,
+___________Mn2++___________,②如验证SO2还具有另一方面的性质,可选择的药品是
A.氯化铁溶液 B.浓硫酸 C.氯水 D.硫化钠溶液
II.设计了下图所示的实验装置模拟工业生产制备少量硝酸。

(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上,由此可知该反应是
(4)B中试剂为
(5)控制氨气和氧气的比例是制备硝酸的关键。
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。红棕色气体的化学式是
②欲使氨气尽可能完全转化为硝酸,理论上n(NH3):n(O2)的最佳比例为
您最近一年使用:0次
2021-10-23更新
|
875次组卷
|
2卷引用:北京市中国农业大学附属中学2019-2020学年高一上学期期末考试化学试题
9 . 实验小组设计如图所示装置,验证SO2性质,对实验现象分析不正确的是


| A.甲中制备SO2利用了硫酸的强氧化性 |
| B.乙中红色花瓣褪色,说明SO2具有漂白性 |
| C.丙中溶液红色变浅,说明SO2能与碱溶液反应 |
| D.若验证SO2具有还原性,可在甲乙装置间增加盛有饱和NaHSO3溶液的洗气瓶 |
您最近一年使用:0次
2021-05-10更新
|
426次组卷
|
3卷引用:北京市房山区2021届高三二模化学试题
解题方法
10 . 某校化学兴趣小组探究SO2与FeCl3溶液的反应,装置如下图所示。
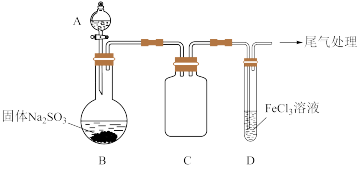
已知:
i.Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。
ii.生成Fe(HSO3)2+离子的反应为:Fe3+ +HSO ⇌Fe(HSO3)2+。
⇌Fe(HSO3)2+。
步骤一:实验准备:
如上图连接装置,并配制100mL 1.0 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管D 中。
(1)配制100mL1.0 mol·L-1 FeCl3溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和______ ,装置C的作用为:________________ 。
(2)用离子方程式解释1.0 mol·L-1 FeCl3溶液(未用盐酸酸化)pH=1的原因:________
步骤二:预测实验
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色。
该小组同学预测的理论依据为:________________
步骤三:动手实验
(4)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,将混合液放置12小时,溶液才变成浅绿色。
①SO2与FeCl3溶液反应生成了Fe(HSO3)2+离子的实验证据为:__________ 。证明浅绿色溶液中含有Fe2+的实验操作为:_____________ 。
②为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验。
综合上述实验探究过程,得出的结论为:____________ 。
步骤四:反思实验:
(5)在制备SO2的过程中,同学们发现,使用70%的硫酸比用98%的浓硫酸反应速率快,分析其中的原因是_________ 。

已知:
i.Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。
ii.生成Fe(HSO3)2+离子的反应为:Fe3+ +HSO
 ⇌Fe(HSO3)2+。
⇌Fe(HSO3)2+。步骤一:实验准备:
如上图连接装置,并配制100mL 1.0 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管D 中。
(1)配制100mL1.0 mol·L-1 FeCl3溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和
(2)用离子方程式解释1.0 mol·L-1 FeCl3溶液(未用盐酸酸化)pH=1的原因:
步骤二:预测实验
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色。
该小组同学预测的理论依据为:
步骤三:动手实验
(4)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,将混合液放置12小时,溶液才变成浅绿色。
①SO2与FeCl3溶液反应生成了Fe(HSO3)2+离子的实验证据为:
②为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验。
| 实验I | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
| 实验II | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
综合上述实验探究过程,得出的结论为:
步骤四:反思实验:
(5)在制备SO2的过程中,同学们发现,使用70%的硫酸比用98%的浓硫酸反应速率快,分析其中的原因是
您最近一年使用:0次



