名校
解题方法
1 . 实验室用酸性蚀刻废液(含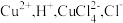 等)和碱性蚀刻废液[NH4+、Cu(NH3)42+、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
等)和碱性蚀刻废液[NH4+、Cu(NH3)42+、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
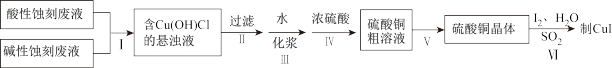
(1)步骤Ⅰ中发生了多个反应,其中 与盐酸反应生成Cu(OH)Cl的离子方程式为
与盐酸反应生成Cu(OH)Cl的离子方程式为____ 。
(2)步骤Ⅳ需控制pH为1~2,80 ℃下进行,合适的加热方式是____ 。
(3)步骤Ⅴ的具体步骤是蒸发浓缩、______ 、____ 。
(4)步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。
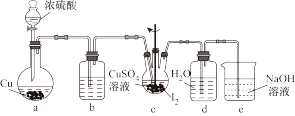
①装置a中盛装浓硫酸的仪器的名称是___ ,圆底烧瓶中发生反应的化学方程式为___ 。
②装置c中反应完成的现象是_____ 。
③用装置d中的溶液洗涤制得的CuI的目的是____ ,然后再用无水乙醇洗涤的目的是___ 。
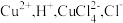 等)和碱性蚀刻废液[NH4+、Cu(NH3)42+、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
等)和碱性蚀刻废液[NH4+、Cu(NH3)42+、NH3·H2O等]制备CuI(白色固体)的实验流程如下: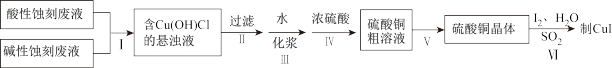
(1)步骤Ⅰ中发生了多个反应,其中
 与盐酸反应生成Cu(OH)Cl的离子方程式为
与盐酸反应生成Cu(OH)Cl的离子方程式为(2)步骤Ⅳ需控制pH为1~2,80 ℃下进行,合适的加热方式是
(3)步骤Ⅴ的具体步骤是蒸发浓缩、
(4)步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。

①装置a中盛装浓硫酸的仪器的名称是
②装置c中反应完成的现象是
③用装置d中的溶液洗涤制得的CuI的目的是
您最近一年使用:0次
2020-04-06更新
|
763次组卷
|
5卷引用:河南等省五岳2020届高三4月联考(全国I卷)理综化学试题
河南等省五岳2020届高三4月联考(全国I卷)理综化学试题河南省临颍县南街高级中学2020届高三下学期第一次月考理综化学试题(已下线)考点15 金属元素及其化合物-2020年高考化学命题预测与模拟试题分类精编江西省九江市十校2020届高三下学期模拟考试理综化学试题(已下线)专题16 化学实验综合题-2020年高考真题和模拟题化学分项汇编
2 . 如图是实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。下列有关说法正确的是
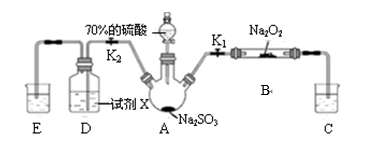

| A.为防止环境污染,装置C和E中的试剂均取用饱和的石灰水 |
| B.关闭 K2,打开 K1,滴加硫酸,则装置 B 中每消耗1mol Na2O2,转移1mol电子 |
| C.关闭 K1,打开 K2,试剂 X 是酸性 KMnO4 或 FeCl3 溶液,均可证明 SO2 有还原性 |
| D.实验过程中体现了硫酸的酸性、吸水性、难挥发性、强氧化性 |
您最近一年使用:0次
2018-10-22更新
|
465次组卷
|
4卷引用:河南省辉县市第一高级中学2019届高三上学期第二次月考化学试题
名校
3 . 过氧化钙可用于治理赤潮、应急供氧等。已知:过氧化钙,为白色或淡黄色结晶粉末,难溶于水,不溶于乙醇、乙醚等有机溶剂,常温下干燥品很稳定,能溶于稀酸生成过氧化氢。某小组同学探究过氧化钙的制法和性质:
(1)甲、乙两位同学设计的过氧化钙实验室制法如下,其中产率较低的是______ (填A、B)
方法A Ca (OH)2(s) + H2O2⇌CaO2(s) + 2H2O
方法B CaCl2(s) + H2O2⇌CaO2(s) + 2HCl
方法A所得产品中纯度不高,所含杂质主要是___________ (填化学式)
如果不加入稳定剂,则两种方法都需在5℃以下进行实验,原因可能是______________ 。
(2)丙同学认为CO2、SO2与过氧化钙的反应原理相同,丁同学认为SO2具有较强的还原性,而CO2没有,故而反应原理不相同。他们设计了如下实验装置,通过测量装置E中所得气体体积判断反应情况:
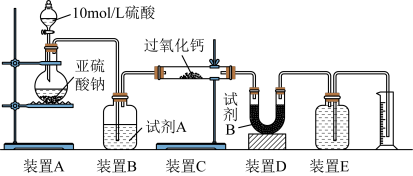
①试剂B的作用是____________________ 。
②若实验中SO2足量,且与过氧化钙充分反应,取反应后的固体进行探究,以验证过氧化钙与SO2反应的生成物。若SO2未被氧化,则反应的化学方程式为:______________________________ 。
③装置E中收集到的氧气体积为V L(已换算成标准状况下),若SO2完全被氧化,则V =______ 。
(3)某工厂利用电石渣(主要成分为氢氧化钙)生产过氧化钙的生产流程如下:
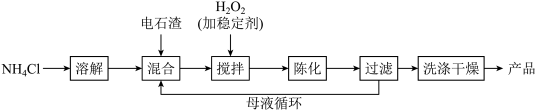
用上述方法制备过氧化钙(CaO2·8H2O),搅拌步骤 的化学方程式是______________ 。
②某小组采用单变量法确定温度、H2O2浓度对产率的影响,结果如下,则实际生产应选择的适宜条件为__________ 。
(1)甲、乙两位同学设计的过氧化钙实验室制法如下,其中产率较低的是
方法A Ca (OH)2(s) + H2O2⇌CaO2(s) + 2H2O
方法B CaCl2(s) + H2O2⇌CaO2(s) + 2HCl
方法A所得产品中纯度不高,所含杂质主要是
如果不加入稳定剂,则两种方法都需在5℃以下进行实验,原因可能是
(2)丙同学认为CO2、SO2与过氧化钙的反应原理相同,丁同学认为SO2具有较强的还原性,而CO2没有,故而反应原理不相同。他们设计了如下实验装置,通过测量装置E中所得气体体积判断反应情况:

①试剂B的作用是
②若实验中SO2足量,且与过氧化钙充分反应,取反应后的固体进行探究,以验证过氧化钙与SO2反应的生成物。若SO2未被氧化,则反应的化学方程式为:
③装置E中收集到的氧气体积为V L(已换算成标准状况下),若SO2完全被氧化,则V =
(3)某工厂利用电石渣(主要成分为氢氧化钙)生产过氧化钙的生产流程如下:

用上述方法制备过氧化钙(CaO2·8H2O),
②某小组采用单变量法确定温度、H2O2浓度对产率的影响,结果如下,则实际生产应选择的适宜条件为
| H2O2% | 30% | 25% | 20% | 15% | 10% | 5% |
| 产率 | 60.40 | 62.42 | 64.54 | 63.20 | 63.10 | 62.40 |
| 温度(℃) | 50 | 40 | 30 | 20 | 10 | 0 |
| 产率 | 43.24 | 52.80 | 64.54 | 63.80 | 60.45 | 52.40 |
您最近一年使用:0次
2020-01-06更新
|
636次组卷
|
4卷引用:河南省周口市扶沟高中2020届高三第一次模拟考试理综化学试题
名校
4 . 甲、乙两组同学用不同的方法制备SO2并探究其性质。(夹持装置已略去)
I.甲组同学设计的实验装置如图所示,回答下列问题:
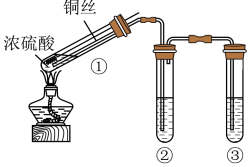
(1)试管①中反应的化学方程式是__________ 。
(2)试管②中的品红溶液褪色。欲证明品红褪色的原因是SO2,需要补充的实验操作及应出现的实验现象是__________ 。
(3)试管③中的试剂是NaOH溶液,反应的离子方程式 是___________ 。
Ⅱ .乙组同学设计的实验装置如下图所示,回答下列问题:
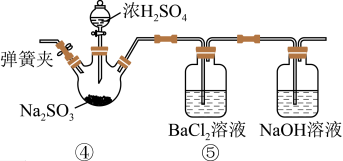
已知: BaSO3是白色难溶于水的物质,但可溶解于盐酸。
(4)④中反应的化学方程式是__________ 。
(5)⑤中产生了不溶于盐酸的白色沉淀,该沉淀是___________ 。
(6)经过分析,乙组同学认为装置中的空气是出现白色沉淀的原因。他们在不改变实验装置的情况下加入了某操作过程,证实了这种猜测是正确的。他们的操作及实验现象 是__________ 。
I.甲组同学设计的实验装置如图所示,回答下列问题:

(1)试管①中反应的化学方程式是
(2)试管②中的品红溶液褪色。欲证明品红褪色的原因是SO2,需要补充的实验操作及应出现的实验现象是
(3)试管③中的试剂是NaOH溶液,反应的
Ⅱ .乙组同学设计的实验装置如下图所示,回答下列问题:

已知: BaSO3是白色难溶于水的物质,但可溶解于盐酸。
(4)④中反应的化学方程式是
(5)⑤中产生了不溶于盐酸的白色沉淀,该沉淀是
(6)经过分析,乙组同学认为装置中的空气是出现白色沉淀的原因。他们在不改变实验装置的情况下加入了某操作过程,证实了这种猜测是正确的。他们的
您最近一年使用:0次
2019-03-03更新
|
640次组卷
|
4卷引用:河南名校联盟2020-2021学年高一下学期开学考试化学试题
名校
5 . 溴化亚铜可用于彩色照相,是一种白色结晶状粉末,见光分解,在空气中会慢慢氧化成绿色,溶于氢溴酸、盐酸、硝酸和氨水,在热水中也会发生分解。实验室制备CuBr的装置示意图和步骤如下:
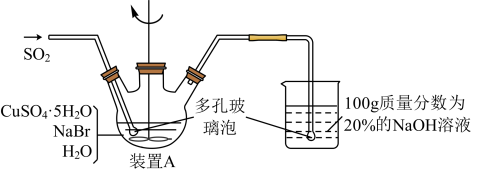
实验步骤:
①在装置A中加入50.0gCuSO4·5H2O、30.9gNaBr、150 mL蒸馏水,60℃时不断搅拌,以适当流速通入SO2;
②溶液冷却后倾去上层清液,在避光的条件下过滤;
③依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤;
④在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥3~4 h,再经氢气流干燥,最后进行真空干燥,得到产品21.6g。
回答下列问题:
(1)步骤②中过滤需要避光的原因是___________ 。
(2)步骤①中实验所用蒸馏水事先要进行的处理操作是___________ ,控制反应在60℃条件下进行,实验中可采取的措施是___________ 。
(3)步骤③中洗涤剂需“溶有SO2”的原因是___________ ;最后洗涤剂改用乙醚的目的是___________ 。
(4)装置A中反应生成CuBr的离子方程式为___________ ;说明反应已完成的现象是___________ 。
(5)本实验产品的产率是___________ 。

实验步骤:
①在装置A中加入50.0gCuSO4·5H2O、30.9gNaBr、150 mL蒸馏水,60℃时不断搅拌,以适当流速通入SO2;
②溶液冷却后倾去上层清液,在避光的条件下过滤;
③依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤;
④在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥3~4 h,再经氢气流干燥,最后进行真空干燥,得到产品21.6g。
回答下列问题:
(1)步骤②中过滤需要避光的原因是
(2)步骤①中实验所用蒸馏水事先要进行的处理操作是
(3)步骤③中洗涤剂需“溶有SO2”的原因是
(4)装置A中反应生成CuBr的离子方程式为
(5)本实验产品的产率是
您最近一年使用:0次
2017-05-15更新
|
502次组卷
|
3卷引用:河南省南阳市第一中学2018届高三第十四次考试理科综合化学试题
名校
6 . 过碳酸钠(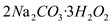 )是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:
)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:
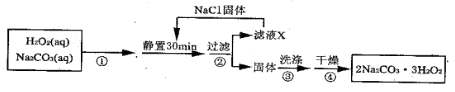
已知主反应: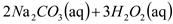

 ∆H<0
∆H<0
副反应: 50℃时
50℃时 开始分解
开始分解
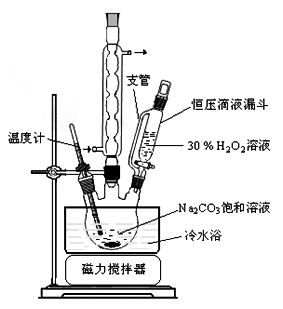
请回答下列问题:
(1)步骤①的关键是_____________ ,其原因是______________________ 。
(2)在滤液X中加入适量NaCl固体的目的是________________________ 。
(3)步骤③中选用无水乙醇洗涤产品的目的是_______________________ 。
(4)下列物质中,会引起过碳酸钠失效的有____________ 。
A.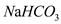 B.
B. C.
C.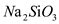 D.HCl
D.HCl
(5)过碳酸钠的产品中往往含有少量碳酸钠,可用重量法测定过碳酸钠的质量分数;其操作步骤:取样品溶液→加入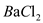 溶液→过滤→洗涤→干燥→称重。需直接测定的物理量有:样品的质量
溶液→过滤→洗涤→干燥→称重。需直接测定的物理量有:样品的质量 g,沉淀的质量
g,沉淀的质量 g,则产品中过碳酸钠质量分数的表达式为:
g,则产品中过碳酸钠质量分数的表达式为:___________ 。
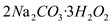 )是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:
)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:
已知主反应:
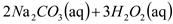

 ∆H<0
∆H<0副反应:
 50℃时
50℃时 开始分解
开始分解
请回答下列问题:
(1)步骤①的关键是
(2)在滤液X中加入适量NaCl固体的目的是
(3)步骤③中选用无水乙醇洗涤产品的目的是
(4)下列物质中,会引起过碳酸钠失效的有
A.
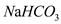 B.
B. C.
C.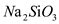 D.HCl
D.HCl(5)过碳酸钠的产品中往往含有少量碳酸钠,可用重量法测定过碳酸钠的质量分数;其操作步骤:取样品溶液→加入
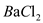 溶液→过滤→洗涤→干燥→称重。需直接测定的物理量有:样品的质量
溶液→过滤→洗涤→干燥→称重。需直接测定的物理量有:样品的质量 g,沉淀的质量
g,沉淀的质量 g,则产品中过碳酸钠质量分数的表达式为:
g,则产品中过碳酸钠质量分数的表达式为:
您最近一年使用:0次
2018-02-28更新
|
662次组卷
|
2卷引用:河南省六市2017届高三下学期第一次联考理综化学试题
名校
解题方法
7 . 下列装置及其使用说法正确的是
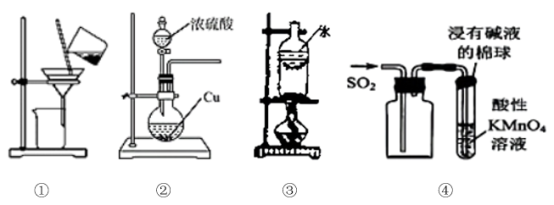

| A.用装置①分离胶体和溶液 | B.用装置②制备SO2 |
| C.用装置③分离NaCl和I2 | D.用装置④收集SO2并验证其漂白性 |
您最近一年使用:0次
2017-11-05更新
|
811次组卷
|
7卷引用:河南省信阳高级中学2017-2018学年高一4月月考化学试题
8 . CaS可用于制备发光漆、用作脱毛剂、杀虫剂、硫脲等,还用于医药工业、重金属处理及环保中。某化学探究小组在实验室中利用反应: CaSO4+C CaS+CaO+SO2↑+CO↑+CO2↑制备硫化钙并检验产物,可选用的装置如下。回答下列问题:
CaS+CaO+SO2↑+CO↑+CO2↑制备硫化钙并检验产物,可选用的装置如下。回答下列问题:
已知:①C及E ~ H中的试剂均为足量。
②酸性KMnO4溶液作氧化剂时,锰元素被还原成Mn2+
③CaS与H2O反应生成Ca(OH)2和H2S。
(1)实验1:若只检验生成物中是否含有CO,可采用的装置组合为______ (按气流方向,填字母组合),生成物中存在CO的现象是________________________ 。
(2)实验2:若只检验生成物中是否含有CO2,可采用的最简单的装置组合为______ (按气流方向,填字母组合),除去SO2的离子方程式为__________________________ 。
(3)实验3:若同时检验CO2和SO2,采用的装置组合为_______ (按气流方向,填字母组合)。
(4)若制备反应的条件完全相同,将产生的气体全部通入上述实验装置中,得到的有关数据如下表:
写出CaSO4和焦炭在高温条件下反应生成CaS的化学方程式:_______________ 。
(5)为了证明硫化钙的化学式设计如下实验:将一定质量(m1)的样品溶于足量的饱和Na2CO3溶液中,通过____ 操作,称得固体质量为m2,则表示硫化钙组成的计算式为n(Ca):n(S)=__________ (用含m1、m2的代数式表示)。
 CaS+CaO+SO2↑+CO↑+CO2↑制备硫化钙并检验产物,可选用的装置如下。回答下列问题:
CaS+CaO+SO2↑+CO↑+CO2↑制备硫化钙并检验产物,可选用的装置如下。回答下列问题:

已知:①C及E ~ H中的试剂均为足量。
②酸性KMnO4溶液作氧化剂时,锰元素被还原成Mn2+
③CaS与H2O反应生成Ca(OH)2和H2S。
(1)实验1:若只检验生成物中是否含有CO,可采用的装置组合为
(2)实验2:若只检验生成物中是否含有CO2,可采用的最简单的装置组合为
(3)实验3:若同时检验CO2和SO2,采用的装置组合为
(4)若制备反应的条件完全相同,将产生的气体全部通入上述实验装置中,得到的有关数据如下表:
| 实验前 | 实验后 | |
| 实验1 | 装置C硬质玻璃管连同CuO质量为26.80 g | 装置C硬质玻璃管连同反应后固体质量为26.64 g |
| 实验2 | 装置G连同溶液质量为187.50g | 装置G连同反应后溶液及沉淀的质量为188.38 g |
| 实验3 | 装置D、H连同溶液质量和为373.60g | 装置D、H连同溶液质量和为374.24 g |
(5)为了证明硫化钙的化学式设计如下实验:将一定质量(m1)的样品溶于足量的饱和Na2CO3溶液中,通过
您最近一年使用:0次



