名校
1 . 下列有关Na2CO3与NaHCO3叙述正确的是
| A.相同条件下,两种固体的溶解度:Na2CO3<NaHCO3 |
| B.可以用澄清石灰水来鉴别Na2CO3溶液和NaHCO3溶液 |
| C.不慎将浓硫酸沾到皮肤上,应立即用大量水冲洗,然后用3%~5%的Na2CO3溶液冲洗 |
| D.将足量稀盐酸分别加入到等物质的量的两种粉末中,产生CO2的质量相等 |
您最近一年使用:0次
2023-12-05更新
|
225次组卷
|
5卷引用:陕西省榆林市十校联考2023-2024学年高一上学期12月月考化学试题
解题方法
2 . 现有含 NaCl、Na2CO3·10H2O 和 NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的(  2和 H2O 的质量,来确定该混合物中各组分的质量分数。
2和 H2O 的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持装置已省略)组装好实验装置后,首先进行的操作是_______ 。
②称取样品,并将其放入硬质玻璃管中;称量盛装浓硫酸的洗气瓶C的质量和盛装碱石灰的U形管 D 的质量。
③打开活塞 K1、K2,关闭 K3,缓缓鼓入空气数分钟,其目的是_______ 。
④关闭K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B 中发生反应的化学方程式为 Na2CO3
 Na2CO3
Na2CO3 、
、_______ 。
(2)关于该实验方案,请回答下列问题。
①若加热前不鼓入空气,对NaCl的质量分数测定结果的影响是_______ (填“偏大”、“偏小”或“无影响”)。
②E 处干燥管中盛放的药品是_______ ,其作用是_______ ;如果实验中没有该装置,会导致测量结果中  3的质量分数
3的质量分数_______ (填“偏大”、“偏小”或“无影响”)。
③若样品质量为 w g,反应后 C、D 装置增加的质量分别为 m1 g、m2 g,则混合物中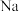 2
2 3
3 2
2 )的质量分数为
)的质量分数为_______ (用含w、m1、m2的代数式表示,不必化简)。
 2和 H2O 的质量,来确定该混合物中各组分的质量分数。
2和 H2O 的质量,来确定该混合物中各组分的质量分数。
(1)实验步骤:
①按图(夹持装置已省略)组装好实验装置后,首先进行的操作是
②称取样品,并将其放入硬质玻璃管中;称量盛装浓硫酸的洗气瓶C的质量和盛装碱石灰的U形管 D 的质量。
③打开活塞 K1、K2,关闭 K3,缓缓鼓入空气数分钟,其目的是
④关闭K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B 中发生反应的化学方程式为 Na2CO3

 Na2CO3
Na2CO3 、
、(2)关于该实验方案,请回答下列问题。
①若加热前不鼓入空气,对NaCl的质量分数测定结果的影响是
②E 处干燥管中盛放的药品是
 3的质量分数
3的质量分数③若样品质量为 w g,反应后 C、D 装置增加的质量分别为 m1 g、m2 g,则混合物中
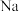 2
2 3
3 2
2 )的质量分数为
)的质量分数为
您最近一年使用:0次
2023-12-03更新
|
138次组卷
|
2卷引用:陕西省汉中市校际2023-2024学年高一上学期期中联考化学试题
解题方法
3 . 化学反应经常伴随着颜色变化。请回答下列问题:

(1)过氧化钠固体呈_______ 色,向装置甲中加入水后形成无色溶液,其离子反应方程式为_______ 。
(2)写出制备氯水时发生的化学反应方程式_______ ,向装置乙的新制氯水中加入紫色石蕊试液,现象是_______ ;装置丙中有气泡产生的原因是_______ (用化学方程式表示)。
(3)向装置丁中加入硝酸银溶液有白色沉淀生成,该反应的离子方程式为_______ 。
(4)向碳酸钠溶液中滴入2滴酚酞溶液后,溶液呈_______ 色,向该溶液中通入一定量的二氧化碳,反应的离子方程式为_______ 。

(1)过氧化钠固体呈
(2)写出制备氯水时发生的化学反应方程式
(3)向装置丁中加入硝酸银溶液有白色沉淀生成,该反应的离子方程式为
(4)向碳酸钠溶液中滴入2滴酚酞溶液后,溶液呈
您最近一年使用:0次
2023-12-03更新
|
60次组卷
|
2卷引用:陕西省汉中市校际2023-2024学年高一上学期期中联考化学试题
名校
解题方法
4 . Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:已知 在低温下溶解度较小。
在低温下溶解度较小。
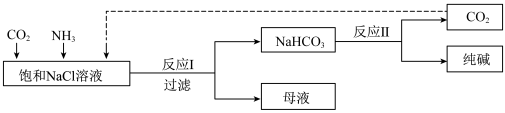
(1)一定温度下,往一定量饱和NaCl溶液中先通入___________ 达到饱和后,再不断通入另一种气体,一段时间后,出现沉淀,过滤得到 晶体。
晶体。
(2)得到的 晶体中可能含有少量NaCl、
晶体中可能含有少量NaCl、 等杂质,检验该晶体中是否含有氯离子杂质的操作方法是
等杂质,检验该晶体中是否含有氯离子杂质的操作方法是___________ 。
(3) 和
和 是两种常见的钠盐,
是两种常见的钠盐, 和
和 溶于水溶液均显
溶于水溶液均显___________ (填“酸性”、“中性”或“碱性”)。写出向饱和碳酸钠溶液中通入 的离子方程式
的离子方程式___________ 。
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中 的含量。
的含量。
(4)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若___________ ,说明装置不漏气。
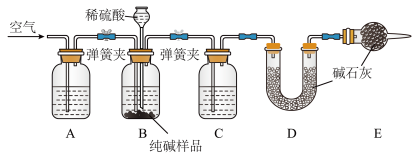
(5)装置A中的试剂为___________ ,装置C中的试剂为___________ 。
(6)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中 的质量分数为
的质量分数为___________ (保留小数点后一位):若缺少E装置,会使测定结果___________ (填“偏高”或“偏低”)。
 在低温下溶解度较小。
在低温下溶解度较小。
(1)一定温度下,往一定量饱和NaCl溶液中先通入
 晶体。
晶体。(2)得到的
 晶体中可能含有少量NaCl、
晶体中可能含有少量NaCl、 等杂质,检验该晶体中是否含有氯离子杂质的操作方法是
等杂质,检验该晶体中是否含有氯离子杂质的操作方法是(3)
 和
和 是两种常见的钠盐,
是两种常见的钠盐, 和
和 溶于水溶液均显
溶于水溶液均显 的离子方程式
的离子方程式Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中
 的含量。
的含量。(4)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若

(5)装置A中的试剂为
(6)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2023-12-03更新
|
77次组卷
|
2卷引用:陕西省西安市碑林区教育局2023-2024学年高一上学期期中教育质量监测化学试题
名校
5 . 下列有关除去杂质(括号内为杂质)的操作中正确的是
A. ( ( ):通过足量碱石灰 ):通过足量碱石灰 |
B. 固体( 固体( ):对固体进行加热 ):对固体进行加热 |
C. ( ( ):将混合气体通过灼热的铜网 ):将混合气体通过灼热的铜网 |
D. 溶液( 溶液( ):加入适量的 ):加入适量的 溶液,过滤 溶液,过滤 |
您最近一年使用:0次
2023-12-01更新
|
162次组卷
|
3卷引用:陕西省咸阳市武功县普集高级中学2023-2024学年高一上学期12月月考化学试题
6 . 下列除去物质中少量杂质的方法正确的是
| 选项 | 物质 | 杂质 | 除去杂质的方法 |
| A | Na2CO3固体 | NaHCO3 | 将固体混合物加热至恒重 |
| B | NaHCO3溶液 | Na2CO3 | 加入适量硫酸 |
| C | Cl2 | HCl | 通过盛有饱和碳酸钠溶液的洗气 |
| D | FeCl3溶液 | CuCl2 | 加入过量铁粉,过滤 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-01更新
|
275次组卷
|
2卷引用:陕西省西安市铁一中学2023-2024学年高一上学期第二次月考化学试题
7 . 下列实验方案中,不能测定 和
和 混合物中
混合物中 质量分数的是
质量分数的是
 和
和 混合物中
混合物中 质量分数的是
质量分数的是A.取 混合物与足量 混合物与足量 溶液充分反应,过滤、洗涤、低温干燥、称重,得 溶液充分反应,过滤、洗涤、低温干燥、称重,得 固体 固体 |
B.取 混合物充分加热,减重 混合物充分加热,减重 |
C.取 混合物与足量稀硫酸充分反应,将产生的气体用盛有碱石灰的干燥管吸收,干燥管增重 混合物与足量稀硫酸充分反应,将产生的气体用盛有碱石灰的干燥管吸收,干燥管增重 |
D.取 混合物与足量 混合物与足量 溶液充分反应,过滤、洗涤、低温干燥、称重,得 溶液充分反应,过滤、洗涤、低温干燥、称重,得 固体 固体 |
您最近一年使用:0次
2023-11-30更新
|
64次组卷
|
2卷引用:陕西省安康市2023-2024学年高一上学期期中考试化学试题
名校
8 . 侯氏制碱法为我国纯碱工业做出了重要贡献。
I.某化学兴趣小组模拟侯氏制碱法制备 ,进一步处理得到
,进一步处理得到 和
和 ,实验流程如图:
,实验流程如图:
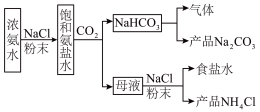
回答下列问题:
(1)生成 的总反应的化学方程式为
的总反应的化学方程式为___________ 。
II.实验中制得的纯碱中含有少量NaCl,该小组设计如图所示装置,测定实验得到的纯碱中 的含量。
的含量。
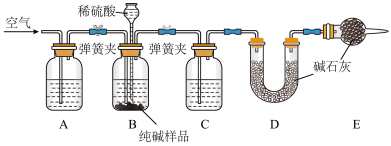
(2)装置A中的试剂为___________ ,装置C中的试剂为___________ 。
(3)实验结束后通入空气的目的:___________ 。
(4)实验前称取26.50g样品,实验后测得D装置增重8.80g,则样品中 的质量分数为
的质量分数为___________ (保留2位小数)。按照以上装置及操作,有同学提出测定结果可能会偏大,他的理由是___________ 。
I.某化学兴趣小组模拟侯氏制碱法制备
 ,进一步处理得到
,进一步处理得到 和
和 ,实验流程如图:
,实验流程如图:
回答下列问题:
(1)生成
 的总反应的化学方程式为
的总反应的化学方程式为II.实验中制得的纯碱中含有少量NaCl,该小组设计如图所示装置,测定实验得到的纯碱中
 的含量。
的含量。
(2)装置A中的试剂为
(3)实验结束后通入空气的目的:
(4)实验前称取26.50g样品,实验后测得D装置增重8.80g,则样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2023-11-30更新
|
129次组卷
|
2卷引用:陕西省西安铁一中滨河高级中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
9 . 下列离子方程式中正确的是
A.用氯气作为水的消毒剂: |
B.把过氧化钠投入水中: |
C.Fe片放入稀盐酸中: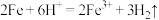 |
D.用小苏打治疗胃酸过多的反应: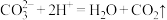 |
您最近一年使用:0次
2023-11-29更新
|
261次组卷
|
2卷引用:陕西省西安市铁一中学2023-2024学年高一上学期第二次月考化学试题
名校
解题方法
10 . 以不同类别物质间的转化为线索,认识钠及其化合物。不正确 的是
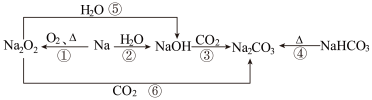
A.反应③为NaOH与过量 反应 反应 |
B.反应④说明 的稳定性强于 的稳定性强于 |
| C.②是放热反应 |
| D.上述转化中发生的反应有分解反应、化合反应、置换反应 |
您最近一年使用:0次
2023-11-29更新
|
125次组卷
|
2卷引用:陕西省西安市雁塔区第二中学2023-2024学年高一上学期第二次阶段性测评化学试题



