名校
1 . 某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
(1)KClO4中氯元素的化合价是___________ 。
(2)Fe2O3可处理产生的Na,反应为6Na+Fe2O3=3Na2O+ 2Fe,反应中Na做___________ (填“还原剂”或“氧化剂”)。
(3)NaHCO3是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式是___________ 。
(4)按如图所示装置实验,可得到“Na2CO3的热稳定性比NaHCO3强”的结论,证据是___________ 。
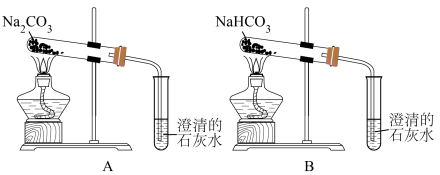
(1)KClO4中氯元素的化合价是
(2)Fe2O3可处理产生的Na,反应为6Na+Fe2O3=3Na2O+ 2Fe,反应中Na做
(3)NaHCO3是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式是
(4)按如图所示装置实验,可得到“Na2CO3的热稳定性比NaHCO3强”的结论,证据是

您最近一年使用:0次
2 . 某小组同学对比Na2CO3和NaHCO3的性质,进行了如下实验。
(1)向相同体积、相同浓度的Na2CO3和NaHCO3溶液中分别滴加0.1mol•L-1的盐酸,溶液pH变化如下。
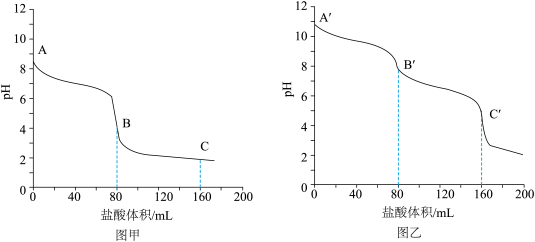
①图____ (填“甲”或“乙”)是NaHCO3的滴定曲线。
②A´—B´发生反应的离子方程式为___________ 。
③下列说法正确的是_________ (填序号)。
a.Na2CO3和NaHCO3溶液中加入饱和石灰水,均有沉淀生成
b.A和A´对应溶液中:c(Na+)+c(H+)=2c( )+c(
)+c( )+c(OH-)
)+c(OH-)
c.B和B´对应溶液中:水的电离程度前者大
d.C和C´对应溶液中:NaCl的物质的量相等
(2)向1mol•L-1的Na2CO3和NaHCO3溶液中分别滴加少量FeCl2溶液,均产生白色沉淀。
查阅资料:i.1mol•L-1的NaHCO3溶液中,c( )=1×10-2mol•L-1,c(OH-)=2×10-6mol•L-1
)=1×10-2mol•L-1,c(OH-)=2×10-6mol•L-1
ii.25℃时,Ksp(FeCO3)=3.2×10-11,Ksp[Fe(OH)2]=5.0×10-17
通过计算判断NaHCO3与FeCl2反应产生的沉淀是FeCO3,还是Fe(OH)2?_______ (要求有计算过程)。
(1)向相同体积、相同浓度的Na2CO3和NaHCO3溶液中分别滴加0.1mol•L-1的盐酸,溶液pH变化如下。

①图
②A´—B´发生反应的离子方程式为
③下列说法正确的是
a.Na2CO3和NaHCO3溶液中加入饱和石灰水,均有沉淀生成
b.A和A´对应溶液中:c(Na+)+c(H+)=2c(
 )+c(
)+c( )+c(OH-)
)+c(OH-)c.B和B´对应溶液中:水的电离程度前者大
d.C和C´对应溶液中:NaCl的物质的量相等
(2)向1mol•L-1的Na2CO3和NaHCO3溶液中分别滴加少量FeCl2溶液,均产生白色沉淀。
查阅资料:i.1mol•L-1的NaHCO3溶液中,c(
 )=1×10-2mol•L-1,c(OH-)=2×10-6mol•L-1
)=1×10-2mol•L-1,c(OH-)=2×10-6mol•L-1ii.25℃时,Ksp(FeCO3)=3.2×10-11,Ksp[Fe(OH)2]=5.0×10-17
通过计算判断NaHCO3与FeCl2反应产生的沉淀是FeCO3,还是Fe(OH)2?
您最近一年使用:0次
3 . 海洋是一个巨大的化学资源宝库,其中钠元素是海洋中含量较高的元素。
(1)已知在太阳光作用下,绿色植物体内的叶绿素能将水、CO2转化为葡萄糖。海水吸收CO2并进行碳循环的原理示意图如下:
(2)某同学欲用碳酸钠晶体(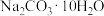 )配制220mL1mol/L的Na2CO3溶液。
)配制220mL1mol/L的Na2CO3溶液。
①所需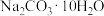 的质量为
的质量为___________ g。
②实验中除需要托盘天平(带砝码)、药匙、量筒、烧杯、玻璃棒、试剂瓶外,还需要的玻璃仪器有___________ 。
③配制溶液时正确的操作顺序是:_________ (填字母,下同)
计算→称量→___________→___________→___________→___________→___________→装瓶贴标签。
a.转移 b.定容 c.摇匀 d.洗涤 e.溶解
④下列实验操作会使配制溶液浓度偏高的是___________ 。
A.容量瓶清洗后,未经过干燥处理
B.定容时,俯视刻度线
C.定容后倒转容量瓶几次,发现液面最低点低于刻度线,再补加几滴水至刻度线
D.所用碳酸钠晶体失去结晶水
(1)已知在太阳光作用下,绿色植物体内的叶绿素能将水、CO2转化为葡萄糖。海水吸收CO2并进行碳循环的原理示意图如下:
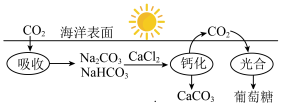
| A.CO2是碱性氧化物 |
| B.等质量的NaHCO3和Na2CO3分别与足量的盐酸反应,前者产生的二氧化碳气体较多 |
C.碳酸氢钠的电离方程式为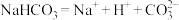 |
| D.该循环过程中未涉及氧化还原反应 |
(2)某同学欲用碳酸钠晶体(
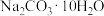 )配制220mL1mol/L的Na2CO3溶液。
)配制220mL1mol/L的Na2CO3溶液。①所需
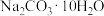 的质量为
的质量为②实验中除需要托盘天平(带砝码)、药匙、量筒、烧杯、玻璃棒、试剂瓶外,还需要的玻璃仪器有
③配制溶液时正确的操作顺序是:
计算→称量→___________→___________→___________→___________→___________→装瓶贴标签。
a.转移 b.定容 c.摇匀 d.洗涤 e.溶解
④下列实验操作会使配制溶液浓度偏高的是
A.容量瓶清洗后,未经过干燥处理
B.定容时,俯视刻度线
C.定容后倒转容量瓶几次,发现液面最低点低于刻度线,再补加几滴水至刻度线
D.所用碳酸钠晶体失去结晶水
您最近一年使用:0次
2024-01-25更新
|
58次组卷
|
2卷引用:陕西省汉中市汉台区2023-2024学年高一上学期1月期末化学试题
名校
解题方法
4 . 化学是一门实用性很强的科学,请根据题意填空:
(1)铝合金和碳纤维复合材料是飞机、火箭的常用材料,这主要利用了它们具有的共同性能是密度___________ (填“大”或“小”),铝的在地壳中的含量比铁___________ (填“多”或“少”)。
(2)铝制餐具不宜长时间存放酸性、碱性食物,说明Al2O3属于___________ 氧化物,写出氧化铝与NaOH溶液反应的离子反应方程式___________ 。
(3)面粉发酵时会产生有机酸(用HA表示其化学式),影响口感。我们可以加入膨松剂(主要含NaHCO3),那么蒸出来的馒头蓬松柔软,且口感好。若加入过量的膨松剂,请写出相关反应的化学方程式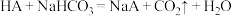 ,
,___________ ,由以上反应可知,酸性HA___________ H2CO3。
(4)电子工业用FeCl3溶液制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:___________ ,某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:首先取少量待测溶液﹐滴入___________ (填写试剂的名称)溶液呈红色,则溶液中含有的Fe3+,另取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、洗涤、干燥,称量沉淀质量为43.05g,则待测液中Cl-的物质的量浓度为___________ 。
(1)铝合金和碳纤维复合材料是飞机、火箭的常用材料,这主要利用了它们具有的共同性能是密度
(2)铝制餐具不宜长时间存放酸性、碱性食物,说明Al2O3属于
(3)面粉发酵时会产生有机酸(用HA表示其化学式),影响口感。我们可以加入膨松剂(主要含NaHCO3),那么蒸出来的馒头蓬松柔软,且口感好。若加入过量的膨松剂,请写出相关反应的化学方程式
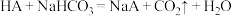 ,
,(4)电子工业用FeCl3溶液制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
您最近一年使用:0次
名校
解题方法
5 . 以食盐为钠源制备纯碱的一种工艺流程如图。
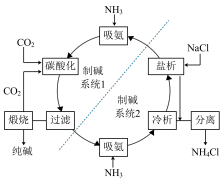
(1)熔融氯化钠可以导电是因为___________ (用化学用语解释)。
(2)电解熔融NaCl可制得单质钠,钠与水反应的化学方程式为___________ 。
(3)需要100mL0.1mol/L的NaCl溶液,配制时需用托盘天平称取NaCl固体___________ g。
(4)制碱系统1中,饱和食盐水吸氨后通入过量CO2碳酸化,过滤。
①滤渣的成分是___________ (填化学式),煅烧滤渣制取纯碱的化学方程式为___________ 。
②滤渣成分可作膨松剂,制馒头时与食醋(CH3COOH)共用效果更佳,相关的离子方程式为______ 。
(5)该流程中,可以循环利用的物质有CO2和___________ 。

(1)熔融氯化钠可以导电是因为
(2)电解熔融NaCl可制得单质钠,钠与水反应的化学方程式为
(3)需要100mL0.1mol/L的NaCl溶液,配制时需用托盘天平称取NaCl固体
(4)制碱系统1中,饱和食盐水吸氨后通入过量CO2碳酸化,过滤。
①滤渣的成分是
②滤渣成分可作膨松剂,制馒头时与食醋(CH3COOH)共用效果更佳,相关的离子方程式为
(5)该流程中,可以循环利用的物质有CO2和
您最近一年使用:0次
名校
解题方法
6 . 回答下列问题
(1)除去Na2CO3粉末中的NaHCO3固体,用化学方程式表示___________ ;
(2)除去MgO中混有的Al2O3,用离子方程式表示___________ ;
(3)除去FeCl3溶液中的FeCl2,用离子方程式表示___________ 。
(1)除去Na2CO3粉末中的NaHCO3固体,用化学方程式表示
(2)除去MgO中混有的Al2O3,用离子方程式表示
(3)除去FeCl3溶液中的FeCl2,用离子方程式表示
您最近一年使用:0次
7 . 化学来源于生活,且应用于生活。
Ⅰ.根据所学化学知识,完成下列填空;
(1)FeO是一种黑色粉末,不稳定,在空气里受热迅速被氧化成一种复杂的具有磁性的化合物,该化合物的化学式是________(填序号)。
(2)钠有多种化合物,其中在加工馒头、面包和饼干等产品时,可用作膨松剂的是_____ (填“NaHCO3”或“Na2CO3”)。
(3)开盖后的铁强化酱油(铁元素以Fe2+存在)久置于空气中易导致补铁效果不佳,主要原因是其中的铁元素由+2价升高到+3价,此转化过程体现了Fe2+的_______ (填“氧化性”或“还原性")。
(4)我国四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成,爆炸时的化学反应方程式:S+2KNO3+3C K2S+N2↑+3CO2↑,则反应中氧化剂是_______(填序号)。
K2S+N2↑+3CO2↑,则反应中氧化剂是_______(填序号)。
Ⅱ.实验室配制250mL0.20mol/L的Na2SO4溶液。
(5)计算:在托盘天平上称量硫酸钠固体_____ 克。
(6)配制上述溶液,一定不需要的仪器是______(填序号)。
(7)配制过程中的正确操作顺序是:①②_____ ⑤(填序号);
①在天平上称出硫酸钠固体,把它倒入烧杯中,用适量蒸馏水使它完全溶解并冷却至室温。
②将制得的溶液转移至容量瓶。
③继续向容量瓶中加蒸馏水至液面离刻度线1~2cm时,改用胶头滴管滴加蒸馏水至溶液凹液面的最低处与刻度线相切。
④用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,每次洗涤的液体都注入容量瓶,并轻轻摇动容量瓶,使溶液混合均匀。
⑤盖好容量瓶瓶塞,反复上下颠倒、摇匀。
(8)下列操作将导致所配制的Na2SO4溶液浓度偏大的是_____(填序号)。
Ⅰ.根据所学化学知识,完成下列填空;
(1)FeO是一种黑色粉末,不稳定,在空气里受热迅速被氧化成一种复杂的具有磁性的化合物,该化合物的化学式是________(填序号)。
| A.Fe2O3 | B.Fe3O4 | C.FeS2 | D.Fe(OH)3 |
(2)钠有多种化合物,其中在加工馒头、面包和饼干等产品时,可用作膨松剂的是
(3)开盖后的铁强化酱油(铁元素以Fe2+存在)久置于空气中易导致补铁效果不佳,主要原因是其中的铁元素由+2价升高到+3价,此转化过程体现了Fe2+的
(4)我国四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成,爆炸时的化学反应方程式:S+2KNO3+3C
 K2S+N2↑+3CO2↑,则反应中氧化剂是_______(填序号)。
K2S+N2↑+3CO2↑,则反应中氧化剂是_______(填序号)。| A.S | B.KNO3 | C.N2和K2S | D.S和KNO3 |
Ⅱ.实验室配制250mL0.20mol/L的Na2SO4溶液。
(5)计算:在托盘天平上称量硫酸钠固体
(6)配制上述溶液,一定不需要的仪器是______(填序号)。
A. | B. | C. | D. |
(7)配制过程中的正确操作顺序是:①②
①在天平上称出硫酸钠固体,把它倒入烧杯中,用适量蒸馏水使它完全溶解并冷却至室温。
②将制得的溶液转移至容量瓶。
③继续向容量瓶中加蒸馏水至液面离刻度线1~2cm时,改用胶头滴管滴加蒸馏水至溶液凹液面的最低处与刻度线相切。
④用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,每次洗涤的液体都注入容量瓶,并轻轻摇动容量瓶,使溶液混合均匀。
⑤盖好容量瓶瓶塞,反复上下颠倒、摇匀。
(8)下列操作将导致所配制的Na2SO4溶液浓度偏大的是_____(填序号)。
| A.定容时俯视容量瓶刻度线 |
| B.转移溶液后未洗涤烧杯内壁和玻璃棒 |
| C.转移溶液至容量瓶过程中有Na2SO4溶液溅出瓶外 |
| D.定容加水时超过刻度线,用胶头滴管吸出多余液体 |
您最近一年使用:0次
2024-01-23更新
|
79次组卷
|
2卷引用:湖南省邵阳市2023-2024学年高一上学期1月期末联考化学试题
名校
解题方法
8 . 某汽车安全气囊的产气药主要含有KClO4、Fe2O3、NaHCO3、NaN3等物质。当汽车发生碰撞时,产气药产生大量气体使气囊迅速膨胀,从而起到保护作用。
回答下列问题:
(1)KClO4、Fe2O3、NaHCO3、NaN3四种物质中,属于氧化物的是___________ 。
(2)KClO4是助氧化剂,其中氯元素的化合价为___________ 。
(3)Fe2O3是主氧化剂,与Na发生置换反应,还原产物为___________ 。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为___________ 。
(5)NaN3是气体发生剂,受热分解产生N2和Na,N2和Na的物质的量之比为___________ 。
回答下列问题:
(1)KClO4、Fe2O3、NaHCO3、NaN3四种物质中,属于氧化物的是
(2)KClO4是助氧化剂,其中氯元素的化合价为
(3)Fe2O3是主氧化剂,与Na发生置换反应,还原产物为
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为
(5)NaN3是气体发生剂,受热分解产生N2和Na,N2和Na的物质的量之比为
您最近一年使用:0次
名校
解题方法
9 . 有以下物质:①氯气 ②铁 ③氯化铵 ④氢氧化钠 ⑤氯化钠 ⑥二氧化碳 ⑦醋酸⑧过氧化钠 ⑨碳酸氢钠 ⑩碳酸钠
(1)写出①在②中燃烧的化学方程式__________ 。
(2)写出④溶液与⑦溶液混合的离子方程式__________ 。
(3)写出电解熔融⑤的化学方程式__________ 。
(4)写出③在水溶液中的电离方程式 __________ ,检验其阳离子的实验方法对应的离子方程式为__________ 。
(5)选择以上物质按要求写出可以生成碳酸钠的化学方程式:
氧化还原反应__________
非氧化还原反应__________
(6)若有⑨和⑩两种固体混合物 ,加入足量的盐酸充分反应,可以得到
,加入足量的盐酸充分反应,可以得到 的气体(标准状况),则该混合物中两种固体的物质的量比为⑨∶⑩=
的气体(标准状况),则该混合物中两种固体的物质的量比为⑨∶⑩=__________ 。
(1)写出①在②中燃烧的化学方程式
(2)写出④溶液与⑦溶液混合的离子方程式
(3)写出电解熔融⑤的化学方程式
(4)写出③在水溶液中的
(5)选择以上物质按要求写出可以生成碳酸钠的化学方程式:
氧化还原反应
非氧化还原反应
(6)若有⑨和⑩两种固体混合物
 ,加入足量的盐酸充分反应,可以得到
,加入足量的盐酸充分反应,可以得到 的气体(标准状况),则该混合物中两种固体的物质的量比为⑨∶⑩=
的气体(标准状况),则该混合物中两种固体的物质的量比为⑨∶⑩=
您最近一年使用:0次
名校
解题方法
10 . 按要求完成下列填空:
(1) 溶液分别恰好使相同体积的硫酸铁、硫酸铜两种溶液中的
溶液分别恰好使相同体积的硫酸铁、硫酸铜两种溶液中的 完全转化成沉淀,则硫酸铁、硫酸铜两种溶液的物质的量浓度之比是
完全转化成沉淀,则硫酸铁、硫酸铜两种溶液的物质的量浓度之比是___________ 。
(2)某物质 加热时按化学方程式
加热时按化学方程式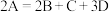 分解,产物均为气体,测得相同条件下由生成物组成的混合物气体对
分解,产物均为气体,测得相同条件下由生成物组成的混合物气体对 的相对密度为20,则反应物
的相对密度为20,则反应物 的相对分子质量为
的相对分子质量为___________ 。
(3)一定量的液态化合物 ,在一定量
,在一定量 中恰好完全反应:
中恰好完全反应: ,冷却后在标准状况下,测得生成物的体积为
,冷却后在标准状况下,测得生成物的体积为 (l表示液态,g表示气态)。
(l表示液态,g表示气态)。
①反应前 的体积是
的体积是___________  。
。
②在 分子中,
分子中, 两元素的质量比为
两元素的质量比为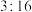 ,则
,则 两元素的相对原子质量之比为
两元素的相对原子质量之比为______ 。
(4)向 某物质的量浓度的
某物质的量浓度的 溶液中缓慢通入一定量的
溶液中缓慢通入一定量的 充分反应后,得到
充分反应后,得到 和
和 的混合溶液,向上述所得溶液中,逐滴滴加
的混合溶液,向上述所得溶液中,逐滴滴加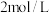 的盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
的盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
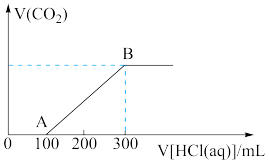
①OA段发生反应的化学方程式___________ 。
② 物质的量浓度为
物质的量浓度为___________ 。
③混合溶液中 和
和 的质量比是
的质量比是___________ 。
(1)
 溶液分别恰好使相同体积的硫酸铁、硫酸铜两种溶液中的
溶液分别恰好使相同体积的硫酸铁、硫酸铜两种溶液中的 完全转化成沉淀,则硫酸铁、硫酸铜两种溶液的物质的量浓度之比是
完全转化成沉淀,则硫酸铁、硫酸铜两种溶液的物质的量浓度之比是(2)某物质
 加热时按化学方程式
加热时按化学方程式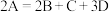 分解,产物均为气体,测得相同条件下由生成物组成的混合物气体对
分解,产物均为气体,测得相同条件下由生成物组成的混合物气体对 的相对密度为20,则反应物
的相对密度为20,则反应物 的相对分子质量为
的相对分子质量为(3)一定量的液态化合物
 ,在一定量
,在一定量 中恰好完全反应:
中恰好完全反应: ,冷却后在标准状况下,测得生成物的体积为
,冷却后在标准状况下,测得生成物的体积为 (l表示液态,g表示气态)。
(l表示液态,g表示气态)。①反应前
 的体积是
的体积是 。
。②在
 分子中,
分子中, 两元素的质量比为
两元素的质量比为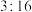 ,则
,则 两元素的相对原子质量之比为
两元素的相对原子质量之比为(4)向
 某物质的量浓度的
某物质的量浓度的 溶液中缓慢通入一定量的
溶液中缓慢通入一定量的 充分反应后,得到
充分反应后,得到 和
和 的混合溶液,向上述所得溶液中,逐滴滴加
的混合溶液,向上述所得溶液中,逐滴滴加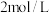 的盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
的盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
①OA段发生反应的化学方程式
②
 物质的量浓度为
物质的量浓度为③混合溶液中
 和
和 的质量比是
的质量比是
您最近一年使用:0次



